"기체"의 두 판 사이의 차이
잔글 (→같이 보기) |
|||
| (사용자 2명의 중간 판 6개는 보이지 않습니다) | |||
| 1번째 줄: | 1번째 줄: | ||
| + | [[파일:고체 액체 기체.png|썸네일|500픽셀|'''물질의 3가지 상태''']] | ||
| + | |||
'''기체'''(Gas)는 물질이 일반적으로 가질 수 있는 네 가지 상태인 [[고체]], [[액체]], 기체, [[플라스마]] 가운데 하나이다. | '''기체'''(Gas)는 물질이 일반적으로 가질 수 있는 네 가지 상태인 [[고체]], [[액체]], 기체, [[플라스마]] 가운데 하나이다. | ||
| 4번째 줄: | 6번째 줄: | ||
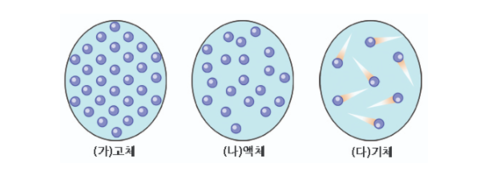
아래 그림과 같이 분자 수준에서 미시적으로 기체, 액체, 고체 상들을 비교해 보면, 고체나 액체를 이루는 분자나 원자들은 서로 매우 가까운 거리를 유지하고 있는 것이 반해, 기체를 이루는 분자나 원자들은 서로 떨어져 있으며 그 사이 거리가 매우 크다. 따라서 기체는 고체나 액체에 비해서 밀도가 매우 낮고, 일정한 형태를 가지지 않으며 압축 또는 팽창시키기도 쉽다. 기체는 또한 입자 사이의 거리가 매우 멀기 때문에, 색이 없거나 연한 색을 띄며 투명하다. | 아래 그림과 같이 분자 수준에서 미시적으로 기체, 액체, 고체 상들을 비교해 보면, 고체나 액체를 이루는 분자나 원자들은 서로 매우 가까운 거리를 유지하고 있는 것이 반해, 기체를 이루는 분자나 원자들은 서로 떨어져 있으며 그 사이 거리가 매우 크다. 따라서 기체는 고체나 액체에 비해서 밀도가 매우 낮고, 일정한 형태를 가지지 않으며 압축 또는 팽창시키기도 쉽다. 기체는 또한 입자 사이의 거리가 매우 멀기 때문에, 색이 없거나 연한 색을 띄며 투명하다. | ||
| − | + | ||
== 개요 == | == 개요 == | ||
기체(gas)라는 단어는 17세기 반 헬몬트(Jan Baptista van Helmont)가 처음 사용하였다. 아마도 카오스라는 단어와 발음이 비슷하게 만들어졌거나, 영혼이나 유령을 뜻하는 gahst (or geist)에서 유래한 것으로 추측된다. | 기체(gas)라는 단어는 17세기 반 헬몬트(Jan Baptista van Helmont)가 처음 사용하였다. 아마도 카오스라는 단어와 발음이 비슷하게 만들어졌거나, 영혼이나 유령을 뜻하는 gahst (or geist)에서 유래한 것으로 추측된다. | ||
| 10번째 줄: | 12번째 줄: | ||
기체는 불활성 원소인 [[네온]](Ne)등의 사례에서 볼 수 있듯이 개별 원자들로 이루어질 수도 있으으며, 한 가지 또는 다수의 원소들로 이루어진 분자들로 이루어질 수도 있다. 예를 들어 [[산소]] 기체의 경우엔 산소 원자 두 개가 결합한 산소 분자(O₂)들이 기체를 이루며, [[이산화탄소]] 기체의 경우 탄소 원자 하나와 산소 원자 두 개가 결합한 이산화탄소 분자(CO₂)들이 기체를 이룬다. 이렇게 한 종류의 원자나 분자로 이루어진 순수 기체들은 서로 섞여서 기체 혼합물을 이룰 수도 있는데, 대기가 대표적인 예이다. | 기체는 불활성 원소인 [[네온]](Ne)등의 사례에서 볼 수 있듯이 개별 원자들로 이루어질 수도 있으으며, 한 가지 또는 다수의 원소들로 이루어진 분자들로 이루어질 수도 있다. 예를 들어 [[산소]] 기체의 경우엔 산소 원자 두 개가 결합한 산소 분자(O₂)들이 기체를 이루며, [[이산화탄소]] 기체의 경우 탄소 원자 하나와 산소 원자 두 개가 결합한 이산화탄소 분자(CO₂)들이 기체를 이룬다. 이렇게 한 종류의 원자나 분자로 이루어진 순수 기체들은 서로 섞여서 기체 혼합물을 이룰 수도 있는데, 대기가 대표적인 예이다. | ||
| − | 표준 온도 압력(0 oC 1 기압, Standard Temperature and Pressure)에서 안정적인 단원자 또는 단분자 기체를 기본 기체(elemental gas)라고 부른다. [[수소]](H₂) 기체, 질소(N₂) 기체, 산소(O₂) 기체, 할로겐족인 불소(F₂) 기체, 염소(Cl₂) 기체가 단분자 기체들이며, 단원자 기체들로는 불활성 기체인 헬륨(He) 기체, 네온(Ne) 기체, 아르곤(Ar) 기체, 크립톤(Kr) 기체, 제논(Xe) 기체, 라돈(Rn) 기체가 있다. | + | 표준 온도 압력(0 oC 1 기압, Standard Temperature and Pressure)에서 안정적인 단원자 또는 단분자 기체를 기본 기체(elemental gas)라고 부른다. [[수소]](H₂) 기체, 질소(N₂) 기체, 산소(O₂) 기체, 할로겐족인 [[불소]](F₂) 기체, [[염소]](Cl₂) 기체가 단분자 기체들이며, 단원자 기체들로는 불활성 기체인 [[헬륨]](He) 기체, [[네온]](Ne) 기체, [[아르곤]](Ar) 기체, [[크립톤]](Kr) 기체, [[제논]](Xe) 기체, [[라돈]](Rn) 기체가 있다. |
매우 낮은 온도에서는 겹침 상태(degenerate state)에 있는 '''양자 기체'''(quantum gas)가 형성될 수 있으며, 양자 기체의 성질은 일반적인 상태에서 관찰되는 기체의 성질과 매우 다르다. 즉, 원자로 이루어진 기체가 매우 낮은 온도에서 매우 높은 밀도로 존재할 경우 원자의 양자역학적 성질에 따라 '''보스 기체'''(Bose gas) 또는 '''페르미 기체'''(Fermi gas)로 분류된다. | 매우 낮은 온도에서는 겹침 상태(degenerate state)에 있는 '''양자 기체'''(quantum gas)가 형성될 수 있으며, 양자 기체의 성질은 일반적인 상태에서 관찰되는 기체의 성질과 매우 다르다. 즉, 원자로 이루어진 기체가 매우 낮은 온도에서 매우 높은 밀도로 존재할 경우 원자의 양자역학적 성질에 따라 '''보스 기체'''(Bose gas) 또는 '''페르미 기체'''(Fermi gas)로 분류된다. | ||
| + | |||
| + | == 연소성에 의한 분류 == | ||
| + | === 가연성 가스 === | ||
| + | 공기 또는 산소 등과 혼합하여 점화 시에 급격한 산화반응으로 열과 빛을 수반하여 연소(폭발)을 일으키는 가스이다. 아세틸렌, 암모니아, 수소, 황화수소, 시안화수소, 일산화탄소, 메탄, 염화메탄, 에탄, 에틸렌, 산화에틸렌, 프로판, 프로필렌, 부탄, 부타 디엔, 부틸렌, 벤젠 등이 있다. | ||
| + | === 조연성 가스 === | ||
| + | 산소와 같이 다른 물질의 연소를 돕는 성질이다. 조연성 기체란 산소나 공기 등과 같이 다른 가연성 기체를 연소시킬 수 있는 기체이다. 가연성 기체는 프로판, 석탄 가스, 수소, 천연가스, 아세틸렌 등과 같이 공기(또는 산소)와 혼합하면 빛과 열을 내면서 연소하는 기체이다. | ||
| + | === 불연성 가스 === | ||
| + | 스스로 연소하지 못하며 다른 물질을 연소시키는 성질도 갖지 않으며 즉 연소와 무관한 가스이다. 수증기, 질소, 아르곤, 이산화탄소, 프레온 등이다. | ||
| + | |||
| + | '''[[리튬이온 배터리]]'''에서 발생하는 불은 산소농도가 1% 이하에서도 시작될 수 있고 열폭주 시 [[수소]]가 다량 발생하는 등 폭발 위험이 큰 것으로 나타났다. 리튬이온 배터리가 화재 3요소(가연물, 산소, 점화원) 중 산소 공급 없이도 화재가 발생하고 메탄 등 가연성 기체가 생성되면서 폭발할 위험성이 있다. 리튬이온배터리 열폭주와 발염 연소단계에서 만들어지는 가스를 분석하기 위한 실험은 NCM(니켈ㆍ코발트ㆍ망간)과 NCA(니켈ㆍ코발트ㆍ알루미늄), LFP(리튬철인산) 계열 원통형ㆍ각형ㆍ파우치형 등 리튬이온배터리 셀 단위를 대상으로 실시했다. 그 결과 산소농도가 1% 이하인 상황에서 각 배터리에 열을 가해 열폭주를 유도했더니 일부 화염이 분출되는 연소가 진행됐다. 이 과정에서 [[아세틸렌]]과 [[에틸렌]], [[메탄]], [[일산화탄소]] 등 가연성 기체가 생성됐고 특히 열폭주 시 [[수소]]가 다량 발생하는 것으로 나타났다.<ref>최누리 기자, 〈[https://www.fpn119.co.kr/150308 “산소 없어도 발생하는 리튬이온배터리 화재, 폭발 위험 커”]〉, 《FPN소방방재신문》, 2021-01-25</ref> | ||
== 거시적 성질 == | == 거시적 성질 == | ||
| + | 기체는 고체나 액체보다 대단히 가볍고, 압축하기도 쉽다. 이는 앞에서 언급한 것처럼 기체를 구성하는 입자들 사이의 거리가 매우 크기 때문이다. 기체를 이루고 있는 입자들은 공간 속을 자유롭게 날아다니고 있다. | ||
| + | |||
| + | 물질의 상태를 설명하기 위해 사용하는 상태 방정식에는 다음 변수들이 사용된다. 이들을 기체를 중심으로 살펴보면; | ||
| + | |||
| + | === 압력 === | ||
| + | 기체의 압력은 기체가 용기 벽의 단위 면적에 가하는 힘을 말한다. 보통 P 로 표시하며 SI 단위는 [[파스칼]](Pa, Pascal)이다. 표준 대기압은 1.01325 x 105 Pa로 정의한다. 일상생활에서는 기압(atm)을 단위로 사용하며, torr, psi 등 여러 가지 단위가 있다. | ||
| + | |||
| + | === 부피 === | ||
| + | 기체의 부피는 보통 V로 표시하며, SI 단위는 m³ 이지만 리터(L)도 널리 사용한다. | ||
| + | |||
| + | === 온도 === | ||
| + | 온도는 보통 T로 표시하며, 기체 분자들의 평균 운동 에너지에 해당한다. SI 단위는 절대온도 [[켈빈]](K)이다. | ||
| + | |||
| + | == 상태 방정식 == | ||
| + | [[파일:보일법칙.png|썸네일|300픽셀|오른쪽|보일 법칙]] | ||
| + | [[파일:샤를 법칙.png|썸네일|300픽셀|오른쪽|샤를 법칙]] | ||
| + | 기체 상태의 거시적 특징은 세 가지 변수, 즉 온도, 압력, 부피로 명확하게 기술할 수 있다. 이들 상태 변수 사이에는 상관관계가 존재하며, 이를 기체 상태 방정식이라고 한다. | ||
| + | |||
| + | === 보일 법칙 === | ||
| + | 1662년 로버트 보일(Robert Boyle)은 기체의 온도를 일정하게 유지하면서 압력과 부피의 곱 PV가 일정함을 발견하였다. 이 관계를 '''보일 법칙'''이라고 한다. | ||
| + | |||
| + | 일정한 온도에서 같은 양의 기체라면, 부피와 압력이 반비례하게 된다. 즉, 부피가 커지면 압력이 줄어들고 부피가 줄어들면 압력이 커지게 되는 것이다. | ||
| + | |||
| + | PV = (상수) | ||
| + | |||
| + | === 샤를 법칙 === | ||
| + | 샤를(Jacques Alexander Cesar Charles)은 1787년부터 기체의 부피와 온도의 관계를 정밀하게 측정하였다. 1802년 게이뤼샥(Joseph Louis Gay-Lussac)은 샤를의 결과를 인용하여 기체 부피는 종류에 상관없이 일정한 온도 변화에 대하여 일정하게 변한다는 것을 발견하였다. 이를 '''샤를 법칙''' 혹은 '''샤를-게이뤼삭 법칙'''이라고 한다. 샤를의 법칙은 온도가 1도씩 낮아질때마다 기체의 부피가 1/273 으로 줄어든다는 내용이다. 일정한 압력에서 기체의 온도를 높이면 부피가 증가하고 온도를 낮추면 부피가 감소한다. | ||
| + | |||
| + | '''V/T = (상수)''' | ||
| + | |||
| + | === 아보가드로 법칙 === | ||
| + | 1811년 아보가드로 (Amedeo Avogadro)는 기체는 그 종류에 관계없이 같은 부피 속에 같은 수의 기체 입자(몰수)를 포함하고 있다고 가정하였다. 그의 제안은 1858년 카니자로(Stanislao Cannizzaro)가 재발견하여 법칙으로 인정되었다. 이상 기체의 부피는 분자의 개수(몰 수)에 비례한다. | ||
| + | |||
| + | === 아보가드로수 === | ||
| + | 산소·질소·이산화탄소의 같은 부피의 무게를 비교해 보면 32:28:44가 되므로, 반대로 각 기체를 32g, 28g, 44g 취하면 그 부피는 같게 된다. 같은 조건을 만들기 위해서 0℃. 1기압을 표준 상태(NTP또는 STP)라고 한다. 표준 상태에서의 산소 1ι의 무게는 1.429g이므로, 산소 32g의 부피는 22.4ι이다. 같은 방법으로 질소 28g, 이산화탄소 44g의 부피를 계산하면 역시 22.4ι가 된다. 표준 상태에서 22.4ι인 기체 속의 분자의 수는 모두 같으며, 그 수는 6.02×10²³(정확히는 6.022045×10²³)이다. 이 수를 아보가드로 수라고 한다. 또, 아보가드로 수만큼의 입자의 양을 1몰(mol)이라고 한다. 즉, 산소 분자32g, 질소 분자 28g, 이산화탄소 44g이 각 물질의 1몰이 되는 것이다. 아보가드로수는 기체를 이루고 있는 입자뿐만 아니라 모든 물질의 입자수를 알아볼 때 기본이 되는 중요한 수이다. | ||
| + | |||
| + | === 이상 기체 상태 방정식 === | ||
| + | 이상 기체 방정식은 보일 법칙, 샤를 법칙, 아보가드로 법칙을 합쳐 놓은 아래 식이다. | ||
| + | |||
| + | '''PV = nRT''' | ||
| + | |||
| + | 여기서 R은 기체상수로 R = 8.314 J/K mol 이다. 이 식은 압력이 낮을수록 온도가 높을수록 정확하게 성립한다. 즉, 낮은 밀도의 기체를 기술하는 극한 법칙(limiting law)에 해당한다. 이 법칙으로 기술할 수 있는 기체, 즉 PV/nRT = 1인 기체가 이상 기체라고 정의할 수도 있다. 이 비율을 압축 인자(Z)라고도 한다. | ||
| + | |||
| + | === 실제 기체 상태 방정식 === | ||
| + | 실제 기체가 이상 기체 상태 방정식에서 벗어나면 상태 방정식 역시 달라져야 한다. 모든 식은 원칙적으로 다항식으로 전개할 수 있으므로 각 항의 계수를 결정하면 상태 방정식으로 사용할 수 있다. 이를 비리알 방정식 (virial equation)이라고 한다. 1873년 반데르발스(van der Waals)는 기체 입자들 사이의 인력과 반발력을 개념을 사용하여 이상 기체 상태 방정식을 수정한 방정식을 실제 기체에 대한 상태 방정식으로 제안하기도 하였다. | ||
| + | |||
| + | == 기체 분자 운동론 == | ||
| + | 이상 기체 상태 방정식은 낮은 압력에서 기체의 여러 가지 성질들을 종합적으로 잘 설명해준다. 실험 결과에 근거한 이상 기체 상태 방정식은 기체를 이루는 미시적 분자들에 대한 기본적인 물리법칙을 적용하여 설명할 수 있다. | ||
| + | |||
| + | 기체 분자 운동론의 기본 가정은 다음과 같다. | ||
| + | |||
| + | * 기체는 많은 동일한 분자로 구성되어 있으며 분자들은 자신의 크기보다 훨씬 큰 거리를 두고 떨어져 있다. | ||
| + | * 기체 분자들은 무질서하게 끊임없이 움직이고 있다. | ||
| + | * 분자들은 충돌하는 경우를 제외하고는 상호 작용하지 않으며 등속도 직선 운동을 한다. | ||
| + | * 분자와 분자, 분자와 용기 벽과의 충돌은 완전 탄성 충돌이다. | ||
| + | |||
| + | 클라우지우스, 맥스웰, 볼츠만 등은 기체에 대해서 몇 가지 기본 가정에서 출발하여 기체의 거시적 성질을 설명할 수 있었다. 이 이론을 기체분자운동론이라고 하며 기체가 분자로 이루어져 있다는 증거이면서 근대 과학 발전의 큰 이정표가 되었다. | ||
| + | == 기체의 성질을 이용한 증기기관 == | ||
| + | 기체의 성질을 이용해서 산업의 발전이 이루어졌다는 사실 역시 빼놓을 수 없다. 농경시대에서 산업시대로 넘어가던 시기의 1차 산업혁명을 이끈 것이 증기기관이다. 증기기관의 원리가 바로 기체의 성질을 이용한 것이다. 물을 끓여서 뜨거운 수증기를 만들고, 이것이 팽창하려는 힘으로 피스톤을 밀어 기계의 구동축을 움직이게 하는 것이다. 증기기관으로 기계를 만들 수 있어 자동화 시대가 시작되었고, 증기기관차로 기차라는 운송수단을 통해 엄청난 변화를 가져올 수 있었다.<ref>한화토탈, 〈[https://www.chemi-in.com/477 기체의 성질 – (생활 속 과학 이야기 3)]〉, 《한화토탈 공식 블로그》, 2020-11-06</ref> | ||
| + | {{각주}} | ||
== 참고자료 == | == 참고자료 == | ||
* 〈[https://terms.naver.com/entry.naver?docId=5662773&cid=62802&categoryId=62802 기체]〉, 《화학백과》 | * 〈[https://terms.naver.com/entry.naver?docId=5662773&cid=62802&categoryId=62802 기체]〉, 《화학백과》 | ||
* 〈[https://terms.naver.com/entry.naver?docId=4390165&cid=60217&categoryId=60217 기체]〉, 《물리학백과》 | * 〈[https://terms.naver.com/entry.naver?docId=4390165&cid=60217&categoryId=60217 기체]〉, 《물리학백과》 | ||
* 〈[https://ko.wikipedia.org/wiki/%EA%B8%B0%EC%B2%B4 기체]〉, 《위키백과》 | * 〈[https://ko.wikipedia.org/wiki/%EA%B8%B0%EC%B2%B4 기체]〉, 《위키백과》 | ||
| + | * 최누리 기자, 〈[https://www.fpn119.co.kr/150308 “산소 없어도 발생하는 리튬이온배터리 화재, 폭발 위험 커”]〉, 《FPN소방방재신문》, 2021-01-25 | ||
== 같이 보기 == | == 같이 보기 == | ||
| 27번째 줄: | 100번째 줄: | ||
* [[플라스마]] | * [[플라스마]] | ||
| − | {{ | + | {{물질|검토 필요}} |
2022년 2월 1일 (화) 01:33 기준 최신판
기체(Gas)는 물질이 일반적으로 가질 수 있는 네 가지 상태인 고체, 액체, 기체, 플라스마 가운데 하나이다.
기체는 고체나 액체에 비해 밀도가 낮고, 일정한 모양과 부피를 갖지 않는다. 일정한 모양과 부피를 가지지 아니하기 때문에, 기체는 어떤 형태의 용기에도 넣을 수 있으며, 한번 용기 안에 들어가면 용기 안에서 기체 분자들이 확산하여 용기 안을 가득 채운다.
아래 그림과 같이 분자 수준에서 미시적으로 기체, 액체, 고체 상들을 비교해 보면, 고체나 액체를 이루는 분자나 원자들은 서로 매우 가까운 거리를 유지하고 있는 것이 반해, 기체를 이루는 분자나 원자들은 서로 떨어져 있으며 그 사이 거리가 매우 크다. 따라서 기체는 고체나 액체에 비해서 밀도가 매우 낮고, 일정한 형태를 가지지 않으며 압축 또는 팽창시키기도 쉽다. 기체는 또한 입자 사이의 거리가 매우 멀기 때문에, 색이 없거나 연한 색을 띄며 투명하다.
목차
개요[편집]
기체(gas)라는 단어는 17세기 반 헬몬트(Jan Baptista van Helmont)가 처음 사용하였다. 아마도 카오스라는 단어와 발음이 비슷하게 만들어졌거나, 영혼이나 유령을 뜻하는 gahst (or geist)에서 유래한 것으로 추측된다.
기체는 불활성 원소인 네온(Ne)등의 사례에서 볼 수 있듯이 개별 원자들로 이루어질 수도 있으으며, 한 가지 또는 다수의 원소들로 이루어진 분자들로 이루어질 수도 있다. 예를 들어 산소 기체의 경우엔 산소 원자 두 개가 결합한 산소 분자(O₂)들이 기체를 이루며, 이산화탄소 기체의 경우 탄소 원자 하나와 산소 원자 두 개가 결합한 이산화탄소 분자(CO₂)들이 기체를 이룬다. 이렇게 한 종류의 원자나 분자로 이루어진 순수 기체들은 서로 섞여서 기체 혼합물을 이룰 수도 있는데, 대기가 대표적인 예이다.
표준 온도 압력(0 oC 1 기압, Standard Temperature and Pressure)에서 안정적인 단원자 또는 단분자 기체를 기본 기체(elemental gas)라고 부른다. 수소(H₂) 기체, 질소(N₂) 기체, 산소(O₂) 기체, 할로겐족인 불소(F₂) 기체, 염소(Cl₂) 기체가 단분자 기체들이며, 단원자 기체들로는 불활성 기체인 헬륨(He) 기체, 네온(Ne) 기체, 아르곤(Ar) 기체, 크립톤(Kr) 기체, 제논(Xe) 기체, 라돈(Rn) 기체가 있다.
매우 낮은 온도에서는 겹침 상태(degenerate state)에 있는 양자 기체(quantum gas)가 형성될 수 있으며, 양자 기체의 성질은 일반적인 상태에서 관찰되는 기체의 성질과 매우 다르다. 즉, 원자로 이루어진 기체가 매우 낮은 온도에서 매우 높은 밀도로 존재할 경우 원자의 양자역학적 성질에 따라 보스 기체(Bose gas) 또는 페르미 기체(Fermi gas)로 분류된다.
연소성에 의한 분류[편집]
가연성 가스[편집]
공기 또는 산소 등과 혼합하여 점화 시에 급격한 산화반응으로 열과 빛을 수반하여 연소(폭발)을 일으키는 가스이다. 아세틸렌, 암모니아, 수소, 황화수소, 시안화수소, 일산화탄소, 메탄, 염화메탄, 에탄, 에틸렌, 산화에틸렌, 프로판, 프로필렌, 부탄, 부타 디엔, 부틸렌, 벤젠 등이 있다.
조연성 가스[편집]
산소와 같이 다른 물질의 연소를 돕는 성질이다. 조연성 기체란 산소나 공기 등과 같이 다른 가연성 기체를 연소시킬 수 있는 기체이다. 가연성 기체는 프로판, 석탄 가스, 수소, 천연가스, 아세틸렌 등과 같이 공기(또는 산소)와 혼합하면 빛과 열을 내면서 연소하는 기체이다.
불연성 가스[편집]
스스로 연소하지 못하며 다른 물질을 연소시키는 성질도 갖지 않으며 즉 연소와 무관한 가스이다. 수증기, 질소, 아르곤, 이산화탄소, 프레온 등이다.
리튬이온 배터리에서 발생하는 불은 산소농도가 1% 이하에서도 시작될 수 있고 열폭주 시 수소가 다량 발생하는 등 폭발 위험이 큰 것으로 나타났다. 리튬이온 배터리가 화재 3요소(가연물, 산소, 점화원) 중 산소 공급 없이도 화재가 발생하고 메탄 등 가연성 기체가 생성되면서 폭발할 위험성이 있다. 리튬이온배터리 열폭주와 발염 연소단계에서 만들어지는 가스를 분석하기 위한 실험은 NCM(니켈ㆍ코발트ㆍ망간)과 NCA(니켈ㆍ코발트ㆍ알루미늄), LFP(리튬철인산) 계열 원통형ㆍ각형ㆍ파우치형 등 리튬이온배터리 셀 단위를 대상으로 실시했다. 그 결과 산소농도가 1% 이하인 상황에서 각 배터리에 열을 가해 열폭주를 유도했더니 일부 화염이 분출되는 연소가 진행됐다. 이 과정에서 아세틸렌과 에틸렌, 메탄, 일산화탄소 등 가연성 기체가 생성됐고 특히 열폭주 시 수소가 다량 발생하는 것으로 나타났다.[1]
거시적 성질[편집]
기체는 고체나 액체보다 대단히 가볍고, 압축하기도 쉽다. 이는 앞에서 언급한 것처럼 기체를 구성하는 입자들 사이의 거리가 매우 크기 때문이다. 기체를 이루고 있는 입자들은 공간 속을 자유롭게 날아다니고 있다.
물질의 상태를 설명하기 위해 사용하는 상태 방정식에는 다음 변수들이 사용된다. 이들을 기체를 중심으로 살펴보면;
압력[편집]
기체의 압력은 기체가 용기 벽의 단위 면적에 가하는 힘을 말한다. 보통 P 로 표시하며 SI 단위는 파스칼(Pa, Pascal)이다. 표준 대기압은 1.01325 x 105 Pa로 정의한다. 일상생활에서는 기압(atm)을 단위로 사용하며, torr, psi 등 여러 가지 단위가 있다.
부피[편집]
기체의 부피는 보통 V로 표시하며, SI 단위는 m³ 이지만 리터(L)도 널리 사용한다.
온도[편집]
온도는 보통 T로 표시하며, 기체 분자들의 평균 운동 에너지에 해당한다. SI 단위는 절대온도 켈빈(K)이다.
상태 방정식[편집]
기체 상태의 거시적 특징은 세 가지 변수, 즉 온도, 압력, 부피로 명확하게 기술할 수 있다. 이들 상태 변수 사이에는 상관관계가 존재하며, 이를 기체 상태 방정식이라고 한다.
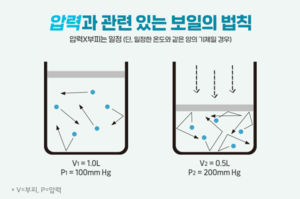
보일 법칙[편집]
1662년 로버트 보일(Robert Boyle)은 기체의 온도를 일정하게 유지하면서 압력과 부피의 곱 PV가 일정함을 발견하였다. 이 관계를 보일 법칙이라고 한다.
일정한 온도에서 같은 양의 기체라면, 부피와 압력이 반비례하게 된다. 즉, 부피가 커지면 압력이 줄어들고 부피가 줄어들면 압력이 커지게 되는 것이다.
PV = (상수)
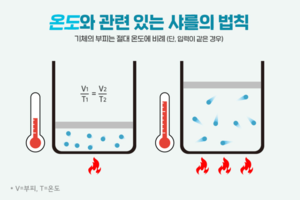
샤를 법칙[편집]
샤를(Jacques Alexander Cesar Charles)은 1787년부터 기체의 부피와 온도의 관계를 정밀하게 측정하였다. 1802년 게이뤼샥(Joseph Louis Gay-Lussac)은 샤를의 결과를 인용하여 기체 부피는 종류에 상관없이 일정한 온도 변화에 대하여 일정하게 변한다는 것을 발견하였다. 이를 샤를 법칙 혹은 샤를-게이뤼삭 법칙이라고 한다. 샤를의 법칙은 온도가 1도씩 낮아질때마다 기체의 부피가 1/273 으로 줄어든다는 내용이다. 일정한 압력에서 기체의 온도를 높이면 부피가 증가하고 온도를 낮추면 부피가 감소한다.
V/T = (상수)
아보가드로 법칙[편집]
1811년 아보가드로 (Amedeo Avogadro)는 기체는 그 종류에 관계없이 같은 부피 속에 같은 수의 기체 입자(몰수)를 포함하고 있다고 가정하였다. 그의 제안은 1858년 카니자로(Stanislao Cannizzaro)가 재발견하여 법칙으로 인정되었다. 이상 기체의 부피는 분자의 개수(몰 수)에 비례한다.
아보가드로수[편집]
산소·질소·이산화탄소의 같은 부피의 무게를 비교해 보면 32:28:44가 되므로, 반대로 각 기체를 32g, 28g, 44g 취하면 그 부피는 같게 된다. 같은 조건을 만들기 위해서 0℃. 1기압을 표준 상태(NTP또는 STP)라고 한다. 표준 상태에서의 산소 1ι의 무게는 1.429g이므로, 산소 32g의 부피는 22.4ι이다. 같은 방법으로 질소 28g, 이산화탄소 44g의 부피를 계산하면 역시 22.4ι가 된다. 표준 상태에서 22.4ι인 기체 속의 분자의 수는 모두 같으며, 그 수는 6.02×10²³(정확히는 6.022045×10²³)이다. 이 수를 아보가드로 수라고 한다. 또, 아보가드로 수만큼의 입자의 양을 1몰(mol)이라고 한다. 즉, 산소 분자32g, 질소 분자 28g, 이산화탄소 44g이 각 물질의 1몰이 되는 것이다. 아보가드로수는 기체를 이루고 있는 입자뿐만 아니라 모든 물질의 입자수를 알아볼 때 기본이 되는 중요한 수이다.
이상 기체 상태 방정식[편집]
이상 기체 방정식은 보일 법칙, 샤를 법칙, 아보가드로 법칙을 합쳐 놓은 아래 식이다.
PV = nRT
여기서 R은 기체상수로 R = 8.314 J/K mol 이다. 이 식은 압력이 낮을수록 온도가 높을수록 정확하게 성립한다. 즉, 낮은 밀도의 기체를 기술하는 극한 법칙(limiting law)에 해당한다. 이 법칙으로 기술할 수 있는 기체, 즉 PV/nRT = 1인 기체가 이상 기체라고 정의할 수도 있다. 이 비율을 압축 인자(Z)라고도 한다.
실제 기체 상태 방정식[편집]
실제 기체가 이상 기체 상태 방정식에서 벗어나면 상태 방정식 역시 달라져야 한다. 모든 식은 원칙적으로 다항식으로 전개할 수 있으므로 각 항의 계수를 결정하면 상태 방정식으로 사용할 수 있다. 이를 비리알 방정식 (virial equation)이라고 한다. 1873년 반데르발스(van der Waals)는 기체 입자들 사이의 인력과 반발력을 개념을 사용하여 이상 기체 상태 방정식을 수정한 방정식을 실제 기체에 대한 상태 방정식으로 제안하기도 하였다.
기체 분자 운동론[편집]
이상 기체 상태 방정식은 낮은 압력에서 기체의 여러 가지 성질들을 종합적으로 잘 설명해준다. 실험 결과에 근거한 이상 기체 상태 방정식은 기체를 이루는 미시적 분자들에 대한 기본적인 물리법칙을 적용하여 설명할 수 있다.
기체 분자 운동론의 기본 가정은 다음과 같다.
- 기체는 많은 동일한 분자로 구성되어 있으며 분자들은 자신의 크기보다 훨씬 큰 거리를 두고 떨어져 있다.
- 기체 분자들은 무질서하게 끊임없이 움직이고 있다.
- 분자들은 충돌하는 경우를 제외하고는 상호 작용하지 않으며 등속도 직선 운동을 한다.
- 분자와 분자, 분자와 용기 벽과의 충돌은 완전 탄성 충돌이다.
클라우지우스, 맥스웰, 볼츠만 등은 기체에 대해서 몇 가지 기본 가정에서 출발하여 기체의 거시적 성질을 설명할 수 있었다. 이 이론을 기체분자운동론이라고 하며 기체가 분자로 이루어져 있다는 증거이면서 근대 과학 발전의 큰 이정표가 되었다.
기체의 성질을 이용한 증기기관[편집]
기체의 성질을 이용해서 산업의 발전이 이루어졌다는 사실 역시 빼놓을 수 없다. 농경시대에서 산업시대로 넘어가던 시기의 1차 산업혁명을 이끈 것이 증기기관이다. 증기기관의 원리가 바로 기체의 성질을 이용한 것이다. 물을 끓여서 뜨거운 수증기를 만들고, 이것이 팽창하려는 힘으로 피스톤을 밀어 기계의 구동축을 움직이게 하는 것이다. 증기기관으로 기계를 만들 수 있어 자동화 시대가 시작되었고, 증기기관차로 기차라는 운송수단을 통해 엄청난 변화를 가져올 수 있었다.[2]
각주[편집]
- ↑ 최누리 기자, 〈“산소 없어도 발생하는 리튬이온배터리 화재, 폭발 위험 커”〉, 《FPN소방방재신문》, 2021-01-25
- ↑ 한화토탈, 〈기체의 성질 – (생활 속 과학 이야기 3)〉, 《한화토탈 공식 블로그》, 2020-11-06
참고자료[편집]
- 〈기체〉, 《화학백과》
- 〈기체〉, 《물리학백과》
- 〈기체〉, 《위키백과》
- 최누리 기자, 〈“산소 없어도 발생하는 리튬이온배터리 화재, 폭발 위험 커”〉, 《FPN소방방재신문》, 2021-01-25
같이 보기[편집]
| ||||||||||||||||||||||||||||||

 위키원
위키원