"전해질"의 두 판 사이의 차이
잔글 (→같이 보기) |
잔글 (→참고자료) |
||
| 41번째 줄: | 41번째 줄: | ||
{{각주}} | {{각주}} | ||
| + | == :{|class=wikitable width=800 | ||
| + | !align=center rowspan=2| | ||
| + | !align=center colspan=2|액체 | ||
| + | !align=center|겔 폴리머 | ||
| + | !align=center colspan=2|고체 | ||
| + | |- | ||
| + | !align=center|유기 전해질 | ||
| + | !align=center|이온성 액체 | ||
| + | !align=center|전해질 | ||
| + | !align=center|폴리머 전해질 | ||
| + | !align=center|무기 전해질 | ||
| + | |- | ||
| + | |align=center|구성 | ||
| + | |align=center|유기용매 + 리튬염 | ||
| + | |align=center|이온성 액체 + 리튬염 | ||
| + | |align=center|폴리머 + 유기용매 + 리튬염 | ||
| + | |align=center|폴리머(가교제 + 가소제) + 리튬염 | ||
| + | |align=center|황화계 | ||
| + | 산화계 | ||
| + | |- | ||
| + | |align=center|이온전도도 | ||
| + | |align=center|~10-2S/cm | ||
| + | |align=center|~10-3S/cm | ||
| + | |align=center|~10-3S/cm | ||
| + | |align=center|~10-5S/cm | ||
| + | |align=center|~10-3S/cm | ||
| + | |- | ||
| + | |align=center|저온특성 | ||
| + | |align=center|좋음 | ||
| + | |align=center|좋음 | ||
| + | |align=center|좋음 | ||
| + | |align=center|나쁨 | ||
| + | |align=center|좋음 | ||
| + | |- | ||
| + | |align=center|고온안정성 | ||
| + | |align=center|나쁨 | ||
| + | |align=center|아주 좋음 | ||
| + | |align=center|좋음 | ||
| + | |align=center|아주 좋음 | ||
| + | |align=center|아주 좋음 | ||
| + | |} | ||
| + | |||
== 참고자료 == | == 참고자료 == | ||
* 〈[https://ko.wikipedia.org/wiki/%EC%A0%84%ED%95%B4%EC%A7%88 전해질]〉, 《위키백과》 | * 〈[https://ko.wikipedia.org/wiki/%EC%A0%84%ED%95%B4%EC%A7%88 전해질]〉, 《위키백과》 | ||
2023년 5월 31일 (수) 16:14 판
전해질(電解質, electrolyte)은 양극과 음극 사이를 오가며 전기화학 반응이 원활하도록 리튬이온(Li+)의 이동이 일어나는 매체이다. 전해질은 다시 세분화해서 현재 상업화된 리튬이온 배터리에 적용되는 유기용매와 리튬염 그리고 첨가제로 구성되는 액체전해질, 향후 리튬2차전지의 셀 안정성을 획기적으로 강화하고 분리막을 대체할 수 있을 것으로 기대되는 고체 전해질, 기존 액체전해질과 향후 고체전해질의 중간단계 기술로 적용되는 젤(Gel) 폴리머 전해질 등으로 정의할 수 있다.
아래에 서술하는 전해질은 리튬이온배터리에 적용되는 액체전해질이다.
개요
전해질은 수용액 상태에서 이온으로 쪼개져 전류가 흐르는 물질이다. 대표적인 전해질로는 염화나트륨, 황산, 염산, 수산화나트륨, 수산화칼륨, 질산나트륨 등이 있다. 염화나트륨은 고체 상태에서는 전류를 흘려 보내지 않아 도체가 될 수 없지만, 수용액 상태에서는 전류를 흘려 보내서 전해질이 될 수 있다. 강한 산과 염기나 가용성 염은 강한 전해질이 되고, 약한 산과 염기는 약한 전해질이 된다. 반대로 이온으로 나누어지지 않아서 전류가 통하지 않는 물질을 비전해질이라 한다.
전해질은 배터리의 4대 소재중 하나이다. 배터리에서 리튬이온이 양극(+)과 음극(-)을 오가며 충·방전할 수 있도록 돕는 물질이 전해질이다. 현재 리튬이온 배터리의 경우 전해질이 액체다보니 전해액이라고도 부른다. 전해액은 양극과 음극의 표면을 안정화하는 동시에 배터리의 수명이나 특성을 향상시킨다.
전해액은 △리튬이온이 이동하는 통로 역할을 하는 염 △염을 잘 녹여 리튬이 원활하게 이동할 수 있도록 돕는 용매 △용매가 분해되지 않도록 먼저 분해돼 양·음극 표면에 보호막을 형성하는 첨가제 등으로 구성된다. 리튬이온 배터리에 공통적으로 적용되는 염은 리튬·인산·불소로 구성된 LiPF6이다. 이는 이온이동도나 용해도, 화학적 안정성이 높다는 특성이 있다.
용매는 이온 화합물을 분리시켜주는 유전상수가 높아야 하고 리튬이 원활하게 이동할 수 있도록 점도가 낮아야 한다. 현재 주로 에틸렌 카보네이트(EC)가 쓰인다. 첨가제의 경우 고온에서의 성능과 수명을 개선하고자 비닐렌 카보네이트(VC), 플루오르 에틸렌 카보네이트(FEC) 등이 사용된다.[1]
상세
가장 대중적인 전해질은 LiPF6로써 소형 IT용 2차전지 등에 주로 사용된다. 일반적으로 전기차용 전해질은 LiPF6 15%에 더해 LiFSI(F 전해질), LiPO2 F2(P 전해질), LiDFOP(D 전해질), LiBOB(B 전해질) 등이 5% 가량 추가된다.
LiPF6가 단독으로 적용되었을 경우와 비교해 보았을 때 ① 배터리 수명 ②충방전 효율 ③ 과충전 방지 능력 ③ 저온에서의 방전 억제율에서 큰 폭의 개선을 기대해 볼 수 있기 때문이다.
LiFSIF 전해질
먼저 LiFSI(F 전해질)는 배터리 수명 향상, 저온 환경에서의 방전 억제 효과가 있다.
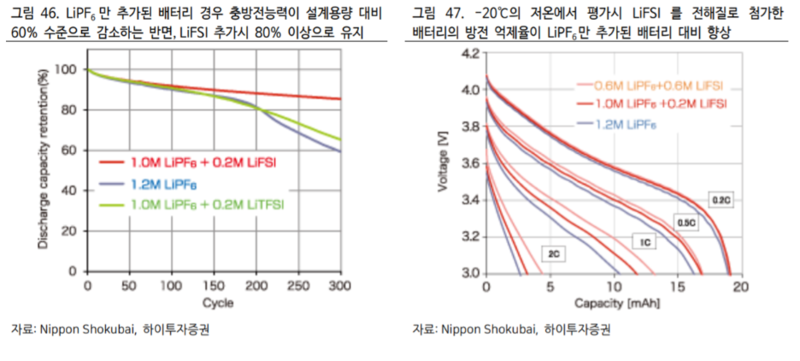
일본의 Nippon Shokubai 사의 실험결과에 따르면 총 300 회의 충방전을 반복하였을 때 순수하게 LiPF6만 사용된 배터리의 경우 잔여 충방전능력이 설계용량 대비 60% 수준으로 감소하는 반면 LiFSI를 추가하였을 때는 80%이상으로 유지되었다. (아래 그림 46 참조)
동사에서 실시한 -20℃ 저온 환경에서의 방전 억제율 실험 결과에서도 LiFSI를 추가 했을 때의 결과가 순수 LiPF6 대비 우수했음을 확인할 수 있다. (위 그림47 참조). 양극: LiNi13Co13Mn13O2, 음극: 흑연 사용 화학적 성질 측면에서도 LiFSI의 이온전도도가 98mS/cm 으로 LiPF6의 80mS/cm 대비 우월하기 때문에 충방전 속도 개선에도 일부 기여 가능하다.
LiPO2F2 P 전해질
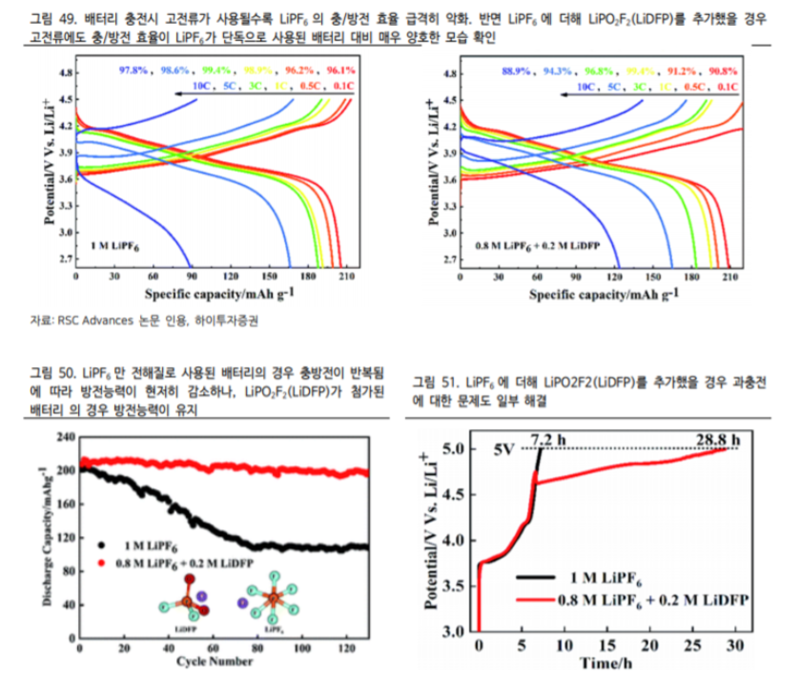
LiPO2F2 P 전해질는 첨가제 형태로 1-2% 소량 사용되는데 적은 용량에도 배터리 성능 개선에 크게 기여한다 이는 올해 발간된 RSC Advances 저널에 게시된 논문에 자세히 기술되어 있다(그림 49~51 참조).
동 논문은 LiPF6와 LiDFP의 혼합체를 NCM811 배터리에 전해질로 적용한 연구결과를 담고 있다. 연구를 통해 Lili Liu 등 5 명의 연구진이 내린 결론은 LiPO2F2 가 ① 전해질의 점도를 낮추어 이온 전도도를 향상시키고 ② 높은 전압에서의 배터리 수명을 개선시키며 ③ 전해질의 분해속도를 늦춘다는 것이었다. 이러한 성능 개선 효과뿐만 아니라 음극의 산화 방지 효과도 갖추고 있어 LiPF6와 더불어 주요 범용 전해질로 사용되고 있다.
LiDFOPD 전해질
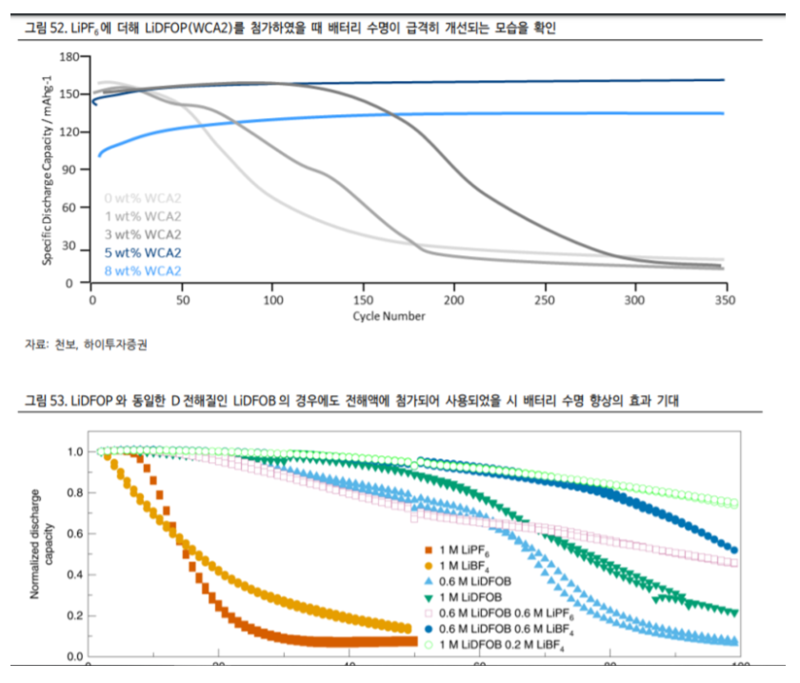
LiDFOPD 전해질도 첨가제 형태로 5% 첨가 되었을 때 효율이 가장 우수한데 ① 배터리 수명 향상 ② 출력 개선 및 ③ 충전시간 단축 ④ 고온 안정성 개선의 효과가 있다.(그림 52,53 참조)
전극 표면에 SEI를 형성하는데 도움을 준다는 점이 수명 개선의 주요 이유이다. LiDFOP는 일본 화학업체가 특허를 보유하고 독점 생산하고 있는 제품이었으나 국내 업체 중에서 천보가 상호 기술을 제휴하여 지난 2019 년말 250tpa 규모의 전용 공장을 준공한 이후 현재 생산 중이다. 최근 MercedesBenz 기아 니로 BEV에 적용되었으며 이어 추가적으로 많은 전기차에 확대 적용될 것으로 전망한다.
LIBOBB 전해질
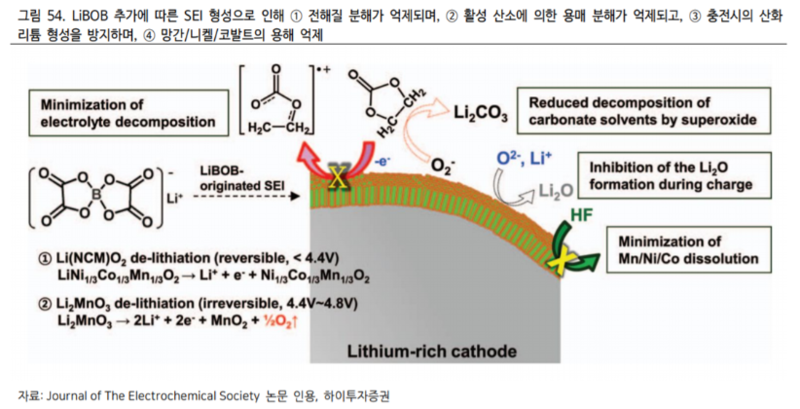
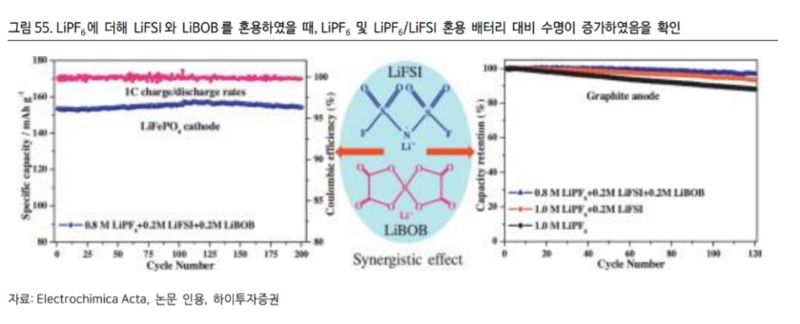
LIBOBB 전해질은 LiPF6와 혼용되었을 때 ① 배터리 안정성 개선 ② 상온 및 저온 출력 증대 및 ③ 순간 출력 향상 ④ 수명 개선의 효과가 있다 지난 2014 년 Journal of The Electrochemical Society 저널에 게시된 논문에 따르면 LiBOB를 추가하였을 때 형성되는 SEI로 인해 ① 전해질 분해가 억제되며 ② 활성 산소에 의한 용매 분해가 억제되고 ③ 충전시의 산화리튬 형성을 방지하며 ④ 망간니켈코발트의 용해가 억제되는 것으로 밝혀졌다. (그림 54 참조)
또한 마찬가지로 지난 2014 년 Electrochimica Acta 에 게시된 논문에 따르면 LiBOB를 LiPF6와 혼용하였을 때 배터리 수명이 극적으로 개선됨을 확인할 수 있다.(그림 55 참조)[2]
각주
- ↑ 경계영 기자, 〈(배터리 인사이드)④리튬이온 이동 돕는 전해질〉, 《이데일리》, 2020-10-03
- ↑ 뜨리스땅, 〈2차 전지 기술 탐구: 전해질〉, 《티스토리》, 2020-08-11
== :{|class=wikitable width=800 !align=center rowspan=2| !align=center colspan=2|액체 !align=center|겔 폴리머 !align=center colspan=2|고체 |- !align=center|유기 전해질 !align=center|이온성 액체 !align=center|전해질 !align=center|폴리머 전해질 !align=center|무기 전해질 |- |align=center|구성 |align=center|유기용매 + 리튬염 |align=center|이온성 액체 + 리튬염 |align=center|폴리머 + 유기용매 + 리튬염 |align=center|폴리머(가교제 + 가소제) + 리튬염 |align=center|황화계 산화계 |- |align=center|이온전도도 |align=center|~10-2S/cm |align=center|~10-3S/cm |align=center|~10-3S/cm |align=center|~10-5S/cm |align=center|~10-3S/cm |- |align=center|저온특성 |align=center|좋음 |align=center|좋음 |align=center|좋음 |align=center|나쁨 |align=center|좋음 |- |align=center|고온안정성 |align=center|나쁨 |align=center|아주 좋음 |align=center|좋음 |align=center|아주 좋음 |align=center|아주 좋음 |}
참고자료
- 〈전해질〉, 《위키백과》
- 경계영 기자, 〈(배터리 인사이드)④리튬이온 이동 돕는 전해질〉, 《이데일리》, 2020-10-03
- 뜨리스땅, 〈2차 전지 기술 탐구: 전해질〉, 《티스토리》, 2020-08-11
같이 보기

 위키원
위키원