알루미늄
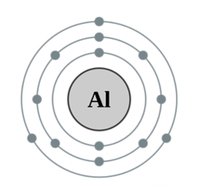
알루미늄(Aluminum)은 주기율표에서 원자 번호 13번에 해당하는 화학 원소이다. 알루미늄의 원소 기호는 Al, 원자량은 26.981g/mol, 녹는점은 660.32℃, 끓는점 2519℃, 밀도는 2.7g/cm3이다. 알루미늄은 은백색의 가볍고 무른 금속으로. 지각 구성 원소로 8%를 차지하며 이는 철보다도 많은 양이며, 산소와 규소 다음으로 세번 째 많은 양이다.
알루미늄은 금속 중 밀도가 낮은 금속에 속한다. 순수한 알루미늄은 반응성이 매우 좋다. 표면에서 발생하는 부동화(passivation) 현상으로 인해 외부 환경에 따른 부식에 저항성을 가진다. 금속공학 분야에서 알루미늄의 가장 큰 가치는 강도나 외관이 아닌 가벼움이다. 가볍고 연성이 높아 공정이 쉬우며 다양한 금속들과 합금을 형성한다. 따라서 다양한 물성의 금속 소재들을 구현 가능하다는 측면에서 널리 사용된다. 일상생활에서 흔히 발견되는 값싼 제품들에서부터 고부가가치의 제품들에 이르기까지 다양한 곳에 알루미늄이 사용되고 있다.
알루미늄은 수산화 알루미늄이 풍부하게 들어 있는 철반석(bauxite) 암석에서 전기화학을 통해 정제하여 얻는다. 정제 과정 중 얻게 되는 산화알루미늄은 섭씨 2000도가 넘는 고온에서 녹으며 불 속에서도 산소가 쉽게 떨어지지 않는다. 알루미늄을 환원시킬 수 있으면서 공정에 적합한 가격을 가지는 물질이 없었기 때문에 전기분해 방법이 개발되었다. 이러한 정제 기술이 개발되기 전에는 흙 속의 은이라고 불릴 만큼 귀한 금속이었으며 금보다 비쌌다. 알루미늄의 가격을 획기적으로 낮춘 전기분해 제련법은 1886년 미국의 화학자 찰스 마틴 홀과 프랑스의 화학자 폴 루이 투생 에루가 각각 발견하였다. 홀과 에루는 우연한 공통점이 많은 화학자이다. 같은 해(1863년)에 태어나서 같은 해에 알루미늄 제련법을 개발하였고 같은 해(1914년)에 유명을 달리했다. 둘은 생전에 만난 적이 한 번도 없었다고 한다.
이들의 노력으로 인하여 1910년에 주석 포일이 알루미늄 포일로 대체되었다. 전기분해에 의한 알루미늄 제련법 개발에 따라 전기는 알루미늄 생산에 필수적이다. 1970년 석유파동이 오면서 알루미늄 제련소가 북반구에서 남반구로 옮겨갔으며 대표적인 나라가 브라질이다. 브라질의 알루미늄 산업은 아마존 열대우림을 위협하는 큰 장애물로 여겨지고 있다. 알려지기로 전 세계 전체 생산되는 전기의 3% 이상이 알루미늄 제련에 사용된다고 한다.
알루미늄은 많은 경우 온전히 재활용이 가능한 금속이다. 재활용 과정에서 알루미늄 조각들을 녹이는데 사용되는 에너지는 광물에서 알루미늄을 생산하는 에너지에 비해 대략 5% 수준으로 알려져 있다. 이러한 이유로 선진국에서는 알루미늄의 재활용을 적극 권장하고 있다. 유럽의 경우 알루미늄의 재활용률이 매우 높다. 예로써 음료 캔의 경우 약 40%, 건축자재의 경우 85%, 운송수단(차량, 선박, 기차 등)에서는 90% 이상의 알루미늄 재활용률을 보임이 보고된 적이 있다.
원소 구조
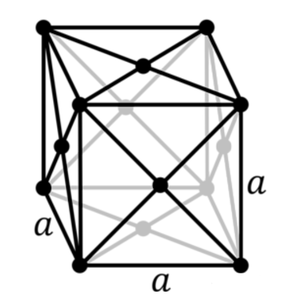
알루미늄은 13개의 전자를 가지며 비활성 기체 대비 3개의 전자를 더 가지고 있다. 전자 배치는 다음과 같다: [Ne]3s²3p¹. 따라서 3개의 전자를 제거하기 위한 각각의 이온화 에너지보다 4번째 전자를 제거하기 위한 이온화 에너지가 더 높다. 폴링의 전기음성도에 따르면 1.61의 전기음성도를 가진다. 중성 상태의 알루미늄은 143 pm의 원자 반지름을 가지며 산화되어 전자를 잃게 되면 그 반지름이 39 pm까지 줄어든다. 표준상태에서 순수한 알루미늄은 면심입방 결정 구조[face-centered cubic (fcc) crystal structure]를 가진다.
알루미늄과 전기차
알루미늄은 최근 태양광 모듈을 구성하는 틀과 각 태양광 패널들을 고정하는 구조물 등에 쓰이는 소재로 주목받고 있다. 풍력에서도 '나셀(Nacelle)'이라고 하는 회전력을 전기 에너지로 전환하는 발전 장비와 풍력 타워를 구성하는 물질로 쓰이고 있다. 전기차에도 내연차의 4배 이상의 알루미늄이 사용된다. 최근 각광 받는 전기차와 신재생 발전 설비 도입으로 수요 급증이 예상된다는 의미다.
자동차 업계에서 차량 경량화 기술에 대한 요구가 증가하고 있는 가운데, 알루미늄 소재는 기존 철강 강판의 1/3 무게로 강성과 안전성까지 갖춘 가장 적합한 대체 재로 주목 받고 있다. 알루미늄 압연 제품 제조기업 노벨리스의 발표에 따르면, 미국 자동차 제조업체 포드(Ford)의 F-150 픽업트럭의 경우 전체 차체 내 알루미늄을 92%, 철강을 8% 비율로 사용해 기존 모델보다 중량을 300 kg 이상 줄였다. LS전선은 알루미늄으로 전선을 만들고 있다. 알루미늄 도체 전선은 기존 구리 전선보다 40% 이상 가볍다. 전기차 1대에 들어가는 전선의 무게는 25㎏ 선이다. 알루미늄 전선으로 바꾸면 15㎏ 안팎까지 무게가 줄어든다. 일본 전장업계에서도 알루미늄 전선 생산라인을 구축하고 있다. 리튬 하이니켈 배터리의 일종으로 니켈과 코발트에 알루미늄을 추가한 NCA배터리와 니켈·코발트·망가니즈·알루미늄을 사용한 4원계 리튬 하이니켈 배터리인 NCMA배터리가 있다. UNIST 조재필 교수팀은 전기차에 적용 시 알루미늄 1kg으로 700km거리 운행할 수 있는 [[알루미늄 공기 흐름 전지 기술을 개발했다.
글로벌 컨설팅 업체 더커 월드와이드가 2017년 7월 발표한 리포트에 따르면, 향후 10년간 북미 자동차 시장 내 경량 트럭 및 SUV, 전기차 부분을 중심으로 알루미늄 소재 도입이 급속히 확대될 것으로 예측된다. 북미 시장의 경우 2020년까지 자동차용 알루미늄 수요는 2012년 대비 60% 성장한 약 398만 톤에 달하고, 2028년까지 차량당 평균 알루미늄 도입량은 256 kg 수준이 될 것으로 예측된다.[1] [2] [3] [4]
역사
알루미늄은 산소와 규소 다음으로 지구상에 많은 원소이나 알루미늄의 비교적 큰 산화성 때문에 다른 금속에 비해 늦게 분리되었다. 고대에는 산화알루미늄 등의 산화물 형태로 알려져 있다가 전기분해로 정제기술이 개발되면서 18세기 때 처음으로 순수하게 분리되었다. 1825년 덴마크 화학자인 한스 크리스티안 외른스테드에 의해 발견되었으며 알루미늄(Al)은 라틴어인 alumen(alum)에서 유래하였다.
동위원소
자연계에서 존재하는 알루미늄의 동위 원소로는 ²⁷Al이 100% 존재하고 있으며 핵융합 과정을 통하여 형성된 원소이다.
²³Na + ⁴He → ²⁷Al
자연계에서 미량으로 존재하는 ²⁶Al은 우주 광선을 통해 생성되며 반감기는 71만 7천 년이다. 생성과정은 우주에서 강한 우주 광선으로 인해 속도가 매우 빠른 양성자가 날아와 ²⁶Mg의 중성자 한개를 방출하고 대신 양성자 한개가 들어가서 결합되면서 생성된다.
지금은 우주선으로 인해 미량 생성되므로 ²⁷Al의 10 과거 태양계 역사 초기에 매우 풍부하게 존재했다.
¹⁴N + ⁴He → ¹⁸F
¹⁸F + ⁴He → ²²Na
²²Na + ⁴He → ²⁶Al
왜냐하면 ²⁶Al은 항성의 핵융합 과정을 통하여 생성된 원소이며 현재 지구상에 매우 풍부하게 존재하는 ²⁶Mg에 그 증거가 있다. 과거 ²⁶Al은 초창기 지구에 많이 존재했던 ⁶⁰Fe과 함께 지구의 용암 바다의 오랜 기간 유지와 태양계 초창기 역사에 중요한 역할을 한 원소이다. 지금은 비록 우주 광선을 통하여 매우 미량으로 존재하고 있지만 ²⁶Al의 태양계 초창기 역사에 매우 많은 양이 존재했었고 매우 중요한 역할을 하였다는 것과 우리 태양계에 중원소가 풍부하다는 이유로는 초신성 폭발이 존재했다는 사실은 매우 중요한 사실로 남을 것이다.
화학성 특성
²⁷Al 은 안정한 알루미늄 동위원소로 지구상에서 주로 발견된다. 다른 동위원소들은 방사성을 띤다. ²⁶Al의 경우 720,000년 정도의 반감기를 가지는 것으로 알려져 있다. 괴상 알루미늄은 다른 금속인 은(Ag)과 비슷한 외관을 가진다. 알루미늄은 금속임에도 2.70 g/cm3의 낮은 밀도를 가지며 이는 일반적인 강철에 대비하여 3분의 1 정도 수준이다.
Bulk 알루미늄은 가볍고 높은 연성을 가지며 다양한 모양으로 변형할 수 있다. 따라서 다양한 기계적 공정을 통해 원하는 모양의 제품을 개발하는데 널리 사용된다. 알루미늄은 비자성(nonmagnetic) 물질이며, 불에 연소하지 않는다. 깨끗한 알루미늄 박막은 가시광선에 높은 반사율(대략 92%)을 보이며 적외선도 일부 반사한다. 순수한 알루미늄은 7–11 MPa의 항복 강도(yield strength)를 보인다. 합금을 만들면 항복 강도를 200 에서 600 MPa까지 향상할 수 있다. 알루미늄은 상대적으로 좋은 열전도도 및 전기전도도를 보인다: 열, 전기 전도도가 좋은 원소인 구리(Cu) 대비 대략 60% 정도의 열, 전기 전도도를 보이면서 밀도는 구리의 30% 수준이다.
각주
- ↑ 편집부, 〈노벨리스, 알루미늄 소재로 국내 자동차 협업 가속〉, 《스마트앤컴퍼니》, 2019-01
- ↑ 송형석 기자, 〈더 가볍게…전기차 시대 경량화에 사활 건 소재·부품사들〉, 《한경닷컴》, 2020-09-29
- ↑ 양사록 기자, 〈탄소절감의 역설…알루미늄이 뜬다〉, 《서울경제》, 2021-07-26
- ↑ 최수상 기자, 〈알루미늄1kg으로 700km 운행...신개념 전기차 배터리 개발〉, 《파이낸셜뉴스》, 2018-09-13
참고자료
- 〈알루미늄〉, 《위키백과》
- 〈알루미늄〉, 《화학백과》
- 〈알루미늄〉, 《두산백과》
- 편집부, 〈노벨리스, 알루미늄 소재로 국내 자동차 협업 가속〉, 《스마트앤컴퍼니》, 2019-01
- 송형석 기자, 〈더 가볍게…전기차 시대 경량화에 사활 건 소재·부품사들〉, 《한경닷컴》, 2020-09-29
- 양사록 기자, 〈탄소절감의 역설…알루미늄이 뜬다〉, 《서울경제》, 2021-07-26
- 최수상 기자, 〈알루미늄1kg으로 700km 운행...신개념 전기차 배터리 개발〉, 《파이낸셜뉴스》, 2018-09-13
같이 보기

 위키원
위키원