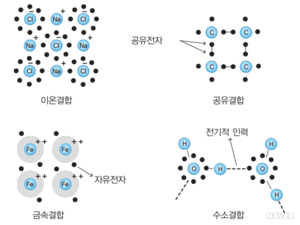
결합
결합(Bond)은 화학에서 한 화합물에 있는 원자들이 서로 잡아끌어 묶여있는 상태를 말한다. 대표적인 결합 형태로는 이온 결합, 공유 결합, 금속 결합과 수소 결합과 같은 분자간 결합 등이 있다. 결합에 참여한 공유 전자의 수효에 따라 단일-, 이중-, 삼중- 및 사중 결합으로 구별한다.
고체를 형성하기 위해서는 분자를 형성하는데 대단히 많은 수의 원자가 결합하게 되므로 결합에대한 정보는 고체의 성질을 파악하는데 중요한 역할을 한다. 이온결합의 경우는 보통 금속성과 비금속성 원소가 결합할 때 나타나고 공유결합은 보통 비금속 원소들 사이의 결합에서 나타나며 전자의 분포가 특정한 방향성을 가지게 되어 주변의 원소와 결합하게 된다. 이온결합의 대표적인 물질로는 염화나트륨(소금)이 있으며 공유결합의 대표적인 물질로는 다이아몬드가 있다.
개요[편집]
결합은 두 개 이상의 원자, 이온, 또는 분자가 물리적 또는 화학적 상호작용을 통해 서로 연결된 상태를 의미한다. 결합은 물리, 화학, 생물학 등의 다양한 분야에서 중요한 개념이며, 물질의 특성과 거동을 결정하는 중요한 역할을 한다.
결합은 다음을 가리킨다.
- 수소 결합
- 배위 결합
- 공유 결합
- 이온 결합
- 화학 결합
- 시그마 결합
- 펩타이드 결합
- 이중 결합
- 삼중 결합
- 금속 결합
- 델타 결합
- 다이설파이드 결합
- 선형결합
- 인산다이에스터 결합
- 저장벽 수소 결합
- 피 결합
주요 유형[편집]
결합은 주로 다음과 같은 유형으로 나뉜다.
- 화학결합 (Chemical Bond)
화학 결합은 원자들 간에 전자들의 공유 또는 전하 교환을 통해 형성된다. 주요 화학 결합의 종류는 다음과 같다.
- 공유 결합 (Covalent Bond): 두 원자가 전자쌍을 공유하는 결합으로, 주로 비금속 원소들 사이에서 형성된다.
- 이온 결합 (Ionic Bond): 전자를 주고받아 양이온과 음이온으로 변한 원자들이 전기적 인력으로 결합하는 방식이다. 금속과 비금속 원소 사이에서 흔히 나타난다.
- 금속 결합 (Metallic Bond): 금속 원자 간의 결합으로, 전자들이 자유롭게 움직이며 결합에 참여하는 방식이다.
- 수소 결합 (Hydrogen Bond): 수소 원자와 전기음성도가 큰 원자 사이에서 형성되는 약한 결합으로, 물 분자 간의 결합에 중요한 역할을 한다.
- 물리적 결합 (Physical Bond)
물리적 결합은 화학적 결합과 달리 원자나 분자가 직접적인 전자 교환 없이 서로 간에 상호작용하는 힘에 의해 형성된다.
- 반데르발스 결합 (Van der Waals Bond): 분자 간의 약한 전기적 인력으로 형성되는 결합으로, 분자 간 거리와 방향에 의존한다.
- 분자 결합(Molecular Bond): 분자들 간의 물리적 결합으로, 주로 비극성 분자들 사이에서 나타난다.
결합의 중요성[편집]
결합의 형성과 강도는 물질의 성질과 반응성에 큰 영향을 미친다. 예를 들어, 공유 결합은 물질에 안정성을 부여하고 이온 결합은 고체 상태에서 높은 녹는점을 가지게 한다. 수소 결합은 생체분자의 구조와 기능, 특히 단백질과 DNA의 구조를 유지하는 데 중요한 역할을 한다.
결합의 에너지와 길이[편집]
결합의 강도는 결합 에너지로, 결합의 길이는 원자 간의 거리로 표현된다. 결합 에너지가 높을수록 결합이 안정하며, 결합 길이는 두 원자의 크기와 결합의 특성에 따라 달라진다.
역사와 연구[편집]
결합의 개념은 19세기 초반에 확립되기 시작했으며, 20세기 들어 양자 역학과 전자 껍질 모델을 통해 구체화되었다. 현대 화학에서 결합 연구는 나노 기술, 재료 과학, 생화학 등 다양한 분야에 응용되고 있다.
- 관련 개념
- 결합 차수 (Bond Order): 결합의 강도를 나타내는 수치로, 예를 들어 이중 결합은 결합 차수가 2이다.
- 결합각 (Bond Angle): 결합된 원자들 간의 각도로, 분자의 입체 구조와 특성을 결정한다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원