원자
원자(原子, atom)는 일상적인 물질을 이루는 가장 작은 단위이다. 일상적인 물질들이 원소로 구성되어 있기 때문에, 이는 화학 반응을 통해 더 쪼갤 수 없는 단위와 동의어이다. 모든 고체, 액체, 기체, 플라즈마가 전부 원자로 이루어져 있다. 현대 물리학의 관점에서 볼 때 원자는 원자핵과 전자로 이루어져 있으며, 원자핵은 중성자와 양성자로 구성된다. 또 핵반응을 통해서는 더 작은 단위로 나뉜다. 원자와 혼동하기 쉬운 개념으로 '원소'를 들 수 있는데, 원자가 물질을 구성하는 기본 입자라고 한다면, 원소는 물질을 이루는 성분의 종류라고 하겠다. 한편, 여러 원자의 화학적 결합으로 이루어진 분자는 물질의 성질을 가지는 가장 작은 입자이다.
목차
개요[편집]
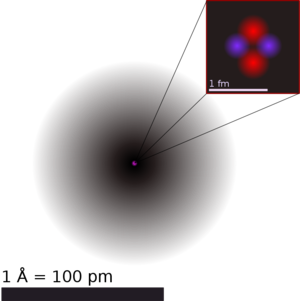
원자는 원소의 화학적 성질을 갖는 최소 단위이다. 가장 작은 수소 원자의 반지름은 53 pm이며, 다른 원자의 반지름은 100 pm 단위이다. 원자는 매우 작기 때문에 그 성질과 양태을 이해하기 위해서는 고전 역학(classical mechanics)보다는 양자 역학(quantum mechanics)을 이용한다. 원자는 핵(nucleus)과 그 주위에 분포되어 있는 전자(electron)들로 이루어져 있다. 원자핵은 양전하(positive charge)를 갖는 양성자(proton)와 전기적으로 중성인 중성자(neutron)로 이루어져 있으며 원자 질량의 대부분을 차지한다. 원자핵은 양성자와 중성자 사이의 핵력(nuclear force)에 의해 서로 결합되어 있으며, 이 힘은 원자핵 내부와 같이 짧은 거리에서는 양성자 사이의 정전기적 반발력보다 커서 핵으로 뭉쳐 있다. 원자핵과 그 주위에 분포된 전자들 사이에는 쿨롱 전기적 인력(Coulomb electric force)이 작용한다. 원자의 화학적 성질은 양성자 수에 의해 결정되기 때문에 양성자의 수가 같은 원자들은 같은 원소의 원자로 분류한다. 양성자 수는 같지만 중성자 수가 다른 원자들을 동위원소(isotope)라고 부른다. 동위원소는 양성자 수가 같기 때문에 같은 원소의 원자들이고, 화학적 성질이 동일하다. 하지만 중성자 수가 서로 달라 다른 질량수를 가지며 이로 인한 특성 - 동위원소 효과라고 부르는 차이를 보인다.
어원[편집]
기원전 450년경에 데모크리토스가 그리스어의 부정을 뜻하는 á와 자름을 뜻하는 tomos를 합성하여, átomos라는 자를 수 없음을 뜻하는 단어를 만들어냈다. 후에 데모크리토스의 제자들의 가보가 끊겨 중세에는 잊힌 이론이었으나 근대에 재조명받아 다시 주류 학설로 등장하게 된다.
근대에 이르러서야, 존 돌턴이 원자론을 재발견하고 atom이라는 단어를 정립하게 되었다. 한자로는 근본이 되는 물질이라 하여 근본 原을 사용, 原子로 확립되었다.
물론 현대에 이르러서는 원자도 더 작은 입자들로 구성되어 있다는 걸 밝혀냈기 때문에, 전류의 방향이 실제로는 반대인 것처럼, 현재에 와서는 어원의 뜻과 실제 정의가 달라졌다.
역사[편집]
원자설[편집]
세상의 물질들이 작은 입자들로 이루어져 있다는 사상은 고대 그리스와 인도에서부터 발견된다. 물론 이는 과학적 방법에 따른 결과가 아닌, 사상적 철학적 논증의 결과 나타난 사상의 한 갈래이다.
돌턴의 배수 비례의 법칙[편집]
존 돌턴은 1803년에 과학자들의 실험 결과를 분석하여 화합물이 만들어질 때 필요한 원소의 질량비가 간단한 정수비를 나타낸다는 사실을 발견하고, 이를 배수 비례의 법칙이라는 이름으로 발표한다. 이에 따라 물질들이 기본적인 질량 단위로 구성되어 있다는 사실이 밝혀졌다.
돌턴은 논문에서 세 종류의 화학반응을 예로 들었다. 첫 번째 예시는 산화 주석이다. 검은 가루(SnO)는 주석 88.1%와 산소 11.9%로 이루어져 있고, 흰 가루(SnO₂)는 주석 78.7%와 산소 21.3%로 이루어져 있다. 이는 질량비로 나타내면 검은 가루는 주석 100g에 산소 13.5g이고, 흰 가루는 주석 100g에 산소 27g이다. 이 때 필요한 산소의 질량인 13.5와 27은 1:2의 정수비를 가진다. 실제로 각 산화물은 주석 1개당 산소 1개 혹은 2개를 가져간다.
두 번째 예시는 산화철이다. 검은 가루는 78.1%의 철과 21.9%의 산소, 빨간 가루는 70.4%의 철과 29.6%의 산소로 이루어져 있다. 이는 질량비로 나타내면 검은 가루는 철 100g에 산소 28g이고, 붉은 가루는 철 100g에 산소 42g이다. 이 때 필요한 산소의 질량인 28과 42은 2:3의 정수비를 가진다. 실제로 각 산화물은 철 2개당 산소 2개 혹은 3개를 가져간다.
마지막으로 돌턴은 질소 산화물을 예시로 든다. 아산화 질소는 63.3%의 질소와 36.7%의 산소로, 일산화 질소는 44.05%의 질소와 55.95%의 산소로, 이산화 질소는 29.5%의 질소와 70.5%의 산소로 이루어져 있다. 이는 곧 각각 140g의 질소마다 80g의 산소, 160g의 산소, 320g의 산소가 필요하다는 의미인데, 이 필요한 산소의 질량비는 1:2:4의 비율을 이룬다.
기체 분자 운동론[편집]
18세기 후반에 기체가 작은 입자들의 집합체로 해석함으로써 통계학과 확률론 등을 통해 실제 기체의 운동을 잘 설명할 수 있다는 사실이 밝혀졌다. 돌턴의 원자론이 기체의 화학반응을 통해 물질의 구성성분이 입자임을 밝혔다면, 기체 분자 운동론은 물리적 성질을 통해 밝혔다는 의의가 있다.
브라운 운동[편집]
1827년에 식물학자 로버트 브라운은 현미경을 통해 물 위에 뜬 티끌들이 변덕스럽게 움직이는 현상을 발견하고, 브라운 운동이라 이름붙인다. 사람들은 여기 원자론을 적용하여 물 분자들이 티끌과 무작위적으로 충돌함으로써 이러한 현상이 발생한다고 추측했다. 이후 1905년에 알버트 아인슈타인이 통계물리학을 통해 브라운 운동의 원인이 실제로 분자의 자발적 운동이라는 것을 밝힌다. 프랑스의 물리학자 장 페랭은 아인슈타인의 이론을 실험으로 검증하여 1926년 노벨 물리학상을 받는다.
톰슨의 전자 발견[편집]
1897년 영국의 과학자 조지프 존 톰슨은 음극선이 전자기파의 일종이 아닌, 수소보다 1,800배나 가벼운 입자로 이루어진 빔이라는 사실을 발견한다. 이는 즉 원자보다 가벼운 입자가 존재함을 시사한다. 이 입자는 처음으로 발견된 아원자 입자로 처음에는 소체(小體)라는 의미의 corpuscle라 불렸으나, 이후 전자로 다시 명명된다. 톰슨은 전자가 방사성 물질에서 방출된다는 사실을 밝혔고, 이후 광전 효과에서 튀어나오는 입자도 전자임을 보였다. 금속 내부에서 흐르는 전류의 원인이 전자라는 사실도 곧 밝혀졌다.
원자로 이루어진 음극 판에서 음극선이 방출되므로, 원자가 쪼개질 수 있다는 사실이 너무나 부녕하게 드러난 것이다. 이를 바탕으로 1907년에 톰슨은 양전하를 가지는 물체에 음전하를 가지는 전자가 빵 속의 건포도처럼 박혀있는 원자모형을 제시한다.
러더퍼드의 원자핵 발견[편집]
위의 음극선 실험으로 톰슨은 음전하를 띄는 전자라는 입자가 양전하를 띄는 푸딩 안에 박혀있는 형태의 원자를 제안하게 된다. 이 모형은 푸딩 모형이라고도 불린다.
영국의 과학자 어니스트 러더퍼드와 그 제자인 한스 가이거, 어니스트 마즈든은 알파 입자의 비전하를 측정하는 실험을 하고 있었다. 그러나 입자가 측정기구 내부의 공기 중에서 산란되는 현상이 계속 발생하고, 결국 실험을 진행하기 어려울 정도로 오차가 쌓인다. 톰슨도 음극선을 사용해 실험을 계속 진행하며 같은 현상을 마주했는데, 톰슨은 실험기구 내부를 진공으로 만들어 이를 해결했다. 그러나 러더퍼드는 전자보다 수천배 이상 더 무거운 알파 입자를 가지고 실험을 하고 있었기 때문에, 톰슨처럼 간단하게 생각할 문제가 아니었다. 톰슨의 원자 모형에 의하면, 양전하는 원자 내부 어딘가에 뭉쳐있는 것이 아니라 원자 전체에 균질하게 퍼져 있어야 했다. 그러므로 충분한 크기의 전기장을 형성하지 못할 텐데, 알파 입자가 산란되는 현상이 계속 발생하는 것이었다. 이에 따라 러더퍼드와 제자들은 이 산란을 주제로 연구를 시작한다.
러더퍼드는 1908년부터 1913년까지 무려 5년의 시간동안 알파입자를 얇은 금박에 쏘는 실험을 진행한다. 대부분의 알파입자는 금박을 통과했지만, 90° 이상 산란되어 튕겨 나오는 알파입자도 관측되었다. 이러한 현상을 설명하기 위해 러더퍼드는 원자 내에 양전하가 한 군데 모여있으며, 그 위치는 원자의 중심이 되어야만 한다는 것을 논증한다. 이 때 제안된 원자모형은 행성모형이라고도 불린다.
닐스 보어의 원자구조[편집]
하지만 러더퍼드의 원자모형은 원자의 흡수 방출 스펙트럼을 설명할 수 없었고, 전자가 가속운동할 때 전자기파를 방사하는 싱크로트론 방사로 인해 운동에너지를 잃어버려야 하지만, 실제 원자가 물리적으로 안정한 이유를 설명할 수 없었다.
이를 보완하기 위해 1913년 덴마크의 과학자 닐스 보어는 전자가 각기 다른 에너지를 가지는 층에 존재한다는 양자화된 궤도 개념을 도입하여 가설을 세우고 이에 근거한 원자모형을 제시했다. 이 모형에서 전자는 광자를 흡수 또는 방출하면서 각 궤도 사이를 오갈 수 있다. 이처럼 양자화된 궤도 개념을 통해 전자궤도의 안정성, 불연속적인 흡수 방출 스펙트럼을 설명할 수 있었다.
같은 해 말엽, 헨리 모즐리는 보어 모형의 가능성을 보장하는 실험 결과를 얻는다. 또한 이 실험은 어니스트 러더포드와 안토니우스 반 덴 브룩의 가설, 즉 원자는 원자번호 갯수만큼의 핵전하를 띌 것이라는 가설을 검증한다. 이로써 원자 번호가 물리적 의미를 가진다는 사실이 밝혀진다.
원자간 화학 결합은 1916년에 길버트 뉴턴 루이스에 의해 설명된다. 루이스는 이 원자들이 전자를 공유함으로써 화학 결합이 형성된다고 주장했다. 또 1919년에는 미국의 화학자 어빙 랭뮤어는 원소의 화학적 성질이 주기율표를 따라 주기적으로 반복되는 이유는 한 원자 안에 있는 전자들이 물리적으로 긴밀하게 상호작용하여 하나의 집단을 이루기 때문임을 논증한다.보어의 모형은 전자껍질이라는 개념을 통해 랭뮤어의 전자집단론이 맞았음을 보이고 있다.
이후 슈뢰딩거에 의해 더 완벽하고 정확한 원자모형이 제시되긴 하지만, 보어 모형은 당시까지 밝혀진 원자의 성질들을 성공적으로 설명할 수 있는 최초의 완전한 원자모형이었다. 다만 수소가 아닌 다른 원자들의 선스펙트럼을 설명하지 못하고, 등속 원운동을 할 때 라모 공식을 따르자면 광자가 방출되어야 한다는 오류를 검증되지 않는 가정으로 해결하고자 하는 등의 문제가 남아있었기 때문에 물리학자들은 더 나은 모형을 탐구하기 시작했다.
슈뢰딩거의 원자 모형[편집]
1922년 슈테른-게를라흐 실험을 통해 원자의 속성들이 양자화되어있다는 것이 밝혀졌다. 은 원자 빔이 불균질한 자기장 내부를 통과하면서 경로가 두 갈래로 갈라지는데, 이러한 현상을 설명하기 위해서는 원자의 자기 모멘트가 두 개로 양자화 되어있어야만 했다. 스핀의 방향은 처음에는 무작위하게 분포되어 있다가, 빔이 자기장을 통과하면서 위 혹은 아래로 정렬되기 때문에 빔이 두 가닥으로 갈라지는 것이다.
1925년 베르너 하이젠베르크는 양자화된 성질을 다루는데 유용한 행렬 역학을 처음으로 제안한다. 그 작년인 1924년에는 루이 드 브로이가 모든 입자는 파동의 성질을 가진다는 가설인 물질파를 제안했다. 에르빈 슈뢰딩거는 드브로이의 이 가설을 정식으로 채택해 슈뢰딩거 방정식을 유도한다. 여기서 원자는 기존에는 입자로만 해석되었던 것과는 달리, 삼차원 파형을 가진 파동으로 해석된다.
이처럼 입자를 파동으로 해석함으로써 위치와 운동량을 동시에 정밀하게 측정하는 것이 불가능하다는 베르너 하이젠베르크의 불확정성 원리가 자연스레 유도되었다. 이처럼 원자를 파동으로 해석함으로써 기존의 보어 모형으로서는 설명될 수 없었던 원소들의 선 스펙트럼을 완벽하게 설명할 수 있었다. 또한 실제 관측결과도 잘 부합하는 터라 행성모형은 폐기되고, 원자 오비탈의 개념이 채택되었다.
하지만 같은 해 10월에 독일의 과학자 보른은 슈뢰딩거 방정식이 전자의 파동함수가 아니라 전자가 존재할 확률함수라고 해석하였다. 이러한 확률적 해석을 바탕으로 원자 주위에서 전자를 발견할 확률을 계산하여 확률의 분포를 점으로 찍어 구름처럼 표시하는 현대의 원자모형이 탄생하였다.
중성자의 발견[편집]
질량 분석기의 발달로 인해 원자의 질량을 더욱 정밀하게 측정할 수 있게 되었다. 프랜시스 윌리엄 애스턴은 이 기구를 통해 동위원소들이 서로 다른 질량을 가지며, 원자 질량이 일정 정수비를 가진다는 정수율을 발견했다. 이러한 현상은 1932년에 제임스 채드윅이 양성자와 비슷한 질량을 가지지만 전하를 띄지 않는 입자인 중성자를 발견함으로써 해결되었다. 이로써 동위원소란 같은 수의 양성자를 가지나 다른 수의 중성자를 가지는 종류의 입자라는 사실이 밝혀졌다.
핵분열, 고에너지 및 응집물리학[편집]
러더퍼드의 제자이자 독일의 화학자인 오토 한은 초우라늄 원소를 만들고자 중성자를 우라늄 원자에 충돌시켰으나, 예상과는 다르게 우라늄보다 더 가벼운 원소인 바륨이 생성되었다. 이듬해 리제 마이트너와 그녀의 조카인 오토 프리슈는 한이 수행한 실험이 핵분열을 일으켰다는 것을 알아낸다. 1944년, 한은 노벨 화학상을 수상한다. 한은 마이트너와 프리슈에게도 공을 돌리고자 했으나 아쉽게도 오직 한만이 노벨상을 수상하였다.
1950년대에 고성능의 입자 가속기와 입자 검출기가 만들어짐에 따라 과학자들은 고에너지 상태에서의 원자의 행동을 연구하기 시작했다. 이후 연구결과가 이어지며 중성자와 양성자가 강입자에 속하며, 쿼크라는 더 작은 입자들로 구성된다는 사실이 밝혀졌다. 아원자 입자들로 구성된 원자핵의 성질, 아원자 입자들의 상호작용 등을 설명하기 위해 표준 모형도 만들어졌다.
구조[편집]
널리 알려진 구조. 양자역학으로 밝혀진 실제 모습과는 다르지만 직관적이기에 여전히 쓰고 있다.
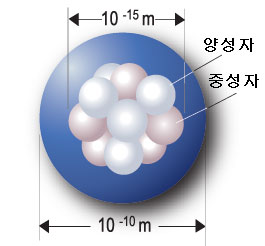
중심에는 원자핵을 이루는 핵자인 양성자, 중성자가 모여있고, 전자는 핵 주변에 분포하며, 이 전자의 분포를 나타내는 전자 구름이 위치해있다.
이러한 구조를 쉽게 이해하기 위해서 축구장을 원자에 비유해서 자주 예로 드는데, 만약 원자가 축구장이라면, 원자핵은 축구장 중앙에 놓인 구슬과 같고, 전자는 경기장에서 주로 축구공 근처에 떠돌아다니는 먼지 정도에 불과하다. 원자는 텅 비어있다고 생각해도 무방하다. 실제로 자신이 원자라는 축구장에 들어가있다면 안에는 희미하게 보이는 구슬을 제외하고는 아무것도 없다고 생각할 수밖에 없다.
물론 정확하게 원자와 원자핵의 크기의 비율이 정확히 축구장과 구슬이라는 의미가 아니며 원자마다 다르다.
원자가 지구 크기라면 원자핵은 남대문 정도 된다고도 한다. 수치상으로는, 원자 반지름은 10⁻¹⁰ m(옹스트롬 참조.), 핵자의 수를 A라 할 때 원자핵 반지름은 1.07 ∛A ×10⁻¹⁵ m이다. 양성자 하나로 이루어진 수소 원자라면, 원자와 원자핵의 크기 비율은 약 '100,000 : 1' 이다. 그리고 '전자'는 현재 기술로는 크기를 측정할 수가 없다.
질량은, 핵자는 약 1.67×10 ⁻²⁷ kg이고 전자는 9.11×10 ⁻³¹kg으로 핵자가 전자에 비해 대략 1800배나 무겁다. 사실상 원자의 질량은 원자핵이 다 차지하고 있는 셈이다.
기본적으로 원자는 전하를 가지지 않는다. 원자핵이 양전하를 가지고, 그만큼의 음전하를 가진 전자가 합쳐져 있기 때문. 전자가 적거나 많으면 양전하나 음전하를 띠기도 한다.
또한 자성을 띤다. 원자가 자성을 띠는 이유는 크게 전자의 스핀 운동과 전자의 궤도 운동 2가지로 볼 수 있다.
원자핵[편집]
핵자인 양성자와 중성자가 이루며, 핵자들의 사이에 작용하는 핵력에 의해 양성자와 중성자가 결합되어 원자핵을 형성한다.
주기율표의 원자번호는 이 원자핵의 양성자 개수를 뜻한다. 즉 원자번호 1인 수소는 양성자가 하나, 원자번호 92인 우라늄은 92개의 양성자를 가지고 있다. 여기서 중성자를 빼놓으면 섭섭한데, 양성자의 수는 같으나 중성자의 수가 다르면 동위원소가 된다. 원자번호 0인 원소가 없듯 중성자가 없는 원자는 존재하나 양성자가 없는 원자는 일반적으로 존재하지 않는다.
양성자의 수에 따라 어떤 원소인지가 결정나므로, 즉 원자가 가지고 있는 양성자의 수를 바꿔버리면 원소를 다른 원소로 인위적으로 바꾸는 연금술도 가능하다고 할 수 있겠다. 양성자를 비롯한 핵자의 수를 바꾸는 대표적인 기술이 핵융합, 핵분열.
전자[편집]
흔히 전자가 원자핵 주변을 도는 것으로 생각하는 사람이 많으나, 정확히 말하면 전자는 그냥 원자핵 주변에 존재해 있는 것이다. 그것도 위치가 정해진 것도 아니며, 전자는 어디에든 확률적으로 존재할 수 있다. 다만 핵에서 가까울수록 그 위치에 대해서 전자가 존재할 확률이 올라가고 반대로 핵에서 멀어질수록 존재할 확률이 낮아진다. 그리고 이 전자의 분포는 띠 형태로 나타나게 되는데 이 형태를 전자구름이라고 부른다.
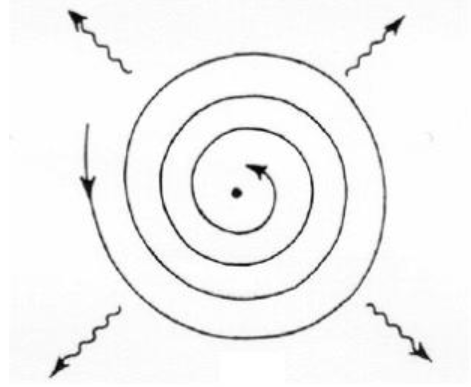
원자핵 주변을 도는 모델이 실패했던 이유는 해당 모델이 매우 불안정하기 때문이다. 전자와 전자사이에 작용하는 척력까지 고려한다면 원자는 외부의 약한 충격에도 붕괴되어야 한다. 만일 우리가 고전역학적인 모델을 채용한다면 전자가 원운동을 하면 싱크로트론복사로 빛을 내며 에너지를 잃어버린다. 원자 구조로 인해 순식간에 빛으로 와해되는 것.
보어의 원자모델에서 일어날 수 있는 일. 당연하지만 이런 일은 일어나지 않는다. 참고로 이 모형에서 전자가 원자핵에 포획되지 않기 위해서는 최소 초속 1000km대 이상으로 움직여야 한다.
전자구름 모델. 오비탈 모델이라고도 하며, 색이 입혀진 부분은 매우 높은 확률로 전자를 찾을 수 있는 지역을 의미한다. 그림에서의 색은 파동함수에서의 위상을 나타낸다. 색이 없는 부분에서도 발견할 수는 있으나, 그 확률은 매우 낮다.
원자의 실제 관찰 모습[편집]
원자를 실제 모습은 1980년대에 개발된 제3세대 현미경인 원자현미경에서부터 MRI가 발달함에 따라, 보다 다양하게 관측 및 촬영까지 할 수 있게 되었다.
2020년 2월에 찍은 인류 역사상 최초로 원자가 결합되고 분리되는 장면을 촬영한 영상도 있다. 구체적으로는 탄소나노튜브 안에 레늄 원자를 넣어서, 레늄 원자의 금속 결합 및 분리를 관측한 것이다. 레늄의 경우 원자번호가 큰 편이라서 관찰이 수월했기 때문. 이 발견은 이론으로만 알 수 있었고, 고등학교 교과에도 나올만큼의 보편성이 높아진 지식이라 할 수 있는 '원자 간의 결합'을 실제로 사람 눈으로 확인한 세계 최초의 사례이므로, 그 의의가 높다 할 수 있겠다.
동영상[편집]
참고자료[편집]
같이 보기[편집]
| ||||||||||||||||||||||||||||||
| ||||||||||
| ||||||||||||||||||||||

 위키원
위키원