염
염(鹽, salt)은 산의 음이온과 염기의 양이온이 정전기적 인력으로 결합하고 있는 이온성 물질인 화합물을 말한다. 주로 중성을 띠는 물질이 많으나, 산이나 염기를 띠는 물질도 있다. 흔히 염화나트륨을 주 성분으로 하는 소금 결정도 염에 해당한다.
목차
[숨기기]구분[편집]
- 산성염: 수소가 포함된 산에서 수소양이온의 일부만이 다른 금속이온으로 치환된 염으로 수소 이온이 포함되어 있는 염이다. (pH < 7 인 상태의 화합물)
- 염기성염: 수산화물이 포함된 염으로 대부분 불용성이다. (pH > 7 인 상태의 화합물)
- 정염: 어떤 산과 염기에서의 수산화이온과 수소이온이 완전히 다른 이온으로 치환되어 있는 염으로, 중성염이라고도 한다. (pH = 7 인 상태의 화합물)
그러나 이름과 달리 산성염이라고 해서 염의 수용액이 반드시 산성이라는 것이 아니다. 실제로 염이 "수용액에서 어떠한 성질을 띠는가"는 염이 가수분해될 때 어떤 액상이 되는가가 중요하다. 염이 가수분해될 때 어떤 산과 염기의 염이냐에 따라 다른 액상을 띄게 되는데, 염의 액상은 다음과 같다.
- 강산-강염기: 가수분해시 액성은 염의 종류와 일치
- 강산-약염기: 가수분해시 염의 종류와 관계없이 무조건 산성
- 약산-강염기: 가수분해시 염의 종류와 관계없이 무조건 염기성
- 약산-약염기: 가수분해시 액성은 염의 종류와 일치
(다만 일부 경우에는 예외적인 상황이 발생할 수 있다.)
종류[편집]
특성[편집]
용해도(solubility)[편집]
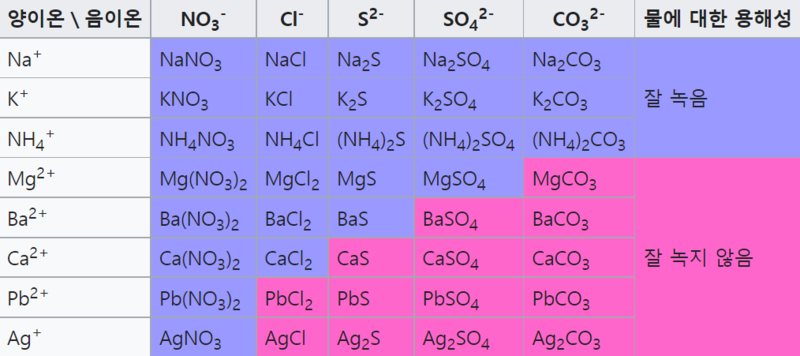
고체 상태의 염을 물에 넣었을 때 염을 구성하는 이온들의 종류에 따라 용해도(물에 녹는 정도)에 큰 차이가 있다. 예를 들어 염화소듐(NaCl)은 물에 매우 잘 녹아 Na⁺와 Cl⁻ 이온으로 잘 해리되는 반면에 염화 은(AgCl)은 물에 넣어을 때 매우 적은 양만 녹아서 아주 소량의 Ag⁺와 Cl⁻이온만이 물에서 해리되어 존재한다. 염의 용해도는 양이온과 음이온 사이의 상호인력과 물⁻이온 사이의 상호인력의 상대적인 세기 차이에 따라 결정되며, 이온들의 상호인력이 상대적으로 약하고 물과 이온의 상호인력이 상대적으로 강할 때 물에 잘 녹는다. 물에 용해된 이온들은 물 분자들로 둘러싸여 수화되며, 수용액 내에 분산되어 독립적으로 움직인다.
구성하는 이온의 종류에 따른 대략적인 용해도 차이는 다음과 같은 규칙을 따른다.
- 질산 이온(NO₃⁻)을 포함하는 대부분의 염은 물에 매우 잘 녹는다.
- 알칼리 금속 이온(Li⁺, Na⁺, K⁺, Cs⁺, Rb⁺)과 암모늄 이온(NH₄⁺)을 포함하는 대부분의 염은 물에 매우 잘 녹는다.
- 염화 이온(Cl⁻), 브로민화 이온(Br⁻), 아이오딘화 이온(I⁻)을 포함하는 대부분의 염은 물에 매우 잘 녹으나, 은이온(Ag⁺), 납 이온(Pb⁺), 수은 이온(Hg₂²⁺)을 포함하는 경우에는 물에 거의 녹지 않는다.
- 황산 이온(SO₄²⁻)을 포함하는 대부분의 염은 물에 잘 녹으나, 예외적으로 BaSO₄, PbSO₄, Hg₂SO₄, CaSO₄의 경우 물에 거의 녹지 않는다.
- Ba(OH)₂, Sr(OH)₂, Ca(OH)₂를 비롯하여 수산화 이온(OH⁻)을 포함하는 대부분의 염은 물에 잘 녹지 않으나, NaOH와 KOH는 물에 매우 잘 녹는다.
- 황화 이온(S²⁻), 탄산 이온(CO₃²⁻), 크로뮴산 이온(CrO₄²⁻), 인산 이온(PO₄³⁻)을 포함하는 대부분의 염은 물에 잘 녹지 않는다. 단, 위의 2번 규칙에 따른 알칼리 금속 이온과 암모늄 이온을 포함하는 경우는 예외적으로 물에 잘 녹는다.
물에 잘 녹지 않는 이온성 염의 경우, 정량적인 용해도 정도를 용해도곱 상수(solubility product)를 통해 계산할 수 있다. 예를 들어, 브로민화 구리(I) (CuBr(s))는 물에서 일부 녹아 다음과 같은 반응 평형에 도달하게 된다.
CuBr(S) ⇌ Cu(aq)⁺ + Br(aq)⁻
이때 CuBr(s)의 용해도곱 상수는 Ksp=[Cu⁺][Br⁻]로 정의된다. 여기서 [Cu⁺]와 [Br⁻]는 각각 구리(1⁺) 이온과 브로민화 이온의 몰 농도를 의미한다. CuBr(s)의 용해도곱 상수인 Ksp=4.0×10⁻⁸로 주어졌고 평형에 도달하였을 때 용해된 CuBr(s)의 농도를 x mol/L라고 가정하면, 평형상태에서 물에 녹아 있는 Cu⁺와 Br⁻의 농도 역시 x mol/L라고 가정하여 용해도를 계산할 수 있다. 용해도곱 상수의 정의로부터 Ksp=[Cu⁺][Br⁻]=x2=4.0×10⁻⁸이므로, CuBr(s)의 용해도는 x mol/L=2.0×10⁻⁴ mol/L임을 계산할 수 있다.
이온을 포함하는 수용액에서의 침전 반응(precipitation reaction)[편집]
다른 두 용액을 섞었을 때 고체 상태의 물질이 형성되는 경우가 있으며, 이러한 고체 상태의 물질을 침전(precipitate)이라 한다. 예를 들어 무색의 Ba(NO₃)₂(aq) 수용액에 노란색의 K₂CrO₄(aq) 수용액을 섞었을 때 노란색의 침전이 형성되는 것을 관찰할 수 있다. 위에서 소개된 용해도 규칙에 따르면 Ba(NO3)₂와 K₂CrOv는 물에 잘 녹아 각각의 수용액 내에 Ba²⁺와 NO³⁻, K⁺와 CrO₄²⁻ 이온 상태로 존재하며, 두 수용액을 섞었을 때 물에 잘 녹지 않는 (용해도가 낮은) 노란색 고체 상태의 BaCrOv(s)을 형성하게 된다. 이처럼 이온 상태의 물질을 포함하는 용액들을 섞었을 때 용해도가 낮은 고체 상태의 염을 형성하는 반응을 침전 반응(precipitation reaction)이라 한다. 수용액에 여러 금속 이온들이 녹아 있을 때 이온성 염의 용해도 차이를 이용한 침전 반응을 이용해서 금속 이온을 선택적으로 분리할 수 있다.
염이 용해된 수용액(salt solution)의 전기 전도도(electrical conductivity)[편집]
고체 상태의 염 자체는 전기를 통하지 않는 절연체이다. 하지만 용융된 상태의 용융염이나 염을 물에 녹인 수용액의 경우에는 전기가 잘 통한다. 물에 녹았을 때 수용액의 전기가 잘 통하게 하는 물질을 전해질(electrolyte)이라 한다. 수용액의 전기 전도도(전기가 잘 통하는 정도)는 용액 내에 존재하는 이온의 수에 따라 달라지며, 따라서 물에 넣었을 때 잘 녹아 완전히 양이온과 음이온으로 해리되는 염의 경우 전기를 매우 잘 통하게 된다. 염화 소듐(NaCl)과 같이 물에 잘 녹아 수용액에서 이온 상태로 존해하여 전기를 잘 통하는 염을 강한 전해질(strong electrolyte)이라 한다. 반면에 아세트산(CH3COOH)과 같이 물에서 소량의 이온들만 존재하는 물질을 약한 전해질(weak electrolyte)이라 하며, 당(sugar)와 같이 물에 녹지만 거의 이온을 생성하지 않는 물질을 비전해질(nonelectrolyte)이라고 한다.
앙금[편집]
염 중에서도 난용성 또는 불용성의 염을 앙금이라고도 하며, 서로 다른 전해질 수용액을 섞었을 때, 양이온과 음이온이 강하게 결합하여 물에 녹지 않는 앙금을 생성하는 반응을 앙금 생성 반응이라 한다. 수용액에서의 반응의 예는 다음과 같다.
염화 이온과 은 이온이 포함된 수용액을 반응시키면 염화 은 앙금이 생성된다.
Cl⁻ + Ag⁺ → AgCl ↓(흰색 앙금)
바륨 이온과 황산 이온을 반응시키면 황산 바륨 앙금이 생성된다.
Ba²⁺ + SO₄2⁻ → BaSO₄ ↓(흰색 앙금)
탄산 칼슘 칼슘 이온과 탄산 이온을 반응시키면 탄산 칼슘 앙금이 생성된다.
Ca²⁺ + CO₃²⁻ → CaCO₃ ↓(흰색 앙금)
아이오딘화 이온과 납 이온을 반응시키면 아이오딘화 납 앙금이 생성된다.
2I⁻ + Pb²⁺ → PbI₂ ↓(노란색 앙금)
황화 이온과 구리 이온을 반응시키면 황화 구리 앙금이 생성된다.
S²⁻ + Cu²⁺ → CuS ↓(검은색 앙금)
- 앙금을 생성하는 이온과 앙금
1. AgCl, Agl – 검출하려는 양이온 : Ag⁺ 일 때 – 검출하려는 음이온 : Cl⁻, I⁻일 때 – 앙금(색깔): AgCl(흰색), AgI(노란색)
2. CaCO₃, CaSO₄ – 검출하려는 양이온: Ca²⁺일 때 – 검출하려는 음이온: CO₃²⁻, SO₄²⁻일 때 – 앙금(색깔): CaCO₃(흰색), CaSO₄(흰색)
참고자료[편집]
같이 보기[편집]

 위키원
위키원