환원제
환원제(還元劑, reducing agent)는 자신은 산화되면서 다른 물질을 환원시키는 성질이 큰 물질을 말한다. 넓은 의미에서는 스스로는 전자를 잃고 그 전자를 다른 물질에 주는 물질을 말한다. 산화환원 반응에서는 반응에 관계되는 물질 중 한쪽이 산화제이고 다른 쪽이 환원제인데, 상대에 따라서 환원제가 되기도 하고 되지 않기도 하지만, 보통 많은 물질에 대하여 환원작용을 나타내는 것을 가리켜서 환원제라고 부른다.
개요[편집]
환원제(還元劑, reducing agent)는 산화와 환원 반응에서 상대를 환원시키고 자신은 산화되는 물질이다. 주로 금속 물질이며, 전자친화도가 작다. 대표적인 환원제는 알데하이드계(R-COH)의 물질로써 포름알데하이드(H-CHO), 아세트알데하이드(CH₃-CHO) 이며, 메탄올과 같은 알코올계(R-OH), 포름산(H-COOH), 옥살산(C₂H₂O₄)과 같은 카르복실산계(R-COOH)도 산화가 잘되므로 환원제이다. 이들은 주로 산소를 받거나 수소를 주는 화합물로써 탄소의 산화수가 증가한다. 또한 대부분의 금속원소들은 전자친화도가 낮기 때문에 상대에게 전자를 주며 양이온이 쉽게 되어 산화수가 증가하며 산화되어 환원제로 작용한다. [1]
보통 사용되는 환원제에는 수소를 비롯하여 비교적 불안정한 수소화합물(요오드화수소 · 황화수소 · 수소화알루미늄 등), 저급(低級) 산화물(일산화탄소 · 이산화황 등), 또는 저급 산소산의 염(아황산염 · 황화나트륨 등), 전기적 양성(陽性)이 큰, 즉 양이온이 되기 쉬운 금속(알칼리 금속 · 마그네슘 · 아연 등), 산화 정도가 낮은 유기화합물(알데히드 · 당류 · 포름산 · 옥살산 등) 등 이다.
환원제가 조건에 따라 산화제로 작용하는 경우도 있는데, 예컨대 과산화수소 · 이산화황 등이 해당한다. 산화물을 주체로 하는 광석으로부터 환원시켜 조금속(粗金屬)을 얻는 환원제에는 코크스 · 석탄 등 외에 많은 가스 환원제가 있다.[2]
이와 반대적 특성을 가진 물질은 산화제라고 한다. 물질마다 전자를 잃고 얻는 성질의 세기가 다르기 때문에 산화, 환원 반응이 일어난다. 환원제의 경우, 대상 물질에 비해 환원제 스스로는 전자를 잃는 정도가 크고, 대상 물질은 환원제로부터 유래된 전자를 얻는 상대적 정도의 크기가 크다. 그러므로 환원제와 산화제는 작용하는 물질의 종류와 이에 상대하는 대상 물질의 종류의 조합에 따라 불리는 상대적 명칭이다.
종류[편집]
수소화붕소나트륨(sodium borohydride, NaBH₄), 수소화알루미늄리튬(lithium aluminum hydride, LiAlH₄)는 강력한 환원제이다. 이들에겐 산화가 잘되는 금속이 있고 또한 수소를 제공하기 쉽다. 이들은 일반적으로 환원제로 작용하는 알데하이드(aldehydes), 케톤류(ketones), 카르복실산(carboxylic acid) 등도 환원시킨다. 아스코르브산(C₆H₈O₆)과 같은 비타민C 등의 항산화제도 수소와 전자를 제공하므로써 산화되어 환원제이다. 포도당과 같은 단당류는 기본적으로 환원력이 강한(환원제) 카르보닐기 등의 작용기를 가지고 있어 산화되기 쉬운 환원당이다. 리튬, 나트륨, 칼륨 등의 금속화합물들은 전자를 잃고 양이온이 되기 쉽거나 비금속과 결합시 전자를 제공하므로 산화수가 증가하여 산화되므로 환원제이다.
LiAlH₄ + 4H₂O → LiOH + Al(OH)₃ + 4H₂
LiAlH₄는 환원제, 물은 산화제이다. H₂O는 산소를 주고 수소의 산화수를 감소시켰습니다. LiAlH₄에서 Li는 +1에서 산화수 변화가 없고, Al도 +3에서 산화수 변화가 없습니다. 하지만 수소의 산화수는 -1에서 1로 산화되었다.
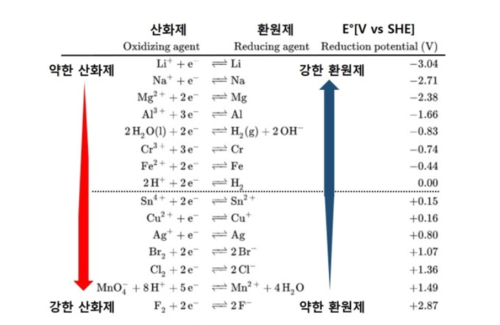
금속원소들은 보통 환원제인데, 강한 환원제인 Li는 양이온이 되면서 약한 산화제가 되고, 비금속원소이면서 강한 산화제인 F₂는 음이온이 되면서 약한 환원제가 된다.
위의 표는 표준전극전위(standard Electrode Potential)로써, 수소의 표준전극전위(Eo = 0V)와 비교하여 전자를 받아들이기 쉬운 정도를 정량적으로 나타낸 것이다. 금속원소들은 비금속원소들보다 전자를 제공하므로써 환원제의 성질이 강하나 금속원소들 끼리도 수소를 기준으로 상대적인 환원력의 차이가 있다. 리튬 및 나트륨과 같은 1족 금속원소들은 강한 환원제이다.
Zn + Cu²⁺ → Zn²⁺ + Cu 에서 아연은 산화(환원제) 되었고, 구리는 환원(산화제) 되었다. 같은 금속일지라도 아연은 표준환원전위가 - 이고, 구리는 + 이어서, 아연이 구리보다 환원력이 강하여 산화되기 쉽다.[1]
각주[편집]
- ↑ 이동: 1.0 1.1 applepop, 〈산화제와 환원제(oxidizing agent and reducing agent)〉, 《네이버 블로그》, 2020-12-12
- 이동 ↑ 〈환원제(reducing agent)〉, 《사이언스올》, 2015-09-09
참고자료[편집]
- 〈환원제〉, 《화학백과》
- 〈환원제〉, 《위키백과》
- applepop, 〈산화제와 환원제(oxidizing agent and reducing agent)〉, 《네이버 블로그》, 2020-12-12
- 환원제(reducing agent)〉, 《사이언스올》, 2015-09-09
같이 보기[편집]

 위키원
위키원