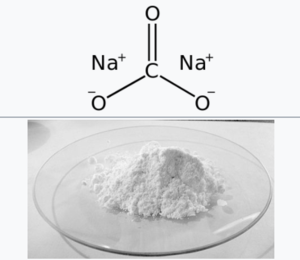
탄산나트륨
탄산나트륨(sodium carbonate)은 탄산의 나트륨염으로 보통 소다 또는 탄산소다라고도 부른다. 무수물은 백색 분말의 흡습성이 강한 소다회이며, 1수화물·7수화물·10수화물이 알려져 있다. 10수화염은 세탁 소다, 결정 소다라고도 불린다. 화학 공업상 가장 중요한 제품의 하나이다. 유리·비누 등의 제조원료로 사용되며, 알칼리로서 종이 제조 등에 사용된다.
무수물(無水物)은 소다회, 10수화물은 세탁소다·결정소다라고도 한다. 화학식은 Na₂CO₃이다.
개요[편집]
탄산 나트륨은 화합물의 한 종류로, 탄산과 수산화나트륨의 염이다. 유리에 주로 포함되어 있어 빛이 통과할 때 자외선을 차단해 주는 역할을 하기도 한다. 상수도에서 정수 과정 중 pH를 조절하기 위해 사용되기도 한다. 탄산나트륨은 나트륨 이온(Na+)이 포함되어 있어 물에 잘 녹는다.
무수물(無水物)은 식량(式量) 106.0, 녹는점 851℃, 비중 2.533, 굴절률 1.535, 물에 대한 용해도 7.1g/100g이다. 자연계에는 1수화물(서모나트라이트), 10수화물(나트론)로서 존재한다. 탄산나트륨을 많이 함유하는 염호(鹽湖)의 주변이나 호저(湖底)에는 NaCO · NaHCO · 2HO의 조성을 가진 결정(結晶)으로 퇴적해 있으며 트로나라 불린다.
고대 이집트에서 유리와 비누 등의 제조에 사용한 세계 최초의 소다이다.
유래[편집]
고대부터 탄산나트륨은 탄산칼륨과 사용되고 있다. 18세기 말까지는 주로 해안에 나는 식물이나 해초를 태워 얻은 재로 추출하여 탄산나트륨을 제조하였다. 그 외 천연소다가 사용되고 있다. 남아프리카, 몽고, 미국 등에 산재하는 소위 나트론 호수물을 농축해서 만들었다. 또 이집트의 트로나 소다, 남콜롬비아 지방의 우라오 소다처럼 나트론 호수 주변의 땅속에서 단사정(單斜晶)의 세스키탄산나트륨 (Na₂CO₃·NaHCO₃·2H₂O)으로서 생산된다. 동아프리카의 영국령 케냐의 마가디 호수에서 산출되는 마가디 재는 현재에도 시장성을 가진 천연소다의 대표적인 물질이다.
최근 산업의 발달과 함께 탄산나트륨의 수요가 증대하여 종래의 생산량으로는 부족을 초래, 프랑스학사원은 1755년, 막대한 상금을 걸어 염화나트륨에서 탄산나트륨의 제조법을 공모했다. 그 중 프랑스의 Nicolass LeBlanc가 발명한 Le Blanc법이 있었다. 이 방법은 그 후 영국에서 개량이 더해져서 1823년 Le Blanc법에 의한 탄산나트륨은 대공업적으로 제조가 대시되었고, 암모니아·소다법이 출현할 때까지 약 60년에 걸쳐 세계의 공업발전의 일대 원인이 되었다.[1]
제법[편집]
공업적으로는 르블랑 소다법, 암모니아 소다법 및 전해법의 세 방법이 있지만, 현재에는 오로지 암모니아 소다법만이 행해지고 있다.
정제법[편집]
일반적으로 공업염에는 미량의 Cl, Fe, SiO₂가 포함되므로 수용액을 가온하여 이산화탄소를 통해서 순수한 탄산수소나트륨을 만들고 나서 이것을 백금 접시 또는 양질의 자기 접시 중에서 가열 분해하여 무수염으로 한다(⇀ 탄산나트륨의 분석법).
특성[편집]
무수염은 백색의 분말로 흡습성이 있고, 녹는점 851℃. d 2.533, n 1.535. 해리압 19mm/1000℃. 용해도 물 0℃, 7.1g/100g ; 104℃, 48.5g/100g : 에탄올, 에테르에 녹지 않는다. 10, 7 및 1수화염이 있다. 수용액에서 32.08℃ 이하로 결정시키면 10수화염을, 32.08~35.27℃에서는 7수화염을, 35.27℃ 이상에서는 1수화염을 석출한다. 1수화염은 백색, 사방 결정계 결정. 조해성. d 1.55, n 1.506~1.509. 100℃ 이상에서 결정수를 잃는다. 용해도 물 40℃, 48.9g/100g : 글리세린 25℃, 14g/100g : 에탄올, 에테르에 녹지 않는다. 7수화염은 무색, 사방 결정계 결정. d 1.51. 10수화염은 단사 결정계 결정. 풍해성. d 1.46, n 1.425. 용해도 물 0℃, 21.5g/100g ; 30℃, 238g/100g : 에탄올에 녹지 않는다. 수용액은 가수 분해하여 강한 알칼리성을 나타낸다.
Na₂CO₃ + H₂O ⇀ NaOH + NaHCO₃
또 이산화탄소를 흡수해서 탄산수소나트륨을 생성한다.
용도[편집]
공업적으로는 나트륨 및 탄산기가 이용되는 경우와 단순히 싼값의 알칼리로 이용되는 경우가 있다(⇀ 소다회).
- 비누, 유리, 수산화나트륨, 탄산수소나트륨 등의 원료로 사용된다.
- 제지, 염료 공업, 아미노산 제조 및 세탁용으로 이용된다.
- 분석용 표준 시약 : 500~600℃로 40~50분간 유지하고 건조한 후 황산 데시케이터 속에서 방랭한다. 염기의 표준 물질로 산표준액의 표준화에 널리 이용되고 있다. 지시약에는 메틸 오렌지 또는 브로모크레졸 그린을 이용한다.
- 의약품, 6국 기재 탄산나트륨으로 10수화염, 건조 탄산나트륨으로 1수화염과 무수염의 혼합물이 있다. 외용약으로 1.6~2.4% 용액을 피부 질환에, 1% 용액으로 구강, 질 세정에 이용한다.
각주[편집]
- ↑ 화공약품전문, 〈탄산나트륨 (Sodium Carbonate)〉, 《네이버 블로그》, 2015-10-12
참고자료[편집]
같이 보기[편집]

 위키원
위키원