리튬 코발트 산화물
리튬 코발트 산화물(Lithium cobalt oxide)은 리튬이온 배터리의 양극 부분에 자주 쓰이는 리튬 화합물이다. LiCoO₂의 화학식을 가지고 있다. 간략히 LCO(엘씨오)라고도 한다. 리튬 이산화 코발트의 부패는 산소를 생성한다.
1991년 소니에 의해 최초의 상업적 리튬이온 배터리가 출시되었는데 이 제품의 양극으로 층상 구조의 리튬 코발트 산화물이 사용되었다. 납축전지나 니켈 계열의 전지보다 성능이 매우 뛰어나고 라이프 사이클이 길어 노트북, MP3 플레이어, 핸드폰 등 대부분의 모바일 기기에 사용되었다. 하지만 코발트가 쉽게 산화되는 성격이 있어 전극간의 Short가 나거나 고온 혹은 강한 충격에 폭발하거나 연소하는 문제가 있다.[1]
목차
개요[편집]
리튬 코발트 산화물은 높은 비용량(比容量, specific capacity), 낮은 자체 방전 및 훌륭한 주기수명을 가지고 있기 때문에 리튬 이온 전기에서 양극 활물질로서 응용하는데 세계적으로 각광을 받고 있다.
LiCoO₂의 결정성, 평균입도 및 입경 분포는 재충전할 수 있는 리튬전지의 고성능을 얻을 수 있는 중요한 인자이고 출발물질과 또한 제조 방법에 크게 의존하고 있다. 많은 연구자들은 고체 (solid state) 반응에 의해 LiCoO₂를 합성했다. 이 방법을 이용하면 불충분한 혼합과 출발물질의 낮은 반응성 때문에 850~900℃에서 대여섯 시간 하소 (煆燒, calcination)해야 LiCoO₂가 합성된다. 상승된 온도에서 너무 오래 하소하면 분말이 필연적으로 굵어지게 되고 리튬 종이 증발되어 생성물의 전기화학적 성질이 크게 손상을 받는다. 이러한 이유 때문에 균일한 입경 분포를 가진 미세하고 결정화가 잘된 LiCoO₂ 분말을 얻기 위하여 많은 노력이 여러 가지 합성법에서 다루 어 졌다(sol-gel 법, 분무-건조법, 연소합성, 수열합성 외)
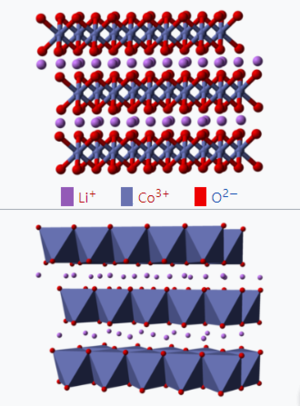
구조와 형성[편집]
LiCoO₂는 6방(方)과 입방 정계구조의 2가지 형태로 나눌 수 있다.
LiCoO₂의 2가지 유형에 관하여 저온 (LT-LiCoO₂)을 입방 형태, 고온(HT-LiCoO₂)을 6방 형태라고 정의한다. 그러나 HT-LiCoO₂가 또한 아주 저온에서도 얻게 되는 것을 고려한다면 리튬 코발트 산화물은 적절하지 못하다. 동일한 산화물의 하위격자 (sublattice)에 의해 6방과 입방 구조는 결정되고 양이온의 공간 배열에 의해 구별된다.
저온 리튬 코발트 산화물 (LT-LiCoO₂)[편집]
중성 회절 데이터에 의하면 LT-LiCoO₂의 구조는 이상적으로 층상을 이루고 있지 않고 코발트 이온의 6%는 리튬 층의 8면체에 자리 잡고 있다. LT-LiCoO₂는 4개의 입방 [111] 방향에 각각 직각을 이루는 0.75 Co와 0.25 Li 및 0.75 Li와 0.25 Co 조성에 번갈아 있는 양이온층을 가진 입방최밀충전 (cubic closed packed) 산소 망을 근거한 스피넬 관련 구조 (공간 그룹 Fd3m)를 가지고 있다고 판단된다.
- 셀 (cell) 변수는 a값이 2.8297(6) Å이고 c값이 13.868(9) Å이다. 스피넬 (4.900-4.914 범위의 c/a)의 종횡비 (aspect ratio)는 이상적인 입방 최밀충전 산소 배열 (c/a=4.899)에 아주 가깝다.
- LT-LiCoO₂에 관련된 거의 모든 보고서에서 특성이 조사된 생성물은 원료 화합물과 합성 절차에 따라 HT 상과 또는 미 반응 Co₃O₄, Li₂CO₃ 또는 LiNO₃의 상당량으로 오염되어 있다. 원료를 높은 수준에서 혼합하는 것이 단상 LT-LiCoO₂를 제조하는데 아주 중요하다. 또한 합성온도는 HT상 형성을 피하기 위하여 400℃ 이하를 유지하
는 것이 필요하다.
고온 리튬 코발트 산화물 (HT-LiCoO₂)[편집]
HT-LiCoO₂의 구조는 Co와 Li 면이 ABCABC 산소 적층(stacking)을 교체하는 이상적인 G-NaFeO₂ 층상구조를 가진 3방(공간 그룹 R3m, O₃ 상) 시스템에 속한다. 셀 변수는 a값이 2.815-2.816 Å범위이고 c값이 14.05-14.08 Å범위에 있다. c/a비의 값이 4.98~5.00이고 이상적인 입방최밀충전 격자보다 현저히 크다.
- 처음에 LiCoO₂는 고체반응에 의해 합성되었다. 고체합성은 세라믹 분말을 제조하는데 아주 간단하고 저렴한 방법으로 850~900℃에서 하소되기 전에 미 분쇄된 전구체는 혼합 된다. 고체합성은 많은 다른 종류의 전구체로부터 출발한다.
- 솔-젤과 저온 합성과 같은 거의 모든 제조방법은 평균입경이 서브마이크론인 초미세 LiCoO₂ 형성을 유도한다. 그러나 용융염 합성은 가장 큰 입경을 가진 LiCoO₂를 형성하는데 원인이 된다.
용도 및 특징[편집]
LCO라고도 불리는 리튬 코발트 산화물은 코발트 원자는 공식적으로 +3산화 상태이므로 IUPAC 이름 리튬 코발트(III) 산화물(lithium cobalt(III) oxide)이다. 리튬 코발트 산화물은 진한 파란색 또는 청회색 결정질 고체이며 일반적으로 리튬이온 배터리의 양극에 사용된다. 현재 가장 많이 사용되는 리튬이온 기술은 LiCoO2로 구성된 음극이 있는 리튬코발트 산화물 배터리이다. LCO 배터리의 주요 특징은 휴대 전화, 태블릿, 노트북 및 카메라와 같은 휴대용 장치의 장기 실행시간으로 변환되는 높은 에너지 밀도이다. 양극재는 60%의 코발트를 함유하고 있으며 음극 중량의 50%를 차지한다. LCO 배터리는 수명이 짧고 고온 및 저온에서 상대적으로 낮은 안전 성능을 갖는 단점이 있다. LCO의 기술은 음극 및 전해질 용액에 중점을 둔 대부분의 연구를 통해 지속적으로 개선되고 있다. 양극은 잘 최적화된 것으로 간주되어 약간의 개선이 가능하다. 리튬 코발트 산화물은 또한 안료(Pigments), 도금제 및 표면 처리제 및 낮은 등급의 코발트 망간 산화물 등급 블렌드를 만드는 데 사용되는 원료로 사용된다.
리튬 코발트 산화물은 유리, 광학 및 세라믹 응용 분야에 적합한 매우 불용성 열 안정성 물질이다. 산화 화합물은 전기에 전도성이 없다. 그러나 특정 페로브스카이트(Perovskite) 구조 산화물은 고체 산화물 연료 전지 및 산소 발생 시스템의 음극에서 전자 전도성 발견 응용 분야이다. 이들은 하나 이상의 산소 음이온과 하나의 금속 양이온을 포함하는 화합물이다. 이들은 일반적으로 수용액(물)에 불용성이며 매우 안정적이어서 점토 보울을 첨단 전자 제품에 생산하는 것과 같이 간단하게 세라믹 구조 연료전지와 같은 항공 우주 및 전기 화학 응용 분야의 경량 구조 부품에 유용하다. 금속 산화물 화합물은 염기성 무수물이므로 산화환원 반응에서 산 및 강력한 환원제와 반응할 수 있다.
그래핀(graphene) 파우더를 첨가하면 LiCoO₂가 음극 재료로서의 성능이 향상된다. 그래핀 파우더의 다른 중량 백분율을 통합함에 따라 리튬이온 배터리(LiB)는 충전 및 방전 특성에서 뚜렷한 변화를 나타냈다. 0.5wt.% 그래핀 파우더가 포함된 음극이 있는 전지는 0.1 C 및 0.5 C 전류에서 가장 높은 방전 용량을 나타냈으며, 1 wt.% 그래핀 파우더를 포함하면 0.1C에서 까지의 전류에서 음극의 가장 안정적인 성능에 기여했다. 또한, 2 wt.% 그래핀 파우더가 포함된 음극이 있는 전지는 음극의 더 높은 방전 용량을 나타냈다.[2]
리튬이온 배터리 양극재[편집]
배터리는 양극과 음극, 전해질 이렇게 세 부분으로 이루어진다. 리튬이온 배터리의 경우 음극재는 보통 흑연(탄소)을 쓰므로 걱정이 없지만 문제는 양극재다. 보통 리튬금속산화물(LiMO₂로 나타내는데 M이 금속(metal)이다)을 쓰는데, 리튬 코발트 산화물(LiCoO₂)이 가장 우수한 양극재로 오늘날 모바일 전자기기에 쓰이는 배터리 대부분에 쓰인다.
리튬은 양이온의 형태(Li+)로 전해질을 통해 음극과 양극 사이를 왔다 갔다 하며 충전과 방전을 반복한다. 이를 화학식으로 나타내면 이렇다.
(충전된 상태) LiC₆(음극) + CoO₂(양극) ⇆ C₆(음극) + LiCoO₂(양극) (방전된 상태)
여기서 C₆은 흑연의 육각형 고리를 이루는 탄소원자 여섯 개를 의미한다. 즉 충전을 하면 음극에서 탄소분자 여섯 개에 리튬이 하나꼴로 들어간다는 말이다. 반면 방전이 됐을 때(기본 상태) 양극에서는 리튬과 코발트가 1:1이다. 그런데 리튬은 원자량이 7(양성자 3개, 중성자 4개)에 불과한 반면 코발트는 59(양성자 27개, 중성자32개)나 된다. 따라서 무게로 따지면 리튬이온배터리에는 리튬보다 코발트가 8배 이상 많이 들어간다. 그래도 양극과 음극을 오가는 게 리튬이온이므로 이름은 리튬이온 배터리다.
한편 전기차용 배터리에는 성능은 약간 떨어져도 가격 경쟁력이 높은 혼합금속산화물을 양극재로 쓴다. 즉 코발트에 니켈(Ni), 알루미늄(Al), 망간(Mn)을 적당한 비율로 조합한 형태다. 오늘날 전기차 르네상스를 이끌고 있는 테슬라의 경우 리튬니켈코발트알루미늄산화물(LiNi0.8Co0.15Al0.05)이 양극재인 리튬이온배터리를 쓴다. 그래도 무게로 따지면 여전히 코발트가 더 많이 들어간다(리튬 1에 코발트 1.28).[3]
각주[편집]
- ↑ 오로라 모바일, 〈리튬 이온 전지의 종류와 특성, 리튬 폴리머, 리튬 코발트 산화물, 리튬 인산철, 리튬 망간〉, 《네이버 블로그》, 2010-10-23
- ↑ GoodFellow, 〈리튬 코발트 산화물(Lithium Cobalt Oxide)의 용도 및 특징〉, 《네이버블로그》, 2021-05-26
- ↑ 강석기 과학칼럼니스트, 〈(강석기의 과학카페) 배터리 핵심소재 리튬 vs 코발트, 누가 더 귀한 몸?〉, 《동아사이언스》, 2018-03-20
참고자료[편집]
- LiCoO2의 형성, 구조, 리튬과 산소의 비화학량론, 전기화학적 거동 그리고 물질이동 특성 - file:///C:/Users/sms/Downloads/LiCoO2%EC%9D%98%20%ED%98%95%EC%84%B1,%20%EA%B5%AC%EC%A1%B0,%20%EB%A6%AC%ED%8A%AC%EA%B3%BC%20%EC%82%B0%EC%86%8C%EC%9D%98%20%EB%B9%84%ED%99%94%ED%95%99%EB%9F%89%EB%A1%A0,%20%EC%A0%84%EA%B8%B0%ED%99%94%ED%95%99%EC%A0%81%20%EA%B1%B0%EB%8F%99%20%EA%B7%B8%EB%A6%AC%EA%B3%A0%20%EB%AC%BC%EC%A7%88%EC%9D%B4%EB%8F%99%20%ED%8A%B9%EC%84%B1.pdf
- 〈리튬 코발트 산화물〉, 《위키백과》
- 강석기 과학칼럼니스트, 〈(강석기의 과학카페) 배터리 핵심소재 리튬 vs 코발트, 누가 더 귀한 몸?〉, 《동아사이언스》, 2018-03-20
같이 보기[편집]

 위키원
위키원