산소
산소(Oxygen)는 화학 원소의 하나로, 원소 기호는 O이고 원자 번호는 8이다. 일반적으로 산소원자 두 개가 결합하여 무색, 무미, 무취인 기체 상태로 존재한다. 공기의 주성분 중 하나로, 지구 뿐만 아니라 우주 전체에 걸쳐 다른 원소와 공유 결합된 상태로 널리 퍼져 있다.
유리 산소(산소 분자, O₂)가 처음으로 지구 대기에 나타난 것은 고원생대로, 혐기성 생물(세균 및 고균)의 물질 대사 과정의 부산물로 만들어졌다. 유리 산소의 증가는 그 당시 대부분의 생물들을 죽음으로 몰아 갔으나, 반대로 산소를 이용하는 새로운 생물이 등장하는 계기가 되었다. 또한 오존층의 형성으로 육상생물이 등장하는 계기도 마련해주었다. 산소는 대부분 광합성 작용으로 만들어지는데, 약 4분의 3은 대양의 식물성 플랑크톤과 조류가, 나머지 4분의 1은 육상 식물이 만든다.
사람에게도 생명활동에 꼭 필요한 물질로써, 산소가 결핍되면 5분이 지나 뇌사 상태에 빠지고 8분 뒤면 사망한다. 사람을 비롯한 동물군의 체내에서 산소를 운반하는 것은 적혈구의 주요 역할이다.
목차
개요[편집]
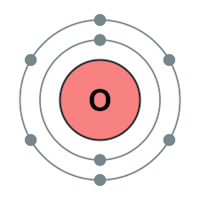
산소는 주기율표 16족에 2주기에 속하는 칼코겐(chalcogen) 원소로 적색 거성의 내부에서 탄소의 핵이 헬륨의 핵인 알파 입자와 융합해서 만들어진 원소이다. 원자량은 16, 녹는점 -218.79℃, 끓는점 -182.95℃, 밀도는 1.429g/L이다. 질량(mass)으로 지각에서 가장 풍부한 화학원소이며 우주에서 수소와 헬륨 다음 세 번째로 많은 원소이다. 상온에서 이원자 분자(O₂)로 존재하며 반응성이 커서 거의 모든 원소와 반응하여 산화물을 만든다. 질량수가 16인 동위원소, 즉 ¹⁶O이 대부분이고, 소량으로 존재하는 ¹⁸O, ¹⁷O의 원자핵도 안정하다. 산소 원자의 8개 전자 중에서 2개는 주양자수가 1인 첫 번째 전자껍질에 들어가고, 나머지 6개는 주양자수가 2인 두 번째 전자껍질에 들어간다. 즉 산소의 원자가 전자(valence electron), 또는 최외각 전자 수는 6이다. 이 원자가 전자의 수가 산소의 원자가, 결합 에너지, 전기음성도, 산화력, 결합(peroxide bond)의 안정도 등 산소의 화학적 성질을 결정한다.
역사[편집]
영국인 조제프 프리스틀리(Joseph Priestley, 1733 ~ 1804, 1774년에 발견)와 스웨덴인 칼 빌헬름 셸레(1773년에 발견) 두 사람이 발견했다. 셸레가 먼저 발견했지만, 프리스틀리가 셸레보다 먼저 산소에 대한 논문을 발표했기 때문에 산소의 발견자가 프리스틀리로 알려진 것이다. 프리스틀리는 플로지스톤설을 따랐기 때문에 자신이 발견한 새로운 공기를 플로지스톤이라고 생각했다. 프리스틀리는 자신이 발견한 새로운 공기를 앙투안 라부아지에에게 알렸고, 라부아지에의 계속된 실험을 통해 새로운 원소로 인정받아 1778년 '산소'라는 이름이 붙여졌다.
문제는 산(oxy)을 만든다(generate)고 해서 산소(oxy+gen)였는데, 일반적으로 산이라고 부르는 물질에 들어가 있는 것들은 수소이다. 즉 원래대로 라면 수소와 산소를 반대로 부르는 것이 오히려 뜻에 맞다. 정작 산소는 알칼리성을 띠는 수산화 이온(OH⁻)에 있으며, 금속 산화물이 산성 용액과 반응할 때 산화 이온이 브뢴스테드-로우리 정의에 의한 염기로서 작용하기도 한다. 당시엔 분자식 같은 체계도 없었고 화학이 이제 막 정립됐을 시기라 몰랐지만. 그래도 명명당시의 라부아지에를 조금 변호해보자면, 원소를 산화시켜서 산소를 덕지덕지 붙인 것이 protonation 되면 산이 되기는 한다. 탄산, 질산, 인산, 황산, 염소산 등등의 구조를 생각해보자. 참고로 말하면 화학에서 '산화'라고 하는 것도 원래는 '산이 된다'는 뜻이었다. 물질이 산소와 결합하는 것을 산화된다고 하는 것이 바로 그런 이유에서다. 그러나 이 역시 당대 화학 지식이 부족했던 탓으로 현재는 화학에서 '산화'와 '산이 된다'의 의미가 맞지 않게 되었는데, 루이스 산염기 정의를 쓰면 어떻게 끼워 맞출 수 있기는 하다.
존재[편집]
자연에서의 존재[편집]
산소는 질량 백분율로 대기와 해양을 포함한 지각의 49.5%를 차지한다. 건조한 공기에서 산소는 부피 백분율로 20.946%를 차지한다. 지각에 존재하는 산소는 대부분이 규산염이나 산화물, 물의 형태로도 존재한다. 물에 포함된 산소는 지각에 존재하는 산소 전체의 질량 백분율의 88.81%를 차지한다. 우주에는 수소,헬륨 다음으로 많이 존재하는 원소이나 그 존재 비율은 낮다.
많은 양의 산소가 호흡, 연소 등으로 사용되지만 대기 중의 산소의 비율은 거의 일정한데, 이는 광합성 때문이다. 광합성이 진행되면서 이산화탄소와 물이 소비되고 포도당과 산소가 생성된다.
동위 원소[편집]
대기 중의 산소는 세 종류의 동위 원소로 이루어져 있는데, ¹⁶O가 99.759%, ¹⁷O가 0.037%, ¹⁸O가 0.204%를 차지한다. 대기 중의 산소는 대부분 이원자 분자 상태로 존재한다. 물에 존재하는 산소의 경우 지역에 따라 동위 원소의 비율이 다르게 나타난다.
¹⁴O, ¹⁵O, ¹⁹O는 인공적으로 합성되는 방사성동위원소이다. 이들은 반감기가 매우 짧은데, 이중 가장 긴 반감기를 가진 동위 원소는 반감기가 약 120초인 ¹⁵O이다.
동소체[편집]
산소의 동소체는 이원자 분자 형태의 O₂, 오존으로 알려진 삼원자 분자 형태의 O₃, 희귀하고 불안정한 O4 등이 있다. O₄는 자성을 띠지 않고 옅은 푸른 빛깔을 띤다. O₄ 분자는 쉽게 해리되어 O₂ 두 분자를 생성한다.
지구 대기에 존재하는 오존의 90% 이상이 지표로부터 15~40km 고도의 오존층에 위치하고 있으며, 생명체에게 해로운, 우주로부터 오는 단파 자외선을 거의 흡수한다. 그러나 지표 가까이에 존재하는 오존은 강한 산화력을 가지며 건강에 해로워 대기 오염물질로 취급한다.
산소의 특성[편집]
원자 반지름[편집]
보어 반지름이라고 알려진 수소 원자의 반지름은 0.53 Å(옹스트롬, 1 Å m; 0.53 Å pm)인데 비해 산소 원자의 반지름은 0.60 Å으로 수소와 거의 비슷하다. 산소의 유효 핵전하가 커서 최외각 전자들이 핵에 강하게 끌리기 때문이다. 그래서 산소는 수소와, 그리고 같은 주기의 탄소나 질소와 전자 구름의 중첩이 쉽고, 결과적으로 강한 공유 결합을 만든다. 뿐만 아니라 산소는 이중결합을 통해 O₂ 분자를 만든다. 3주기에서 산소와 같은 족에 속하는 황이 S2 분자를 만들지 못하는 것과 대비된다.
전기음성도[편집]
유효 핵전하가 큰 산소는 전기음성도가 3.5로 4.0인 플루오린에 이어 모든 원소들 중에서 두 번째로 전기음성도가 높다. 그런데 홀수 번호인 플루오린은 산소에 비해 양이 적고, 원자가가 1이기 때문에 산소처럼 다양한 결합을 만들지 못한다. 게다가 플루오린은 한번 끌어간 전자를 웬만해서는 다시 내놓지 않기 때문에 산소처럼 다양한 반응에 참여하지 못한다. 그래서 산소는 화학적으로 특별한 위치를 차지한다. 그리고 높은 전기음성도 때문에 산소는 많은 화학 반응에서 주도적 역할을 담당한다. 산소와 결합하는 대부분의 원소는 산소에게 전자를 내어주고 산화된다. 또한 산소의 높은 전기음성도는 산화물의 산-염기 특성을 결정한다.
결합 에너지[편집]
극성이 있는 O - H 단일 결합의 에너지는 467 kJ/mol로 H - H 결합 에너지인 436 kJ/mol보다 크다. 한편 산소 분자의 이중결합의 에너지는 498 kJ/mol로 O - H 나 O - H 단일 결합 에너지와 비교해 그것의 2배는 커녕, 크게 다르지 않다. 이러한 예상 외의 사실은 루이스 구조를 통해 이해할 수 있다. O₂분자에서 각각의 산소 원자는 두 개의 비공유 전자쌍(고립 전자쌍)을 가지는데 이중결합 때문에 산소 원자 사이의 거리는 짧고 결과적으로 4개의 비공유 전자쌍이 가까이에서 반발하게 된다. 그래서 산소 원자 사이의 이중결합은 의외로 그리 강하지 않다. 이러한 비공유 전자쌍의 반발 효과는 F₂분자에서도 볼 수 있다. 도합 6개의 비공유 전자쌍이 반발하는 F₂분자에서 F - F 단일 결합 에너지는 H - H 에 비해 매우 낮은 149 kJ/mol이다. 한편 비공유 전자쌍의 반발 효과가 없는 C - H 결합 에너지는 410 kJ/mol이고, 유기 화합물에서 많이 볼 수 있는 카보닐기에서 C = O 이중결합의 에너지는 732 kJ/mol로 상당히 강하다. 탄소는 양쪽으로 다른 탄소나 수소와 결합해서 비공유 전자쌍이 없기 때문이다. 산소의 약한 이중결합 에너지 덕분에 산소는 열이나 자외선에 의해 비교적 쉽게 원자로 분해되어서 연소를 돕고, 오존층을 만들며, 생체 환경에서 산화 작용을 한다. 산소의 이중결합이 보다 강했다면 불을 피우기도 어렵고, 세포의 호흡 작용으로 체온을 유지할 수도 없었을 것이다. 대기권의 상층부에 오존층이 만들어져서 약 4억 년 전에 동물이 육상으로 진출하고 인류로 진화할 시간을 얻은 것도 산소의 약한 이중결합 에너지 덕분이다.
산소의 화합물[편집]
물[편집]
원자가가 2인 산소 원자가 양쪽으로 수소와 결합하면 물이 된다. 물은 우주 공간에서 일산화 탄소(CO)에 이어 두 번째로 풍부한 화합물이고, 가장 풍부한 3원자 분자이다. 물은 체중의 70% 정도를 차지하는 생명의 매트릭스 물질이다. 수소와 산소의 큰 전기음성도 차이 때문에 O - H 는 극성 결합이고, 굽어진 구조의 물은 극성 분자이다.
이산화탄소와 이산화실리콘[편집]
탄소가 양쪽으로 산소와 이중결합을 이루면 이산화탄소가 된다. 이산화탄소는 C=O 결합의 극성이 양쪽으로 상쇄된 무극성 분자이고 상온에서 기체이다. 산소는 탄소보다 반지름이 상당히 큰 실리콘(규소, Si)과는 전자 밀도의 중첩이 크지 않아서 이중결합을 잘 만들지 못하고, 대신 단일결합으로 이루어진 이산화실리콘은 분자 결정으로 지각의 주성분 역할을 한다. 엔트로피 면에서는 이산화탄소 기체의 단일분자 구조가 유리하다. 따라서 산소와 실리콘이 이중결합을 만들 수 있다면 고체 지각은 불가능할 것이다.
유기화합물의 작용기[편집]
산소가 한 쪽으로는 수소와 결합해서 하이드록실기(–OH)를 만들고 다른 쪽으로는 알킬기와 결합하면 알코올이 된다. 산소가 탄소와 이중결합을 만들어 카보닐기(-C=O)를 형성하고 카보닐기 탄소가 두 개의 알킬기와 결합한 화합물을 케톤이라 하고, 카보닐기 탄소가 수소와 결합하면 해당 화합물을 알데하이드( -CHO )라 한다. 카보닐기의 탄소가 –OH와 결합하면 작용기 -COOH 를 카복실기라 하며 이러한 작용기를 가진 화합물을 카복실산이라 한다. 알코올 화합물 C-O-H 에서 산소 원자에 수소 원자 대신 알킬기가 결합한 C-O-C 화합물을 에터(ether)라 한다. 이처럼 유기 화합물이 다양한 작용기를 가지는 것은 대부분 산소의 작용에 의한 것이다. 산소 분자의 이중결합이 약한 것과 같은 이유로 퍼옥사이드 결합( C-O-O-C )은 약하다. 그리고 옥텟 규칙을 만족시키지만 산소가 셋 이상 결합한 -O-O-O 식의 화합물은 찾아볼 수 없다. 거의 무한히 결합할 수 있는 탄소와 대비된다.
산과 염기[편집]
HCl에서는 수소가 자신보다 전기음성도가 높은 염소에 의해 산화되어 염소에게 전자를 내주고 수소 이온으로 해리해서 산의 성질을 나타낸다. 마찬가지로 탄산, 질산, 황산, 인산 등 산소산에서는 산소와 결합한 수소가 산으로 해리한다. 물에서 하나의 수소가 전기음성도가 낮은 소듐, 포타슘 등으로 치환된 Na-OH , K-OH 의 경우에는 산소가 수소보다 금속 원소로부터 전자를 얻기 때문에 K⁺와 OH⁻ 이온으로 해리해서 알칼리성을 나타낸다.
질산과 인산[편집]
질소의 산소산인 질산은 한 개의 –OH기를 가진 1가산이다. 그러나 인의 산소산인 인산은 3개의 –OH기를 가진 3가산이다. 질소보다 반지름이 큰 인은 확장된 옥텟을 허용하기 때문이다. 이 사실은 특히 생명 현상에서 엄청난 의미를 지닌다. DNA 이중 나선의 당-인산 골격에서 2개의 –OH기는 양쪽으로 디옥시리보스와 결합해서 긴 나선을 만든다. 그리고 남은 하나의 –OH는 이온화해서 핵산이 산의 성질을 가지게 한다. 같은 원리는 세포의 에너지 화폐라 볼 수 있는 ATP에서도 찾아 볼 수 있다.
할로젠 논란[편집]
산소는 할로젠 원소들과 성질이 비슷하기 때문에 질소와 함께 할로젠으로 분류되는 경우가 있다. 하지만 비금속 원소로 분류해야 한다는 의견도 만만치 않다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원