전기분해
전기분해(電氣分解, electrolysis)는 외부에서 전기 에너지를 가하여 전기 화학적인 산화환원반응을 통해 물질을 분해하는 과정이다. 산화반응이 일어나는 전극을 산화 전극(anode)이라고 하고, 환원반응이 일어나는 전극을 환원 전극(cathode)이라고 한다. 전기분해 반응에서 산화 및 환원 반응은 항상 동시에 일어나고 전체적으로 흐르는 전류는 동일하다.
전기분해는 자발적으로 발생하지 않는 화합물의 분해 반응을 직류 전기를 사용하여 발생하도록 하여 원하는 물질을 얻는 기술을 말한다.
전기분해를 위해서 3가지 기본 요소가 필요하다. 우선 분해하고자 하는 물질, 즉 전해질이 있어야 하는데, 전해질은 자유롭게 움직일 수 있는 이온을 포함하고 있어야 한다. 그리고 직류 전압을 가할 수 있는 두 개의 전극인 양극(anode)과 음극(cathode)이 있어야 하고, 여기에 외부에서 직류 전류가 공급되어야 한다. 외부에서는 전류가 도선을 따라 흐르고, 전자가 전하 운반자(carrier of electric charge) 역할을 한다. 한편, 전해질 내부에도 전류가 흐르며 여기에서는 이온들이 전하 운반자 역할을 한다. 전극으로는 금속, 흑연, 반도체 등이 사용되는데, 전기 분해하고자 하는 물질과 원하는 물질의 생성에 소요되는 비용에 따라 적절히 선택하여야 한다. 전기분해 기술은 광물에서 원소를 분리해내는 과정으로서 산업적으로 사용되기도 한다.
목차
개요[편집]
산화·환원반응의 일종으로, 전기를 이용해서 물질을 분해하는 과정이다. 화학전지의 일종이며, 전해전지에 해당한다. 참고로 화학전지는 크게 갈바니 전지와 전해전지로 구분할 수 있으며, 전해전지는 전기에너지를 화학에너지로 변환하는 장치이다. 자발적으로 산화환원반응이 일어나지 않는 경우 전기에너지를 공급해 비자발적인 반응을 이끌어내는 과정이므로, 당연하게도 전기를 공급해주어야 분해가 일어난다(참고로 전기분해 반응은 경우에 따라서는 전지를 충전하는 과정으로 볼 수도 있다). 전기를 받아서 결합을 끊는 데 1가 이온 1㏖이 생성되기 위하여 96485.3C의 전하량이 필요하다. 물론 2가 이온 1㏖이 생성되기 위해선 2배의 전하량이 필요하다. 또한 1C (1쿨롬)은 1 A의 전류가 1초간 흐른 양이다.
이러한 전기를 통한 물질의 분해가 가능한 것은 화학결합에 전자가 크게 관여하고 있기 때문이다. 분리와 헷갈리면 안 된다. 좀 더 정확하게 말하자면, 분리는 물리적 과정으로 분자에 변화가 생기지 않는 과정을 말하며, 분해는 화학적 과정으로 분자에 변화가 생기는 과정을 말한다. 설탕물을 물과 설탕으로 나눠도(가열하면 설탕만 남을 것이고 물은 액화를 통해 다시 액체로 만들면 된다) 설탕물(혼합물)을 이루는 분자인 물과 설탕은 그대로 있다. 하지만 물(화합물)을 전기 분해하면 수소와 산소로 분해되며, 물이라는 분자가 수소와 산소라는 분자로 변화하기 때문에 전기 분해는 화학적 과정이라고 할 수 있다.
(+)극(anode)에서는 음이온이 전자를 잃고, 즉 산화됨으로써 물질이 나오며, 반대로 (-)극(cathode)에서는 흘러나온 전자를 양이온이 얻어, 즉 환원됨으로써 물질이 나온다. 극판이 반응을 하면 원하던 반응이 일어나지 않으므로 보통 반응성이 작은 백금(Pt)이나 탄소(C)를 사용한다. 화학전지와는 반대로 (+)극에서 산화반응이, (-)극에서 환원반응이 일어나므로 헷갈리면 안 된다. 화합물의 경우는 그냥 분해가 되지만, 혼합물의 경우는 이온화 경향이 작은 물질부터 분해되어 나온다. 참고로 이 반응이 일어날 때에는 전자가 아니라 이온이 이동하면서 전류가 흐른다. (+)극은 전자를 받고, (-)극은 전자를 방출하니, (-)극에서는 전기적으로 다른 극이어서 전자기력으로 이끌린 양이온이 방출되는 전자를 받고, (+)극에는 음이온이 전자를 방출하는 것이다.
역사[편집]
전기 분해라는 용어는 19세기 초 마이클 패러데이(Michael Faraday)에 의해 도입이 되었다. 패러데이는 전기 분해 과정에서 생성되거나 소모되는 물질의 양은 전기 분해 과정에서 가해 주는 전하량에 의해 결정된다는 사실을 밝혔다. 전자 1몰을 공급해 주었을 때 가해지는 전하량을 1 F(패러데이)로 정의하였는데, 이 값은 전자 하나의 전하량(1.6022×10⁻¹⁹ C)에 아보가드로의 수(6.022×10²³ mol-1)를 곱한 것으로 약 96,485 C/mol에 해당한다. 하지만 전기 분해의 역사는 패러데이가 용어를 도입하기 이전으로 거슬러 올라가며 대표적인 예는 아래와 같다.
- 1800년: 윌리엄 니콜슨(William Nicholson)이 물을 전기 분해하여 수소와 산소를 발생시킴.
- 1808년: 험프리 데이비(Humphry Davy)가 전기 분해를 통해 포타슘, 소듐, 칼슘 등을 발견.
- 1821년: 윌리엄 토마스 브란데(William Thomas Brande)가 전기 분해를 통해 리튬 발견.
- 1833년: 마이클 패러데이(Michael Faraday)가 전기 분해 개념을 도입하고 양적 관계를 확립하는 수식 제안.
- 1886년: 앙리 무아상(Henri Moissan)이 전기 분해를 통해 불소 발견.
- 1886년: 알루미늄 생산을 위한 홀-허라울트(Hall–Héroult) 공정 개발.
수소 에너지 개발의 필요성에 따른 연구[편집]
화석연료로부터 비롯된 에너지 위기가 심화되면서 신재생에너지, 그 중에서도 수소에너지에 대한 학계와 산업계에서 많은 관심을 받고 있다. 화석연료의 경우 고갈 위기와 더불어 환경오염의 측면에서 많은 문제가 있었다. 이로 인해 화석연료를 대체할 친환경적이고 무한한 신재생에너지에 대한 연구가 이어져 왔고, 그 중에서도 energy carrier로 수소에너지가 대두 되고 있다. 수소의 경우, 공기 중에서 연소될 때 산소와 반응하는데(2H₂(g) + O₂(g) → 2H₂O(l)) 다른 오염물질은 방출하지 않고 오직 물만 방출하므로 매우 친환경적이다. 또한, 수소에너지는 물이라는 풍부한 자원이 원료이므로 무한한 자원으로 여겨진다. 수소의 질량당 에너지 밀도는 142kJ/g으로 휘발유의 4배, 천연가스의 3배 수준으로 고효율이며, 다양한 형태로 저장이 용이한 점은 수소에너지를 이상적인 energy carrior으로 꼽는 이유이다.
물의 전기분해(수전해)[편집]
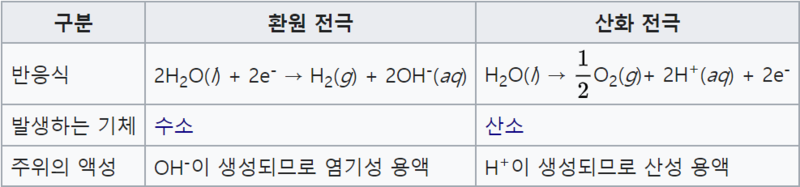
수소를 생산하기 위한 많은 연구가 진행되고 있으며 그 중에서도 적은 에너지를 가지고 반응을 쉽게 일으키게 하는 전극촉매에 쓰일 물질에 대한 연구가 많은 관심을 받고 있다. 현재까지 수소를 대량 생산하기 위해 가장 경제적인 방법은 화석연료로부터의 추출이다. 하지만, 앞에서 다룬 것처럼 화석연료의 사용은 많은 문제점을 일으키고 있어 대안이 필요한데, 그 중 하나는 수전해(H₂O(l) → H₂ + 1/2O₂(g))이다. 수전해란 물에 전기에너지를 가해 수소와 산소로 분해하는 것으로 이러한 연구의 핵심은 수전해에 필요한 에너지를 낮춰주는 전극촉매에 있다. 물을 전기 분해할 때 +극과 -극에서 발생하는 기체의 성질을 확인할 수 있다. 수산화나트륨을 조금 넣은 물에 전류를 흘려 준 후 생성 물질을 확인할 수 있다. 물의 공유 결합이 끊어지면서 물은 수소와 산소로 전기 분해된다.수전해는 크게 수소 발생 반응(hydrogen evolution reaction(HER), 2H⁺ (aq) + 2e⁻ → H₂ (g))과 산소 발생 반응(oxygen evolution reaction(OER), 2 H₂O (l) → 4e⁻ + 4H⁺ (aq)+ O₂ (g)), 위 두 가지 반쪽 반응(half-reaction)으로 구성된다. 그 중 산성 용액에서 HER에 가장 우수한 촉매로 꼽히는 물질은 바로 백금(Pt)이다. 그러나 백금은 매장량이 매우 적고 단가가 높아 공정에 적용하기 어렵다. 이에 따라 백금을 대체할 새로운 물질에 대한 많은 연구가 진행되고 있다.
- 각 전극에서 일어나는 반응
하지만 환원전극에서는 전해질의 음이온이 환원되고 산화전극에서는 양이온이 산화되므로 대부분의 경우 환원전극 주위의 액성은 염기성, 산화전극은 산성 용액이 된다.
- 전체 반응
2H₂O (l) → 2H₂(g) + O₂(g)
H₂와 O₂의 계수비가 2:1이므로 발생하는 수소:산소 기체의 부피비 = 2:1
유기물 수전해[편집]
수소를 연료로써 사용하기 위해서 현재 많은 관심을 받고 있는 방법은 신재생에너지로 부터 전력을 공급받아 물전기분해장치를 통한 수소 발생이다. 하지만 물전기분해 시 매우 높은 과전압(E°rev = 1.23 V)을 필요로 하게 되어 전체적으로 시스템 효율을 낮추는 영향을 미치고 있다. 이런 이유로 물전기분해 장치의 스택은 4.2 kWh m−3의 전력이 요구되며, 실제 상용 시스템의 경우 6 kWh m−3 이상의 전력을 필요로 한다. 유기물수전해 (organic solution assisted water electrolysis) 방식은 이를 보완하고자 알코올류 (에탄올, 메탄올), 글리세롤, 개미산 등의 유기물과 물을 혼합한 연료를 이용하여 전기분해를 통해서 수소를 얻는 방법이 최근 다각도로 연구되고 있다.
탄소-물 공동 전기분해[편집]
고체 탄소와 물을 전기분해 하여 수소를 얻는 방법으로 탄소/석탄 보조 물전기분해(Carbon/coal-assisted water electrolysis; CAWE)라고도 한다. 이 방법은 물전기분해에서 공동으로 탄소가 반응식에 참여함으로써 수소 생산 작동 thermo-neutral 전압을 이론적으로 약 0.46 V at 25'C (저온 수전해 방식) 혹은 고온수전해 방식의 경우 약 0.26 V at 827'C까지 낮출수 있으며, 기존의 PEM 수전해 방법의 1.48 V at 25'C 보다 1/3가량 전력 소비를 줄일 수 있는 획기적인 수소 생산 방법이다. 이 방법은 Coughlin and Farooque 이 Nature지에 1979년 발표되었으나, 수소생산 보다는 석탄 개질/황 제거 등의 다른 전기화학적 연구가 더 집중되었다가 최근 석탄 활용의 친환경적인 이용 방법의 다변화를 위해서 최근 다시 떠 오르고 있는 공정이다.
전기분해 반응[편집]
- 산화와 환원, 에너지방출, 패러데이 법칙
전기분해의 핵심 반응은 외부회로를 통해 공급 또는 제거되는 전자를 통해 원자와 이온간의 전달이다. 전기분해를 통해 생산하고자 하는 물질은 전해질과 다른 물리적 형태를 띨 수 있다. 예를 들어 소금물 전기분해는 수소와 염소를 생산하는데 생산물은 가스형태이며, 가스들만 별도로 수집된다. 전해질을 함유하고 있는 액체는 통상적으로 다음과 같이 생산된다.
- 가동이온을 생산하기 위해 이온 화합물을 (물에)녹이거나 반응시키는 방법
- 이온화합물을 가열하여 녹이는 방법
전해질에 잠겨있는 전극 한쌍을 통해 전기적 전위가 공급된다. 각 전극은 상반된 전하를 띄는 이온들을 당기게 된다. 양전하들은 전자를 공급하는 전극인 음극을 향하며, 음전하는 전자를 회수하는 전극인 양극으로 향한다. 이 반응 중에서 전자는 흡수 또는 방출된다. 중성을 띄는 원자들은 전자를 잃거나 얻으면서 양이온 또는 음이온이 된다. 이온이 전자를 얻거나 잃는 경우에는 전하를 띄지 않는 원자가 되며, 전해질에서 분리되어 나온다. Cu²⁺와 같은 양전하를 띄는 금속이온은 Cu로 변환되면서 음극 표면에 형성된다.
이러한 내용은 전기도금, 전해채취 및 전기제련이라 불린다. 이온이 전자를 얻거나 잃었음에도 중성이 되지 않는다면, 과정 중에서 전기전하는 변경된다. 화학에서는 전자를 잃는 경우에는 산화(Oxidation)그리고 전자를 얻는 경우에는 환원(Reduction)이라고 불린다.
산화화 환원[편집]
이온 또는 중성 분자의 산화는 양극(Anode)에서 발생한다. 예를 들어 양극에서는 제1철 이온 제2철이온으로 산화시킬 수 있다.
Fe²⁺(aq) → Fe³⁺ (aq) + e⁻
이온 및 중성 분자의 환원은 음극(Cathode)에서 일어난다.
음극에서는 페리시안 화합물을 페로시안 화합물로 환원시킬 수 있다.
Fe(CN)³⁻ + e⁻ → Fe(CN)⁴⁻
중성 분자들은 양극 또는 음극 모두에서 반응할 수 있다
수소 이온(H⁺ ion)은 용액의 산(acid) 뿐만 아니라 물과 메탄올과 같은 용매 자체에서 생산될 수 있다. 전기분해과정에서 수소이온이 생성되는 경우는 산성 용액에서 빈번하게 일어나며 알칼리용액에서는 수산화 이온(OH⁻)을 포함한 반응이 빈번하게 일어난다.
물과 같은 용매는 전극에서 산화화 환원이 일어난다. 가스확산전극(Gas diffusion electrode)를 사용하는 경우 가스를 활용한 전기분해가 일어나기도 한다.
에너지 방출[편집]
깁스 프리 에너지(Gibbs Free Energy)의 변화 및 시스템에서의 효율을 고려한 전기에너지가 공급되어야 한다. 이론적으로 0에 가까울 수 있으며, 최대 열역학 효율은 반응의 자유에너지변화로 나눠진 엔탈피Enthalpy) 변화로 설명될 수 있다. 대다수의 경우 반응의 엔탈피 변화보다 많은 양의 전기가 공급되기 때문에 일부 전기 에너지는 열의 형태로 방출 될 수 있다. 몇몇 경우 고온 수증기의 전기분해를 통해 수소와 산소를 생성하는 경우 주변에서 열을 흡수하게 되며, 생성된 열량은 공급된 전기보다 높다.
유사 기술[편집]
다음 기술들은 전기분해와 관련이 있다.
ᄋ수소연료전지를 포함한 전기화학 셀은 전기를 생산하기 위해 다른 표준전극전위를 사용한다. 이온의 반응, 전기분해 및 전기화학셀의 운전은 관련이 있을 수 있으나, 전기분해의 역반응으로 고려하면 안된다.
전기분해의 파라데이 법칙[편집]
- 전기분해 제1법칙
고체 및 용액에 녹아있는 소금이 분해되는 총량은 회로상에 공급되는 전류의 총량과 비례한다. 전극에서 생성되는 물질의 총량(m)은 전기 또는 정류 총량(Q)와 비례하며 다음 식에서 k는 전기공학 상수이다.
m= k•Q
또는
m=e•Q
여기서 e는 전극에 형성되는 금속 또는 전극에서 생산되는 가스의 전기화학당량(Electrochemical equivalent)이다.
- 전기분해 제2법칙
각각 다른 전해질/물질에 공급되는 총 전류가 같다면, 전극에 형성 및 생성된 물질의 총량은 당량(equivalent weight)과 같다.
산업에서 사용되는 전기분해[편집]
알루미늄을 생산하기 위한 할-에루 공정(Hall-Heroult process)
- 전기야금(Electrometal lurgy)은 전기분해를 통해 금속화합물에서 금속을 환원시켜서 순수한 금속을 추출하는 공정이다. 알류미늄, 리튬, 소듐, 칼륨, 마그네슘, 칼슘 및 구리가 전기야금법으로 생산된다.
- 클로로 알칼리(Chlor-alkali)공정을 통해 염소와 수산화나트륨을 생산.
- 염소산나트륨 및 염소산칼륨 생산
- Electrofluorination을 통한 과불소화 유기화합물 생산
- 저순도의 구리를 양극으로 사용하여 고순도의 구리 생산
전기분해는 그 외에도 다른 사용처가 존재한다.
- 핵잠수함 및 우주비행기에서의 산소생산
- 저렴한 전기를 통해서 수소 생산
전기분해는 고고학적 유물들을 세척 및 보호하는데 사용된다. 비금속 물질에서 금속물질을 분리해 낼 수 있기 때문에, 오래된 동전에서부터 자동차 엔진 부품 등을 세척하는데 사용될 수 있다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원