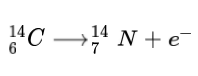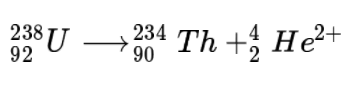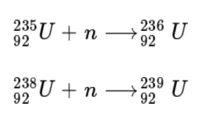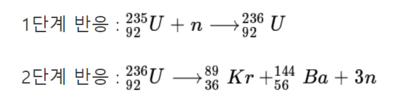원자핵
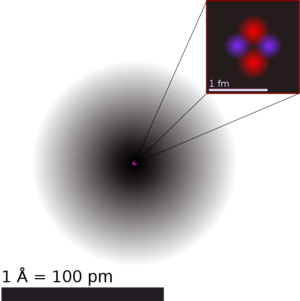
원자핵(原子核, atomic nucleus)은 원자 중심의 핵자(양성자와 중성자)와 중간자로 이루어진 작고 밀도가 높은 부분을 말한다. 지름은 (수소의 양성자 핵 크기인) 1.6 fm(10-15 m)에서 (우라늄 등의 무거운 핵의) 15 fm 정도이다. 이 크기는 원자 전체 크기의 23,000 분의 1(우라늄)에서 145,000 분의 1(수소)에 해당한다. 원자 질량의 대부분은 핵자를 이루는 양성자와 중성자의 질량이며, 원자핵 주위를 도는 전자의 질량은 아주 일부만을 차지한다. 원자핵의 바깥쪽에 있는 전자의 질량은 양성자 질량의 약 이므로 원자의 질량은 대부분 원자핵의 질량, 즉 양성자의 수와 중성자의 수에 해당하는 질량의 합계라고 할 수 있다.
원자 중에는 양성자의 수는 같으나 중성자의 수가 다른 원자핵을 갖는 동위 원소가 존재하며, 그 존재 비율은 장소나 물질의 종류에 관계없이 거의 일정한 비율로 존재한다.
원자 1개의 질량은 매우 작아서 보통 실험실에서 쓰이는 그램 단위의 질량을 차지하는 원자나 분자의 수는 1023∼1025개의 집단으로 되어 있다. 따라서 원자 1개의 정확한 질량을 이용하여 물질의 연구를 진행하는 것은 비실용적이다.
따라서 화학적 연구는 원자 1개의 질량보다는 원자 사이의 질량의 비율을 이용하는 것이 편리하기 때문에 기준이 되는 원자로서 탄소 원자의 동위 원소 중에서 질량수가 12인 것, 즉 12C를 국제적으로 12로 정하고, 이 기준 값과 비교한 모든 원자의 상대적 질량을 구하여 원소의 원자량으로 정하고 있다.
원자량의 기준이 되는 1원자 질량 단위(amu= atomic mass unit의 약자)는 탄소의 동위 원소인 12C의 원자 1개의 질량의 1/12로서, 실제로는 1.6605655×10⁻²⁴g이다. 따라서 어떤 원소의 원자량이란 이 질량을 1로 할 때 값이다.
개요[편집]
보통 원자를 표현한 그림에서는 이걸 크게 그리는데 사실 엄청 작다. 원자 전체의 크기가 야구 경기장이라고 치면 원자핵의 크기는 구슬 정도. 대성당 가운데 내려앉은 파리 정도의 크기라고도 비유된다. 비율을 보자면, 가장 작은 수소 원자핵은 전체의 1/145,000, 묵직한 우라늄 원자핵은 1/23,000, 발견된 원소 중 가장 무거운 오가네손 원자핵은 1/19,900의 크기를 갖는다.
주기율표의 원자번호는 원자핵에 존재하는 양성자의 개수를 뜻한다. 즉 원자번호 1인 수소는 양성자가 하나, 원자번호 92인 우라늄은 92개의 양성자를 가지고 있다. 여기서 중성자를 빼놓으면 섭섭한데, 양성자의 수는 같으나 중성자의 수가 다르면 동위원소가 된다. 원자번호 0인 원소는 없지만 원자핵이 없는 원소는 있다.
양성자의 수에 따라 어떤 원소인지가 결정나므로, 즉 원자가 가지고 있는 양성자의 수를 바꿔버리면 원소를 다른 원소로 인위적으로 바꾸는 연금술도 가능하다고 할 수 있겠다. 엄청난 비용이 든다는 단점이 있지만. 이에 대해서는 핵융합과 핵분열을 참조.
이 핵자들이 기본입자라고 불릴 때도 있었으나, 이들은 그저 세 개의 쿼크로 이루어진 바리온이다. 양성자는 2업1다운, 중성자는 1업2다운 쿼크로 구성되어 있다. 이 쿼크가 기본입자인데, 그렇다고 쿼크를 쪼개지 못한다는 건 또 아니다. 어쩌면 이렇게 계속 계속 쪼개기만 할 뿐 기본입자라는 건 존재하지 않을지도 모른다.
핵자들이 가지는 전하가 쿼크에서 결정나는데, 업쿼크는 +⅔e, 다운쿼크는 -⅓e 전하를 가지고 있고, 이에 따라 양성자는 +e 전하를 가지고 중성자는 전하를 가지지 않게 된다.
원자량 300 이상의 원소에서는 쿼크가 양성자와 중성자에 묶여있는 대신 자유롭게 섞여 있는 업-다운 쿼크 물질(udQM) 원자핵이 가능할 것이라는 이론도 있다. 양성자 또는 중성자들간의 결합이 아닌 쿼크간의 결합으로 이루어져 있으므로 방사성 붕괴에 대해 매우 높은 내성을 가질 것으로 예상된다.
발견과 역사[편집]
데모크리토스의 원자설[편집]
데모크리토스(기원전 460~370)는 모든 물질은 원자라고 불리는 눈에 보이지 않는 작은 입자로 이루어져 있다고 생각했다. 그러나 당시 주도적으로 받아 들여지던 아리스토텔레스의 4원 소설에 밀려 받아 들여지지 않았다.
돌턴의 원자모형[편집]
영국의 화학자인 존 돌턴(1766~1844)은 1808년 원자설을 발표했다. 돌턴은 물질을 한없이 쪼개면 더 이상 쪼갤 수 없는 원자라는 입자에 도달한다고 발표했다. 돌턴은 그의 원자론으로 인해 원자를 공 모양의 단단한 알갱이로 보았다. 이를 근거로 돌턴은 같은 종류의 원자는 크기 모양 질량이 같고 다른 원자로 변하지 않는다고 주장했다. 돌턴의 원자모형은 원자는 더 이상 쪼개지지 않는 단단한 공모양이다. 하지만, 음극선 실험 결과를 설명하기 어렵다는 한계점을 가지고 있다.
톰슨의 원자모형[편집]
영국의 물리학자 조지프 존 톰슨(1856~1940)은 1897년 새로운 원자모형을 발표했다. 음극선 실험을 통해 -전하를 띄고 있는 원자 안의 입자를 발견했다. 그 당시 까지만 해도 원자는 더 이상 쪼갤 수 없는 마지막 입자라고 생각 되었지만 톰슨의 발견으로 원자는 다른 물질로 쪼개질 수 있으며 전자가 존재 함을 밝혀냈다. 톰슨은 이를 근거로 양전하를 띠는 원자안에 전자가 박혀 있는 푸딩 모형을 주장했다. 음극선 실험을 통해 음극선은; 1.질량을 가진다, 2.음극선은 직진한다, 3.음극선은 -극 을 띤다라는 3가지 사실을 알았고 이 음극선이 전자라는 것을 밝혔다. 푸딩모형- +전하가 고르게 분포되어 있는 원자 속에 -전하를 띤 전하가 듬성 듬성 박힌 원자모형이다. 단점을 꼽자면, 러더퍼드의 알파 입자 산란실험에 대해서는 설명 불가하다는 점이다. 양성자의 발견한 사람은 골드슈타인으로, 골드슈타인은 진공방전관에 소량의 수소 기체를 넣고 높은 전압을 걸때 -극으로 이동하는 입자의 흐름을 발견하고 이를 양극선이라고 하였다. 러더퍼드는 양극선이 +전하의 흐름임을 발견하고 이를 양성자라고 이름 붙였다. 시간이 흘러 제임스 채드윅은 1932년 중성자를 발견하였다. 알파입자를 베릴륨 원자핵에 충돌시켰을때 전하를 띠지않는 입자의 방출을 관찰한 채드윅은 이를 중성자라고 이름 붙였고 이를 통해 헬륨 원자핵의 질량을 설명할 수 있게 되었다. 이전까지는 양성자만 발견되어 헬륨 원자핵의 질량을 설명할 수 없었다.
러더퍼드 원자모형[편집]
톰슨의 제자였던 어니스트 러더퍼드(1871~1937)는 알파입자 He2+산란 실험으로 원자핵을 발견했다. 알파 입자를 얇은 금박에 충돌시키면 대부분의 알파 입자를 통과하나 극히 일부의 알파 입자가 튕겨져 나오는 것을 발견하였다. 알파 입자 산란 실험을 통해 러더퍼드는 원자의 중심에 원자의 질량 대부분을 차지하는 +전하를 띠는 물질을 발견했고 이를 원자핵이라고 불렀다. 그리고 이를 근거로 원자핵 중심에 톰슨이 발견한 전자가 돌고 있는 행성 모형을 주장했다. 행성모형은 부피가 작고 밀도가 큰 +원자핵이 중심에 있고, 그 주위를 -전하를 띠는 전자가 돌고 있다는 개념이다. 즉, 원자핵의 질량을 최초로 밝혀낸 원자모형이라고 말할 수 있다. 하지만 원자의 안정성과 수소원자의 선 스펙트럼에 대해 설명하기에 한계점이 있었다.
보어의 원자모형[편집]
닐스 보어(1885~1962)는 러더퍼드가 설명한 원자모형으로는 설명이 불가능한 선 스펙트럼을 설명하기 위해 새로운 원자모형을 제시했다. 양파 껍질처럼 여러 겹으로 된 원자 모형이다. 전자껍질은 K껍질 L껍질 M껍질···으로 이어지는 데 다른 껍질로 전이 될 때 에너지를 내고 이러한 에너지의 차이로 인해 연속스펙트럼이 아닌 선 스펙트럼이 생긴다고 보어는 설명했다. 궤도모형의 정의는, 전자는 원자핵 주위의 특정한 에너지 준위를 가진 궤도상에서 원운동한다-이다. 하지만, 전자가 2개 이상인 다전자 원자의 선 스펙트럼에 대해 설명 불가하다는 한계점이 있었다.
현대의 원자모형[편집]
원자가 존재하는 확률을 나타낸 표현한 오비탈로 나타내어져 있다. 이를 통해 확률을 나타내면 원자의 경계가 뚜렷하지 않고 구름 처럼 보이므로 전자구름 모형이라고 한다. 특정 위치에서 전자가 발견될 확률을 계산하여 확률분포를 표시하면 전자가 원자핵 주위에 구름처럼 퍼져있다. 현재로써는 원자핵이 중심에 있는 원자를 가장 잘 표현한 원자모형이라 할 수 있다.
구조와 모형[편집]
강력[편집]
원자핵에는 양전하를 띠는 양성자와 전하를 띠지 않는 중성자로 구성되어있다. 양성자끼리는 서로 밀어내는 힘이 작용하므로 원자핵이 안정된 상태로 존재하려면 전자기력보다 큰 힘이 핵자들 사이에 작용해야한다. 이 힘은 전자기력보다 강한 힘이라는 의미에서 강한 상호작용이라고 한다.
강한 상호작용은 아주 가까운 거리에서만 작용하므로 갈고리에 비유될 수 있다. 양성자와 중성자가 아주 가까이 있을 때 강한 상호 작용이라는 이름의 갈고리가 서로 떨어지지 않도록 붙잡아 맨다. 둘 사이의 거리가 갈고리보다 멀면 갈고리는 제 역할을 하지 못한다. 원자핵과 같이 좁은 영역에 중성자가 양성자와 함께 들어 있으므로, 핵에서는 강한 상호 작용이 발동하여 양성자들 사이의 척력을 무기력하게 만드는 것이다. 중성자는 전하를 갖고 있지 않으므로 전기력을 발휘할 수 없지만, 강한 상호 작용을 발동하여 원자핵을 전체적으로 붙잡아 묶는 역할을 한다. 물질의 99%가 수소와 헬륨이다. 나머지 원소들은 수소와 헬륨에서 만들어진 것이다.
간단한 핵에서 복잡한 핵을 만들려면 양성자와 중성자를 첨가하면 된다. 이때 방해의 요인인 전기적 척력을 어떻게 적절히 상쇄시킬 수 있느냐가 문제의 핵심이다. 이 문제는 강한 상호 작용으로 해결할 수 있다. 강한 상호 작용의 발동은 핵자들이 매우 가까이 접근해야 가능한데, 극도로 고온인 상황 (별의 중심부)에서는 핵자들의 근거리 접근을 할 수 있다. 온도가 대략 1000만 도 이상의 상황에서는 핵자들의 전기적 척력이 위력을 발휘할 수 없을 정도로 매우 빠르게 충돌한다.
양성자[편집]
중성자와 함께 원자핵을 구성하는 입자이며, 양의 전하를 가지고 있다.
양성자의 전하량은 전자의 전하량과 비교했을 때 그 크기는 같으나 부호는 반대이고, 전자 질량의 약 1836배에 해당하는 질량을 지닌 입자이다.
1803년 영국의 화학자 돌턴이 원자설을 제안한 후, 많은 과학자들이 원자의 구조에 대해 연구를 하였다. 그 과정에서 원자는 더 작은 입자로 구성되어 있다는 것을 알게 된다. 그 입자들이 전자, 양성자, 중성자 등이며, 그 중 양전하를 띠고 있는 입자가 양성자이다. 양성자는 소립자(쿼크)로 구성되어 있다.
중성자[편집]
양성자와 함께 원자의 핵자 중 하나이며, 0의 전하를 가지고 있다.
중성자는 전하를 가지고 있지 않으며, 전하가 없으므로 전기량도 없다. 질량은 1.675×10^⁻²⁷kg으로 양성자보다 약간 무겁다. 이는 전자의 약 1,800배이다. 핵에서 벗어날 경우 불안정하며 반감기는 611.0±1.0 초, 평균 수명은 881.5±1.5 초이다. 세 개의 쿼크로 이루어진 중입자이며, 한 개의 업 쿼크, 두 개의 다운 쿼크로 이루어져 있다.
1932년에 채드윅이 일련의 연구를 통해 이 방사선은 전하량이 없는 입자라는 설을 제안하였고, 이를 중성자라 이름 붙였다.
원자핵의 크기[편집]
핵자들의 모임으로 이루어진 원자핵의 크기는 원자핵에 포함된 핵자들의 수와 관계된다. 원자의 크기는 대략 최외각 전자의 반경으로 정의하며 약 0.05nm(헬륨 원자)에서 0.2nm(세슘 원자) 정도이다. 대부분의 원자의 반지름은 0.1~0.2nm 사이이다.
원자핵의 반지름은 원자의 반지름보다 훨씬 작기 때문에 미터 단위보다는 페르미 단위로 측정한다. 1페르미(fm)는 10⁻¹⁵m에 해당한다(1fm=10⁻¹⁵ m). 따라서 원자의 반지름은 원자핵 반지름의 약 104배 크다. 크기 모델로 비교하면 핵을 완두콩으로 나타내면 원자는 축구장 정도의 크기가 된다. 그리고 양성자의 수는 전자의 수를 나타내는 원자번호(atomic number, Z)와 같다.
원자핵의 질량[편집]
원자의 질량은 전자, 양성자, 중성자의 질량과 관계된다. 양성자의 질량은 전자의 질량보다 1,836배 무겁고, 중성자는 양성자와 대략 비슷하다. 각각의 질량은 다음과 같다.
전 자: me=0.511MeV/c² =9.11×10⁻³¹kg
양성자: mp=938.3MeV/c² =1.673×10⁻²⁷kg
중성자: mn=939.6MeV/c² =1.675×10⁻²⁷kg
원자의 대략의 질량은 양성자 1개와 전자 1개의 질량인 수소의 질량(약 1GeV/c²)을 기준으로 핵자(양성자, 중성자)의 전체 수를 세어 계산한다.
예를 들어, 헬륨 원자는 2개의 양성자와 2개의 중성자를 가지므로 수소원자 질량의 4배이다. mHe =4mH로 표시한다. 이처럼 핵자의 수가 원자의 질량을 대부분 결정하기 때문에 이를 질량수(mass number, A)라고 한다. 질량수가 A인 원자의 질량은 약 AmH이다.
동위원소와 원자핵 반응[편집]
동위원소란 원자핵에 존재하는 양성자의 수가 같아 원자 번호는 같지만 중성자의 수가 달라 서로 다른 질량을 갖는 경우를 말한다. 대부분의 원소들은 여러 가지의 동위원소가 존재한다. 이중 상당수는 자연계에 존재하지만 핵반응을 통해 인공적으로 만들어지는 경우도 있다. 자연적으로 존재하는 대부분의 원자핵은 안정한 상태이지만 그 중 일부는 핵이 붕괴하여 다른 원소들로 쪼개지는 경우도 있다. 예를 들어 탄소의 동위원소 중 ¹²C 와 ¹³C 는 안정하지만 ¹⁴C 는 원자핵이 불안정하여 베타 붕괴가 일어나 ¹⁴N 으로 바뀌면서 그 비율이 서서히 감소하게 된다. 반면 핵융합 반응, 중성자 포획을 통해 좀 더 무거운 원소가 만들어질 수도 있는데 이를 핵합성이라 한다.
원자핵 반응의 종류[편집]
베타 붕괴(beta decay)[편집]
베타 붕괴란 원자핵 내부에 존재하는 중성자 1개가 양성자로 변하면서 전자를 방출하는 방사성 붕괴 현상을 말한다. 중성자는 양성자보다 약간 질량이 크고 따라서 좀 더 높은 에너지 상태를 가지게 되어 자발적으로 베타 붕괴가 일어나면서 에너지를 방출할 수 있다. 베타 붕괴가 일어나면 핵 내부의 양성자가 1개 증가하므로 원자 번호는 1이 커지게 되지만 양성자와 중성자의 전체 갯수에는 변화가 없어 질량수는 변하지 않는다.
알파 붕괴(alpha decay)[편집]
알파 붕괴란 원자핵이 알파 입자(헬륨 원자핵)를 방출하는 방사성 붕괴 현상을 말한다. 알파 입자가 방출되면 양성자가 2개 줄어들게 되므로 원자 번호가 2만큼 감소하고 중성자 2개도 함께 방출되므로 질량수는 4가 감소한다. 상대적으로 무거운 원소들(원자 번호 28번인 니켈보다 무거운)에서만 발생할 수 있다. 니켈보다 가벼운 원소들은 핵합성이 주로 일어난다.
대표적인 알파 붕괴 반응은 우라늄의 핵붕괴를 들 수 있다.
중성자 포획(neutron capture)[편집]
중성자 포획은 원자핵이 외부에서 중성자 1개를 받아들이는 반응을 말한다. 대표적인 중성자 포획 반응은 우라늄 원자핵을 들 수 있다.
중성자 포획 반응이 일어나면 원자 번호에는 변화가 없고 질량수만 1 증가하게 된다. 중성자가 포획되어 중성자가 필요 이상으로 많아지게 되면 핵이 불안정해지고 핵분열 반응을 일으키거나 베타 붕괴가 일어나면서 원자 번호가 1 증가하기도 한다.
핵분열 반응(nuclear fission)[편집]
우라늄은 ²³⁵U 와 ²³⁸U 모두 중성자 포획 반응이 일어나지만 ²³⁵U만 연쇄 반응(chain reaction)이 일어날 수 있어 원자폭탄의 원료로 사용될 수 있다. 그 이유는 ²³⁵U가 ²³⁶U로 변하는데 중성자 1개가 필요하지만 만들어진 ²³⁶U는 ⁸⁹Kr과 ¹⁴⁴Ba 으로 쪼개지는 핵분열(nuclear fission) 반응이 일어나면서 3개의 중성자가 다시 발생하게 되는데, 이들이 다시 ²³⁵U와 반응하여 ²³⁶U이 만들어지는 반응이 연쇄적으로 일어날 수 있기 때문이다. ²³⁵U 의 양이 충분하다면 반응 속도가 기하급수적으로 증가하게 된다.
²³⁸U의 중성자 포획에 의해 만들어진 ²³⁹U는 핵분열 반응을 하지 않고 두 번의 베타 붕괴가 일어나 ²³⁹Pu이 되는데 ²³⁹Pu은 핵분열 반응이 일어나는 핵종이다.
임계 질량 이상 이하에서의 핵분열 반응은 만들어진 중성자의 상당수가 다음 연쇄 반응에 참여하지 못하고 주변으로 방출되기 때문에 반응 속도가 적절히 조절되면서 에너지를 서서히 방출하게 할 수도 있다(일반적인 원자력 발전소의 상태, 원전에서는 방출되는 중성자의 속도를 늦추거나 흡수하기 위해 물을 사용한다). 임계 질량 이상이 되면 만들어진 대부분의 중성자가 연쇄 반응에 참여할 수 있게 되어 반응 속도가 기하급수적으로 빨라지게 된다. 핵분열 반응이 일어나는 물질을 단순히 임계 질량 이상으로 뭉치기만 하면 순식간에 엄청난 에너지를 방출하면서 폭발하게 되는데 이를 원자 폭탄이라 한다.
핵융합 반응(nuclear fusion)[편집]
핵융합 반응은 두 개 이상의 원자핵이 만나 더 무거운 핵종으로 바뀌는 반응이다. 핵융합 반응이 일어나기 위해서는 매우 높은 온도와 압력이 필요하므로 태양과 같은 항성 내부에서만 이와 같은 반응이 일어난다. 핵융합 반응을 통해 좀 더 안정한 핵종으로 변해야만 에너지를 방출하면서 반응이 진행될 수 있는데, 이 때문에 핵의 내부 결합 에너지가 가장 높은 ⁵⁶Fe 혹은 ⁶²Ni 보다 가벼운 원소들만 핵융합 반응이 가능하다. 따라서 항성 내부에서 형성될 수 있는 원소는 철과 니켈이 한계이며 그보다 무거운 원소들은 초신성 폭발과 같은 상황에서만 만들어질 수 있다. 태양과 유사하거나 작은 항성에서는 수소의 핵융합 반응을 통해 헬륨이 만들어지는 반응이 주로 일어나고, 태양보다 더 무거운 항성 내부에서는 그 이상의 핵융합 반응을 통해 질소, 산소와 같은 더 무거운 원소들이 만들어질 수 있다.
참고자료[편집]
같이 보기[편집]
| ||||||||||||||||||||||

 위키원
위키원