킬레이트
킬레이트(chelate)는 한 개의 리간드가 금속이온과 두 자리 이상에서 배위결합을 하여 생긴 착이온이다. 해당 리간드는 킬레이트제(chelator, chelating agent, chelant)라고 한다. 주로 예를 들어 구리가 포함된 용액에 에틸렌다이아민의 수용액을 가할 때 구리는 에틸렌다이아민의 두개의 아민기의 질소 원자와 결합하여 고리모양의 착이온을 만드는데, 이렇게 해서 생성된 화합물을 킬레이트라 한다.
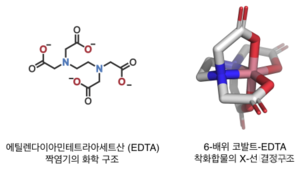
킬레이트를 형성하는 대표적인 리간드로는 에틸렌다이아민, EDTA(ethylenediaminetetraacetic acid)가 있다.
대부분의 킬레이트제는 유기물이지만 피로인산염처럼 무기물도 있다.
목차
정의와 유래[편집]
전이 금속 원자나 이온은 대부분 하나 이상의 리간드와 결합한다. 만일 리간드 한 분자 안에 여러 개의 주개 원자가 있으면, 중심 금속을 감싸는 모양의 배위 결합을 동시에 만들 수 있다. 이런 여러자리(multidentate 혹은 polydentate) 리간드의 금속 착화합물을 킬레이트(chelate)라고 부른다.
그리스어에서 게의 집게발을 뜻하는 'χηλή'가 라틴어 'chela'가 되고, 여기에서 킬레이트라는 용어가 유래했다. 킬레이트제(chelating agent)는 킬레이트화(chelation) 반응을 통해 킬레이트를 만든다.
킬레이트 자릿수[편집]
리간드에서 금속에 배위하는 주개 원자의 개수를 자릿수(denticity)라고 부르며, 이는 '이(tooth)'를 뜻하는 라틴어 'dentis'에서 유래한 용어이다. 한자리(monodentate) 리간드에서 출발해서 주개 원자 개수가 하나씩 증가할 때마다 두자리(bidentate), 세자리(tridentate), 네자리(tetradentate), 다섯자리(pentadentate), 여섯자리(hexadentate) 리간드라고 부른다. 보통 여섯자리까지가 흔하지만, 그보다 큰 자릿수를 갖는 리간드도 있다. 숫자를 명시하지 않고, 일반화시켜 '여러자리 리간드'라고 묶어서 부를 때도 있다.
킬레이트 리간드의 자릿수를 표시할 때는 그리스 문자 κ를 쓴다. 예를 들어, 여섯자리 리간드인 EDTA(위 그림 참조)가 주개 원자를 모두 사용해서 6-배위 착화합물을 만들 때는 κ⁶-EDTA라고 쓴다. 주개 원자가 리간드 골격을 따라 서로 인접해 있지 않을 때 κ 기호를 쓴다는 점을 기억하자.
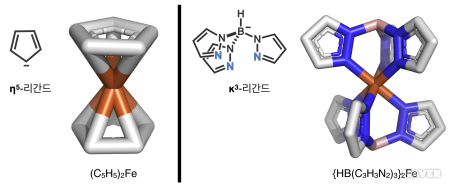
만일 금속 중심에 동시에 배위하는 다수의 주개 원자가 서로 인접해 있다면 그리스 문자 η 기호를 써서 숫자를 표시한다. η 기호는 합토수(hapticity)라고 부르며, 자릿수를 나타내는 κ 와는 구별해야 한다. 예를 들어, 샌드위치 화합물인 페로센(ferrocene, (C₅H₅)₂Fe) 분자의 시클로펜타디에닐(cyclopentadienyl) 리간드에서는 오각 고리를 이루는 탄소 원자 다섯 개 모두가 금속에 동시에 배위되어 있기 때문에 η⁵-C₅H₅ 혹은 줄여서 η⁵-Cp라고 쓴다 (아래 그림 참조). 전자 개수로 따져보자면 Cp- 음이온 리간드는 여섯 개의 전자를 시그마-결합을 통해 금속에 제공하기 때문에, 전자쌍 하나가 자릿수 하나에 해당한다고 보면 세자리 리간드의 역할을 한다. 이 경우, 연달아 배열된 주개 원자의 개수(= 합토수)가 리간드 자릿수와 일치하지는 않는다. 알릴 음이온(allyl anion, [C₃H₅]⁻) 리간드가 금속에 η³-형태로 배위될 때는 두자리 리간드의 역할을 하며, 이 경우에도 역시 합토수와 자릿수가 다르다. 넓은 의미에서는 여러 개의 주개 원자가 합토 결합을 하는 탄소 기반 리간드의 금속 착화합물도 킬레이트라고 생각할 수 있겠지만, 보다 일반적으로는 루이스 염기성 헤테로 원자를 주개로 갖는 여러자리 리간드가 베르너-형태(Werner-type)의 고전적인 착화합물을 만들 때 킬레이트라고 부른다.
킬레이트 고리[편집]
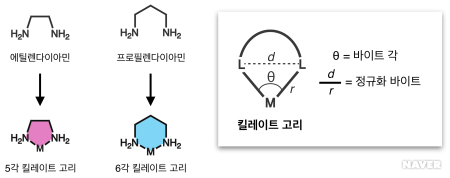
아주 간단한 모양의 두자리 리간드인 에틸렌다이아민(ethylenediamine, H₂NCH₂CH₂NH₂)과 프로필렌다이아민(propylenediamine, H₂NCH₂CH₂CH₂NH₂)을 살펴보면, 금속에 배위하는 두 개의 아민기가 두 개 혹은 세 개의 탄소 원자로 이루어진 사슬로 묶여있다 (아래 그림 참조). 이런 두자리 리간드가 이빨 두 개처럼 금속을 물고 있는 모양을 바이트(bite)라고 부르며, 금속을 중심으로 꺾이는 ∠N_M_N각도를 바이트 각(bite angle, θ)이라고 부른다. 각도를 재는 대신에 두 거리의 비 d/r로 정의되는 정규화 바이트(normalized bite) 값을 쓰기도 한다. 두자리 리간드가 금속에 배위해서 생기는 킬레이트 고리(chelate ring)는 유기 분자인 사이클로펜테인(cyclopentane)이나 사이클로헥세인(cyclohexane)처럼 5각 혹은 6각일 때 고리의 뒤틀림과 입체 장애가 적기 때문에 구조적으로 안정하다. 에틸렌다이아민으로 만들어지는 킬레이트 고리는 5각, 프로필렌다이아민으로 만들어지는 킬레이트 고리는 6각이다.
킬레이트 리간드[편집]
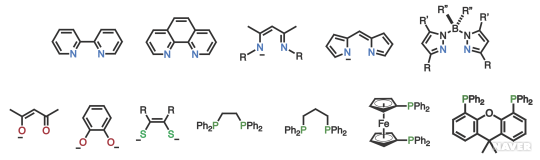
킬레이트 리간드는 주개 원자의 종류, 개수, 그리고 분자의 모양(선형, 가지형, 거대 고리형 등)에 따라서 아래 그림과 같이 다양한 형태를 보인다. 여러자리 리간드로 분자의 크기가 커지고 구조가 복잡해지더라도 인접한 주개 원자와 금속 중심이 만드는 킬레이트 고리는 구조적으로 안정한 5각 아니면 6각으로 유지되는 것이 좋다.
킬레이트 효과[편집]
킬레이트 착화합물은 비슷한 구조의 한자리 리간드 여러 개로 이루어진 착화합물보다 열역학적으로 안정하다. 이 성질을 킬레이트 효과(chelate effect)라고 부르는데, 반응 엔트로피, 반응 속도론, 반응 엔탈피, 용매와 상호작용 등으로 설명할 수 있다.
반응 엔트로피 효과[편집]
반응 엔트로피가 킬레이트 효과에 기여하는 이유는 단순한 모델 시스템을 통해 이해할 수 있다. 동일한 주개 원자를 가진 유사한 전자 환경에서, 한자리 리간드 𝐿 과 여섯자리 리간드 𝐿′이 수화된 [𝑀(H₂O)₆]ⁿ⁺ 금속이온과 각각 반응하여 [𝑀𝐿₆]ⁿ⁺와 [𝑀𝐿′]ⁿ⁺착화합물을 형성하는 화학 반응식과 반응 엔탈피, 엔트로피, 자유 에너지를 각각 다음과 같이 쓸 수 있다.
[𝑀(H₂O)₆]ⁿ⁺ + 6𝐿 ⇄ [𝑀𝐿₆]ⁿ⁺ + 6H₂O (1)
(∆H₁; ∆S₁; ∆G₁)
[𝑀(H₂O)₆]ⁿ⁺ + 𝐿′⇄ [𝑀𝐿′]ⁿ⁺ + 6H₂O (2)
(∆H₂; ∆S₂; ∆G₂)
이 반응 모델에서 리간드 𝐿과 𝐿′은 주개 원자가 같고 금속과 결합 세기 역시 비슷하기 때문에 반응 엔탈피는 큰 차이가 없다 (∆H₁≈ ∆H₂). 하지만, 한자리 리간드의 착화합물인 [𝑀𝐿₆]ⁿ⁺이 만들어지는 식 (1)에서는 반응 전후에 전체 이온/분자의 개수 변화가 없는 반면, 여섯자리 리간드의 착화합물인 [𝑀𝐿′]ⁿ⁺이 만들어지는 식 (2)에서는 생성물 쪽의 이온/분자 개수가 더 많다. 입자의 개수가 많아져서 자유도가 더 증가하기 때문에 ( ∆S₁< ∆S₂), 자유 에너지 면에서 ∆G₁> ∆G₂의 관계가 성립한다. 따라서, 여섯자리 리간드로 이루어진 킬레이트 착화합물의 생성이 더 자발적이며, 그 결과 열역학적으로도 더 안정하게 된다. 자릿수가 다른 킬레이트 리간드에 대해서도 비슷한 방식으로 열역학적 선호도를 설명할 수 있다.
반응 속도론적 효과[편집]
한자리 리간드 여러 개가 금속 중심에 결합해서 𝑀𝐿ₙ 착화합물이 만들어지기 위해서는 모두 n+1 개의 이온/분자가 충돌해야 한다. 반면, 킬레이트 착화합물 𝑀𝐿′이 만들어질 때는 금속이온과 여섯자리 리간드 𝐿′, 이렇게 단 두 개의 이온/분자가 충돌해서 𝐿′의 결합 자리 하나와 금속 사이의 결합이 먼저 생긴다. 금속이 리간드의 한 부분에 먼저 자리 잡으면, 남아있는 결합 자리는 용액 상에서 자유롭게 확산 운동을 할 때보다 훨씬 작은 부피 범위 안에서 움직일 수밖에 없고, 그 결과 금속 중심이 느끼는 개별 주개 원자의 유효 농도(effective concentration)가 현격히 증가해서 빠른 속도로 킬레이트 착화합물이 만들어진다. 금속 중심에서 킬레이트가 떨어져 나가는 역반응이 어려운 이유도 여기에 있다.
반응 엔탈피 효과[편집]
반응 엔탈피가 킬레이트 효과에 미치는 영향은 다소 복잡하다. 다수의 한자리 리간드를 사슬로 연결해서 여러자리 리간드로 만들다 보면 전자 주개 성질이 변해서 금속 리간드 결합 세기도 달라진다. 예를 들어, 암민(NH3) 리간드를 알킬 사슬로 묶는 과정에서 일차 아민(RNH₂), 이차 아민(RR'NH), 혹은 삼차 아민(RR'R'N)의 형태로 질소-주개 원자의 치환 정도가 변하고, 루이스 염기성도 점점 커진다. 또한, 주개 원자들이 근접 거리에 올 때 생기는 정전기적 반발, 여러자리 리간드가 킬레이트 고리의 일부가 되는 과정에서 생기는 탄소–탄소 골격의 뒤틀림과 입체 장애, 그리고 오비탈 겹침과 리간드장의 변화 등이 금속–리간드 결합 세기에 영향을 미친다. 위에서 반응 엔트로피의 영향을 설명 할 때, ∆H₁≈ ∆H₂라는 가정을 했었지만, 실제로 반응 엔탈피의 차이를 완전히 무시할 수는 없다.
용매 효과[편집]
용액 상에서 금속이온과 리간드 분자는 용매와 상호작용을 한다. 금속–리간드 결합이 만들어지는 과정에서는 이온/분자를 둘러싸고 있던 용매화 껍질(solvation shell)의 구조 변화가 반드시 일어난다. 용매화 껍질 안에서 어느 정도 규칙적인 배열을 하고 있던 용매 분자가 자유 용매 분자가 되는 과정이 전체 반응의 엔탈피와 엔트로피 변화에 기여한다. 하지만, 용매화 껍질에서 자유 용매 분자로 풀려나는 분자가 더 많아질수록 (= 큰 엔트로피) 용매화 껍질의 구조를 바꾸는데 많은 에너지가 필요하기 때문에 (= 큰 엔탈피) 두 효과는 서로 상쇄된다. 따라서, 용매 효과는 킬레이트 효과에 그리 크게 기여하지는 않는다.
특별히 킬레이트 리간드가 고리 모양을 하고 있을 경우에는 제한된 개수의 용매 분자가 불안정한 상태로 고리 안쪽을 점유하고 있다가 금속이 배위하는 과정에서 밖으로 자유롭게 풀려날 수 있기 때문에, 비교적 큰 용매 효과를 관찰할 수 있다. 넓은 의미에서는 킬레이트 효과이지만 거대고리 효과(marocyclic effect)라고 따로 부르기도 한다.
이용[편집]
참고자료[편집]
같이 보기[편집]

 위키원
위키원