결합에너지
결합에너지(Bond energy, Binding energy, BE)는 여러 개의 구성입자가 결합하여 만들어진 분자의 결합을 끊어 구성입자로 분리하는 데 필요한 에너지이다. 분자 내 원자 사이의 결합에너지, 원자핵 속에서 핵자 사이의 결합에너지가 있다. 값이 클수록 결합한 정도가 강하다고 볼 수 있다. 결합에너지는 크게 여러 원자가 결합하여 분자를 만들었을 때와, 여러 핵자가 결합하여 원자핵을 만들었을 때로 나눌 수 있다.
① 분자 내 원자 사이의 결합에너지: 물질의 분자 또는 결정이 여러 원자의 화학결합으로 이루어졌을 때, 이들 원자 사이의 화학결합에 소요된 에너지를 말하며, 화학결합에너지라고도 한다. 예를 들면, 메테인 CH₄은 4개의 탄소 C-수소 H 결합을 가지고 있는 화합물인데, 이것을 완전히 탄소원자와 수소원자로 분리시키는 데 필요한 에너지는 1몰당 395㎉이다. 따라서 1개의 C-H결합의 결합에너지는 1몰당 98.75㎉가 된다.
여러 화학결합에 대한 결합에너지를 알고 있으면, 이것을 이용하여 여러 화합물의 해리에너지 또는 생성에너지를 쉽게 구할 수 있다. 다만, 공명구조를 가진 화합물이나 이성질체인 것은 보다 복잡한 이론을 고려하여야 한다. 한편, 결정의 결합에너지는 승화열을 이용하여 실험적으로 측정할 수 있다.
② 원자핵 속에서 핵자 사이의 결합에너지: 이때 결합에너지는 여러 핵자가 서로 결합하여 원자핵이라는 단단한 결합체를 만들 때 밖으로 방출된 에너지를 말한다. 반대로 말하면, 원자핵을 그 구성단위인 핵자로 분리시키려고 할 때 외부로부터 가해야 할 에너지에 해당한다. 이 값은 그것을 구성하고 있는 핵자의 수(질량수라고 한다)가 큰 원자핵일수록 크지만, 핵자 1개에 대한 평균 결합에너지를 살펴보면 질량수가 큰 원자핵이 반드시 큰 것은 아니다. 질량수가 중간 정도인 철의 원자핵(질량수 56)이 가장 크고, 철보다 무거운(질량수가 큰) 원자핵은 무거워질수록 평균 결합에너지가 차차 작아지며, 또 철보다 가벼운 원자핵은 가벼워질수록 비교적 급격히 작아지게 된다.
다시 말하면, 개개의 핵자 사이의 결합은 철의 원자핵이 가장 강하고, 그보다 무겁거나 가벼운 원자핵은 비교적 약하다. 이 때문에 무거운 원자핵(예를 들면, 우라늄핵)이 파괴되어 중간 정도의 질량수를 갖는 원자핵으로 변환하거나, 가벼운 원자핵(예를 들면, 수소핵·중수소핵)이 서로 융합하여 무거운 원자핵이 될 때는 이에 따라 막대한 양의 에너지를 밖으로 방출한다. 이것이 곧 원자핵분열 또는 원자핵융합에 의한 원자에너지(원자력)의 발생 원리이다.
목차
개요
결합에너지는 결합엔탈피(bond enthalpy)라고도 하는데 화학 결합의 세기를 측정하는 방식이다. IUPAC에 따르면 결합 에너지는 기체상태의 해리 에너지, 즉 기체 상태의 원자 1몰의 공유 결합을 끊어서 구성입자(원자 또는 이온)로 만드는 데 필요한 에너지로 정의된다. 같은 종류의 분자에서 같은 종류의 결합을 끊는데 필요한 에너지는 항상 동일하다. 결합 에너지가 클 수록 분자의 에너지준위가 더 낮아지고, 따라서 더 안정하다.
해리 에너지(bond dissociation energy, BDE)는 RX → R + X 과정에서 발생하는 표준 엔탈피로 정의된다. R과 X 사이의 결합을 끊는데 필요한 에너지라는 의미로 Dº(R−X)라 적으며, 다음과 같이 계산한다.
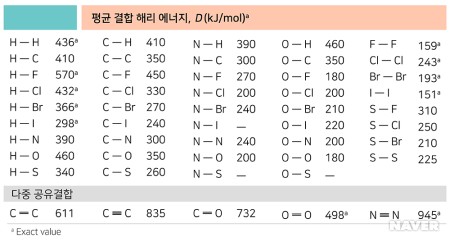
메탄의 경우를 살펴보자. 메탄에 있는 C-H결합 에너지 BE(C–H)는 438 kJ/mol이다. 메탄이 결합 에너지를 흡수 하고 CH3(g)와 H(g)로 분리가 되는 것이다.
- CH4(g)+438kJ→CH3(g)+H(g)
결합에너지는 결합의 세기를 나타내는 척도라고도 볼 수 있다. 결합이 강할수록 결합을 끊는데의 에너지가 많이 들기 때문이다. 결합에너지는 결합이 강할수록, 극성이 클수록, 단일결합 보다는 다중 결합일수록 증가한다.
예를 들면 HF, HCl, HBr, HI가 있을 때 결합의 극성은 HF > HCl> HBr> HI이다. 극성이 클수록 결합에너지가 크 므로 결합에너지도 HF > HCl> HBr> HI이다.
예를 들면 C2의 단일 결합보다는 이중 결합이 이중결합보다는 삼중 결합이 결합에너지가 큰것이다.
화학반응은 원자의 재배열이라 볼 수 있는데 화학반응이 있기 위해서는 분자의 결합이 끊어 져야 한다. 화학결합을 끊으려면 입자들 사이의 인력을 끊을 수 있는 만큼의 에너지가 필요하다.
결합에너지의 계산
화학결합에서의 결합 척도라고 할 수 있는 결합에너지는 오른쪽 그림을 통해 계산할 수 있으며, 반응물과 생성물의 결합 에너지의 차이는 열 발생량 혹은 소모량이 된다. 보통 298K의 온도에서의 에너지 평균값을 나타낸 것이다.
예를 들어, CH₄(g) + 2Cl₂(g) → CH₂Cl₂(g) + 2HCl(g)일 때, 반응물의 총 결합에너지는 4개의 C-H와 2개의 Cl-Cl와의 결합에너지이므로 415 × 4 + 243 × 2 = 1660 + 486 = 2146(kJ/mol)이다. 생성물의 총 결합에너지는 2개의 C-H, 2개의 C-Cl와 2개의 H-Cl와의 결합에너지이므로 415 × 2 + 330 × 2 + 432 × 2 = 830 + 660 + 864 = 2354(kJ/mol)이다. 위의 계산에 따르면 생성물의 결합에너지가 반응물의 결합에너지보다 208kJ/mol만큼 크다는 것을 알 수 있다. 이는 생성물의 결합을 형성하면서 방출한 열이 반응물의 결합을 끊는데 사용한 열보다 더 작으며, 208 kJ/mol이 발열반응에 사용된 에너지임을 알 수 있다.
결합에너지 - 거리 상관 관계
결합에너지는 결합 거리 및 결합 방식과 직접적인 관련성을 가지고 있으므로 분자를 이루는 각각의 원자들의 다양한 결합 방식에 따라 결합 강도는 다르다. 결합 강도는 분자를 이루는 원자들의 공유 원자 반경, 이온 반경 그리고 금속 반경을 이용하여 결정할 수 있다. 결합에너지의 세기는 델타(δ) 결합보다 파이(π) 결합이 더 강하고 파이(π) 결합보다 시그마(σ) 결합이 강하며, 삼중결합이 이중결합보다 이중결합이 단일결합보다 강하다. 결합에너지가 클수록 또한 결합 길이가 짧을수록 결합은 안정하다.
결합에너지와 화학 반응
결합에너지는 화학 반응의 예측과 반응 메커니즘 이해에 중요한 역할을 한다. 화학 반응에서, 반응물의 결합을 끊고 생성물의 결합을 형성하는 데 필요한 에너지를 통해 반응이 발열 반응인지 흡열 반응인지를 판단할 수 있다.
- 발열 반응 (Exothermic Reaction): 생성물의 결합 형성에 의해 방출되는 에너지가 반응물의 결합을 끊는 데 필요한 에너지보다 클 경우 발열 반응이 일어난다.
- 흡열 반응 (Endothermic Reaction): 반응물의 결합을 끊는 데 필요한 에너지가 생성물의 결합 형성 에너지보다 클 경우 흡열 반응이 발생한다.
결합에너지와 결합의 강도
결합에너지는 결합 강도와 직접적인 상관관계가 있다. 일반적으로 결합 에너지가 높을수록 결합이 강하고 안정하다.
단일 결합은 다중 결합에 비해 결합 에너지가 낮아 상대적으로 약한 결합으로 간주된다. 다중 결합 (이중 결합, 삼중 결합): 다중 결합은 더 많은 전자쌍을 공유하여 단일 결합보다 결합 에너지가 크다. 예를 들어, 탄소(C) 간의 단일 결합보다 이중 결합의 결합 에너지가 높고, 삼중 결합이 가장 높다.
결합에너지에 영향을 미치는 요소
- 원자 크기: 결합하는 원자의 크기가 작을수록 핵과 전자 간의 인력이 커져 결합 에너지가 증가한다.
- 전자 친화도와 전기음성도: 결합하는 원자의 전기음성도 차이가 클수록 이온 결합의 결합 에너지가 높아진다.
- 분자 구조: 결합이 형성된 구조에 따라 결합에너지가 달라지며, 공명 구조(resonance structure)는 결합을 더욱 안정하게 만들어 결합 에너지가 증가할 수 있다.
실제 결합에너지 예시
- 수소 분자 (H₂): 수소 분자(H₂)의 H–H 결합 에너지는 약 436 kJ/mol로, 이는 두 수소 원자를 기체 상태로 분리하는 데 필요한 에너지이다.
- 산소 분자 (O₂): 산소 분자(O₂)는 O=O 이중 결합을 가지며, 결합 에너지는 약 498 kJ/mol로 H₂보다 높다.
- 탄소 이중 결합 (C=C): 탄소 원자 사이의 이중 결합(C=C)의 결합 에너지는 약 614 kJ/mol이다.
- 탄소 삼중 결합 (C≡C): 탄소 원자 사이의 삼중 결합(C≡C)의 결합 에너지는 약 835 kJ/mol로, 가장 강력한 결합 중 하나이다.
결합에너지와 에너지 저장 및 변환
결합에너지는 에너지 저장 및 변환 과정에서도 중요한 역할을 한다. 예를 들어, 탄화수소 화합물의 결합 에너지를 통해 연료의 연소 과정에서 방출되는 에너지를 예측할 수 있다. 이러한 결합 에너지의 특성은 태양열 전지, 배터리, 바이오 연료와 같은 에너지 저장 및 변환 기술 개발에 기여하고 있다.
결합에너지와 생명 현상
생물체에서 발생하는 다양한 화학 반응에도 결합 에너지가 필수적이다. 예를 들어, ATP(아데노신 삼인산) 분자의 인산 결합은 높은 결합 에너지를 가지고 있으며, 이를 통해 세포가 필요한 에너지를 얻는다.
참고자료
같이 보기

 위키원
위키원