유기금속화학
유기금속화학(有機金屬化學, organo-metallic chemistry)이란 유기금속 화합물(organo-metallic compounds)을 연구하는 학문이다. 여기서 유기금속 화합물은 최소한 한 개 이상의 금속(알칼리 금속(alkali metal), 알칼리 토금속(alkaline earth metal), 전이 금속(transition metal), 준금속(metalloid) 등)과 유기 화합물 내 탄소의 결합을 포함하고 있는 물질을 말한다. 금속 카보닐(carbonyl), 금속 사이안화물 및 금속 카바이드 등도 유기금속 화합물에 속하다. 엄밀히 말하면, 유기금속 화합물은 아니지만, 그 범주를 좀 더 확장하여 금속 수소화물(hydride)이나 금속 포스핀(phosphine) 화합물도 유기금속 화합물로 취급하기도 한다.
한편, 유기금속 화합물과 관련성이 있지만 다른 용어로 불리는 "금속 유기 화합물(metal-organic compound)"은 직접적인 금속-탄소 결합은 없지만, 화합물 내에 유기 리간드를 포함하고 있는 물질을 말한다. 금속 β-다이케토네이트(β-diketonate), 금속 알콕사이드(alkoxide), 금속 다이알킬아마이드(diakylamide), 금속 포스핀 착물 등이 이 부류에 속한다. 유기금속 화학 분야는 전통적인 무기 화학(inorganic chemistry)과 유기 화학(organic chemistry)의 특성을 결합한 분야라고 할 수 있다.
유기금속 화합물은 촉매, 신소재, 고분자, 태양 전지 및 발광 다이오드 등의 다양한 산업적 응용 분야에 광범위하게 사용되고 있다.
목차
개요
유기금속화학은 금속과 탄소의 화학 결합을 포함하는 화합물인 유기금속화합물을 연구하는 학문이다. 유기 금속화합물의 정의는 무기화학과 유기화학이 융합된 영역이다. 또한 비슷한 말인 합성유기금속(Organic metal)은 폴리아세틸렌 등 금속을 포함하지 않으나 전기전도성을 보이는 순수한 유기화합물을 표현하는 말로 유기금속화학의 범주 밖이다.
유기금속화합물은 '유기팔라듐화합물'처럼 앞에 '유기-'를 붙이는 식으로 불린다. 전형적인 유기금속화합물은 클로로(에톡시카보닐메틸)아연 (ClZnCH₂C(=O)OEt) 같은 유기아연화합물, 디메틸구리리튬 (Li[CuMe₂]) 과 같은 유기구리화합물, 그리냐드 시약, 아이오딘화메틸마그네슘 (MeMgI) 이나 디메틸마그네슘(Et₂Mg) 과 같은 유기 마그네슘 화합물, n-뷰틸리튬과 같은 유기리튬 화합물 등이 있다.
중요한 유기금속화합물로서 금속카보닐, 페로센 등의 메탈로센을 꼽을 수 있다. 유기금속화학에는 규산, 비산, 붕산 등의 반금속의 화합물도 포함된다. 예를 들면 유기붕소화합물인 트라이에틸보레인 (Et₃B) 등이 여기에 속한다. 또한 지글러-나타 촉매로 사용되는 알루미늄과 같은 비금속도 포함된다.
유기금속화합물은 석유화학 제품의 제조나 유기중합체의 제조 등에 촉매로서 종종 쓰인다.
18 전자 규칙과 이소로벌 법칙은 유기금속화합물의 결합과 반응성을 이해하기 위해 중요한 이론이다.
전형원소(Li,Mg,Al,Zn)의 유기금속화합물은 일반적으로 전기음성도가 낮은 금속과 상대적으로 전기음성도가 높은 탄소의 결합이 이온결합적인 성질을 띄기 때문에, 극성반응에 있어서 높은 반응성을 보인다.
유기금속 화합물
유기금속 화합물과 고전적인 배위 화합물(coordination compound)과의 차이점은 다음과 같다.
유기금속 화합물에 있는 중심 금속이 더 높은 전자 밀도를 가지고 있다. 금속-리간드의 결합이 더 큰 공유 결합성을 가지며, π-결합 특성을 보이는 경우가 많다. 따라서 유기금속 화합물에서 금속-리간드 결합이 다중 결합을 형성하는 경우가 많다. 유기금속 리간드는 쉽게 편극화되어 활성화된다. 즉, 리간드의 σ-와 π-결합이 약하거나 잘 끊어지기 때문에 한 리간드 내 또는 다른 리간드들 사이에 화학 결합이 형성되거나 끊어질 수 있다.
종류
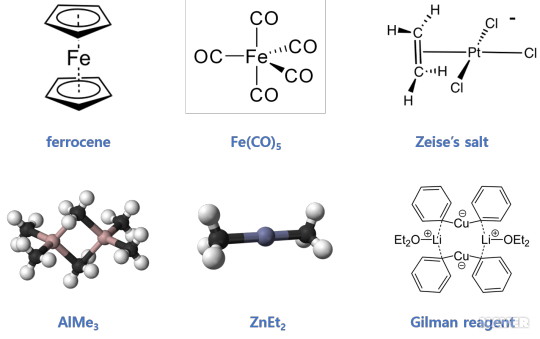
유기금속 화합물은 "유기(organo)-" 접두사를 붙여 구분(예: 유기 팔라듐 화합물, organopalladium compound)하는데, 대표적인 예로 리튬과 구리를 포함하는 길만 시약(Gilman reagent)이 있다. 테트라카보닐 니켈(Ni(CO)4)과 페로센(ferrocene, Fe(C5H5)2)은 전이 금속을 포함하고 있는 유기금속 화합물의 예이다. 유기 마그네슘 화합물인 그리냐르 시약(Grignard reagent), n-뷰틸 리튬(n-butylithium, n-BuLi)과 같은 유기 리튬 화합물, 다이에틸 아연(diethyzinc, ZnEt2), 트라이메틸 알루미늄(trimethylaluminum, AlMe3), 트라이에틸 붕소(triethylborane, BEt3)등의 화합물도 유기금속 화합물이다.
아래의 그림에 몇 가지 유기금속 화합물의 구조를 나타내었다.
구조와 특성
유기금속 화합물에서 금속과 탄소 사이의 결합은 높은 공유 결합성을 가진다. 리튬이나 소듐처럼 전기음성도(electronegativity)가 작은 원소에 결합한 탄소 리간드는 탄소 음이온을 형성하는데, 자유 탄소 음이온의 예는 극히 드물다.
열여덟 전자 규칙(18-electron rule)이 금속 카보닐 화합물 및 이와 관련 있는 일부 유기금속 화합물의 안정성을 예측하는 데 도움을 주긴 하지만, 대부분의 유기금속 화합물은 열여덟 전자 규칙을 따르지 않는다. X-선 회절법(X-ray diffraction), 핵자기 공명 분광법(nuclear magnetic resonance spectroscopy, NMR spectroscopy) 및 적외선 분광법(infrared spectroscopy) 등은 유기금속 화합물의 분자 구조를 결정하는 데 사용한다. 유기금속 화합물의 동적인 특성은 보통 가변 온도(variable-temperature) NMR 분광법 및 반응 속도론(chemical kinetics)을 이용하여 설명할 수 있다.
유기금속 화합물은 아래와 같은 중요한 반응의 촉매로 이용되고 있다.
- 산화성 첨가(oxidative addition) 및 환원성 제거(reductive elimination)
- 금속 교환(transmetalation)
- 수소 금속화(hydrometalation)
- 탄소 금속화(carbometalation)
- 전자 이동(electron transfer)
- 베타-수소 제거(β-hydride elimination)
- 유기금속 치환 반응(organometallic substitution reaction)
- 탄소-수소 결합 활성(C-H bond activation)
- 고리 금속화(cyclo-metalation)
- 이동 삽입(migratory insertion)
- 친핵성 떼어내기(nucleophilic abstraction)
유기금속화학의 역사
- 1760년 : 카데(Louis Claude Cadet de Gassicourt)의 코발트 염 기반의 잉크에 대한 연구 및 비소 함유 코발트 광물로부터 유기비소 화합물 카코딜(cacodyl)의 분리
- 1827년 : 자이스(William Christopher Zeise)가 최초의 백금-올레핀 착물인 자이스 염(Zeise's salt) 합성
- 1848년 : 프랭크랜드(Edward Frankland)의 다이에틸 아연 합성
- 1863년 : 프리델(Charles Friedel)과 크래프트(James Crafts)의 유기염화 실레인 제조
- 1890년 : 몬드(Ludwig Mond)의 테트라카보닐 니켈의 합성
- 1899년 : 그리냐르 반응 소개
- 1899년 : 네프(John Ulric Nef)의 소듐 아세틸라이드를 이용한 알카이닐화(alkynylation) 반응 개발
- 1900년 : 사바티에(Paul Sabatier)의 금속 촉매를 이용한 유기 화합물의 수소화 반응 연구
- 1909년 : 에를리히(Paul Ehrlich)가 매독의 치료제로 효능이 있는 유기 비소 화합물 살바르산(Salvarsan)을 소개
- 1912년 : 그리냐르(Victor Grignard)와 사바티에의 노벨상을 받음
- 1930년 : 길만(Henry Gilman)의 길만 시약 개발
- 1951년 : 히버(Walter Hieber)가 금속 카보닐 화합물 연구로 Alfred Stock memorial prize 수상
- 1951년 : 패로센 합성
- 1956년 : 호지킨(Dorothy Crawfoot Hodgkin)이 금속-탄소 결합을 가진 최초의 생물학 분자인 비타민 B12의 분자 구조 확인
- 1963년 : 지글러-나타 촉매(Ziegler–Natta catalyst) 개발로 노벨상을 받음
- 1965년 : 사이클로뷰타다이엔트라이카보닐 철(Fe(C4H4)(CO)3) 착화합물 개발
- 1968년 : 헤크 반응 개발
- 1973년 : 윌킨슨(Geoffrey Wilkinson)과 피셔(Ernst Otto Fischer)가 샌드위치 화합물(sandwich compound)에 대한 연구로 노벨상을 받음
- 1981년 : 호프만(Roald Hoffmann)과 후쿠이(Kenichi Fukui)가 우드워드-호프만 규칙Woodward-Hoffmann rule)의 정립으로 노벨상을 받음
- 2001년 : 놀스(W. S. Knowles), 노요리(R. Noyori)와 샤프리스(Karl Barry Sharpless)가 비대칭 수소화 반응 연구로 노벨상을 받음
- 2005년 : 쇼뱅(Yves Chauvin), 그럽스(Robert Grubbs)와 슈락(Richard Schrock)이 금속 촉매를 이용한 다양한 복분해 연구로 노벨상을 받음
- 2010년 : 헤크(Richard F. Heck), 네기시(Ei-ichi Negishi)와 스즈키(Akira Suzuki)가 팔라듐 촉매를 사용한 교차 짝지음(cross-coupling) 반응 연구로 노벨상을 받음
결합
금속 [양이온]]을 중심으로 하는 결합을 다룬다. d오비탈이 존재하는 전이금속의 특성상 상당히 넓은 폭의 결합을 형성할 수 있다. 결합의 형성은 크게 두 가지 측면에서 접근할 수 있는데, 오비탈의 안정성(전자 배치)과 구조의 안정성(결합수)을 고려하여 결정된다.
중심 금속 이온
일반적으로 중심 금속 이온은 사각평면, 팔면체 구조 등 4 내지 6의 결합수를 갖는데, 이 자리에는 리간드 장의 세기나 중심 금속 이온에 따라 16전자 내지 18전자의 배치를 갖게끔 결합이 형성된다. 하지만 안정적인 준위의 오비탈을 점유한 상태에서도 결합자리가 남을 경우, 중심 금속 이온은 구조의 안정성을 확보하기 위해서 반결합 오비탈을 사용하여 추가적인 결합을 형성하게 되며 이로 인해 18개가 넘는 전자를 갖게 되는 경우가 있다.
이러한 결합 문제를 해결하기 위해서 금속 이온은 금속 이온끼리의 결합을 형성하여 각 금속 이온이 18전자를 점유하는 이핵 내지는 다핵 중심을 형성한다.
리간드
이러한 환경에서는 중심 금속 이온과 결합하는 리간드도 다양한 결합을 형성할 수 있다. 수소화붕소에서 나타나는 가교결합과 같이 두 개의 금속 이온에 다리를 걸치고 있는 결합이나 역결합에 의한 이수소화물, 이질소화물과 같이 측면 결합을 형성하는 경우도 있다.
또한 페로센(ferrocene)과 같이 합토성에 의한 결합 또한 존재한다.
산업적 응용
유기금속 화합물은 균일 촉매(homogeneous catalysis)와 정량 분석용 시약으로 다양한 상업적 반응에 널리 사용된다. 예를 들어, 염기성과 환원성이 매우 강한 유기 리튬, 유기 마그네슘, 유기 알루미늄 화합물은 정량 분석 시약으로 이용될 뿐만 아니라 다양한 고분자 합성반응 촉매로도 사용된다.
카보닐화 반응
- 몬산토 공정(Monsanto process): 메탄올(methanol)의 카보닐화 반응으로 아세트산(acetic acid, CH3COOH)을 생산하는 공정
- 웨커 공정(Wacker process): 팔라듐 촉매를 이용하여 에틸렌(ethylene)을 산화시켜서 아세트알데하이드(acetaldehyde)를 생산하는 공정
올레핀 중합 반응
- 폴리에틸렌(polyethylene, PE)과 폴리프로필렌(polypropylene, PP)을 생산하는 공정
반도체 생산
- 휘발성의 유기금속 화합물의 유기금속 화학 증착(metalorganic chemical vapor deposition, MOCVD)과정으로 발광 다이오드(Light emitting diode, LED) 제조
참고자료
같이 보기

 위키원
위키원