"물리화학"의 두 판 사이의 차이
(새 문서: 썸네일|300픽셀|물리화학(物理化學, Physical Chemistry)의 4가지 분야 '''물리화학'''(物理化學, Physical Chemis...) |
잔글 (→같이 보기) |
||
| 91번째 줄: | 91번째 줄: | ||
* [[반응속도론]] | * [[반응속도론]] | ||
| − | {{ | + | {{제조|검토 필요}} |
2024년 6월 13일 (목) 09:39 판
물리화학(物理化學, Physical Chemistry)은 물리학 지식을 바탕으로 각종 화학적 현상을 설명하는 화학과 물리학의 하위 학문이다. 양자화학, 화학 통계열역학, 화학반응속도론이 주된 분야이며, 고분자화학, 표면화학, 물리유기화학, 생물리화학, 광화학, 분광학[1] 역시 물리화학의 범주에 들어간다. 즉, 물리화학은 모든 화학 분야의 기반이 되는 학문이다.
개요
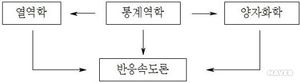
물리화학(物理化學, physical chemistry)은 화학계의 특성과 거동을 지배하고 있는 물리적 원리들을 연구하는 학문이다. 화학계는 미시적 또는 거시적 관점의 어느 하나로 해석할 수 있는데 미시적(microscopic) 관점에 의한 해석은 분자개념을 기초로 하고, 거시적(macroscopic) 관점에 의한 해석은 비교적 큰 척도인 물질의 특성을 연구하는 것이다. 물리화학은 크게 열역학(熱力學, thermodynamics), 양자화학(量子化學, quantum chemistry), 통계역학(統計力學, statistical mechanics), 반응속도론(反應速度論, chemical kinetics)의 네 가지 분야로 구분한다.
물리화학에서 통계역학은 미시적 접근법인 양자화학과 거시적 접근법인 열역학간의 연결고리 역할을 하고 반응속도론은 다시 다른 세 가지 분야의 이론들을 복합적으로 연구하는 학문이다. 물리화학의 원리들은 화학의 모든 분야에 있어서 기본 틀을 형성하는 근간이 된다.
유기화학자들은 반응속도론을 이용하여 반응메커니즘을 규명하고 양자화학 계산을 통해 반응중간체의 구조와 안정성을 연구하며 양자화학으로부터 유도된 대칭법칙을 사용하여 반응경로를 예측한다. 화합물의 구조를 규명하기 위해 핵자기 공명(NMR: Nuclear Magnetic Resonance) 분광학(分光學, spectroscopy)과 적외선 분광(IR: InfraRed) 광도계 등을 사용하는데 그 원리는 물리화학에 기반을 두고 있다. 무기화학자들 역시 양자화학과 다양한 분광 광도법을 이용하여 화학결합을 연구하고 다양한 무기화합물의 반응성을 예측한다.
열역학(thermodynamics)은 계(system)를 설명하는 다양한 평형 특성 값들 간의 관계와 변화과정에서 이 특성 값들의 변화정도를 거시적 관점에서 연구하는 학문이다. 고전역학으로서는 분자와 이를 구성하고 있는 전자와 핵의 거동을 완전하게 설명할 수 없으며 양자역학의 도움으로 이들의 거동을 설명할 수 있게 되었다. 이러한 원자구조와 분자 결합 해석에 적용되는 양자역학과 분광학을 연구하는 학문을 양자화학이라 한다. 열역학에서의 거시적 특성 값은 분자 수준에서의 거동을 모두 합한 결과물이라고 할 수 있다. 통계역학을 통해서 분자 수준과 거시적 수준 간의 관계를 설명할 수 있는데 이로부터 열역학의 여러 가지 법칙들이 타당함을 입증할 수 있으며 분자적 특성 값으로부터 거시적인 열역학적 특성 값을 계산할 수 있다.
속도론(速度論, kinetics)은 화학반응, 확산, 전기화학전지에서의 전하의 흐름 등과 같은 전달 과정에서의 거동을 연구하는 학문이다. 전달 과정은 열역학, 양자화학 및 통계역학의 이론들을 적절히 사용하여 해석한다.
물리 화학의 본질
화학은 기본적으로 분자라는 고유한 성질을 갖는 화합물을 연구하는 학문이다. 변화가 일어나는 기본 단위가 주로 분자이기 때문에 일반적으로 모든 현상을 분자 단위에서 관찰하고 설명한다. 분자를 구성하는 기본 단위는 원자이기 때문에 원자 사이의 화학 결합의 본질과 화학 반응이 일어나는 과정에서 원자들 사이의 결합에 일어나는 변화를 이해하는 것은 물리 화학의 기본적인 내용이다.
20세기 이전의 물리화학은 주로 열역학과 화학 반응 속도로 화학 반응이 일어나는 반응계를 거시적이고 현상학적인 방법을 이용하여 이해하려고 노력하였다. 그 결과 반응 차수, 화학 평형, 활동도 등과 같은 많은 물리 화학 개념들이 정립되었다. 분자의 운동 특성과 반응 메커니즘을 이해하기 위해서는 분자의 전자 구조에 대한 이해가 필요하였는데, 20세기 초반에 비약적으로 발전한 양자 역학은 다양한 분자의 전자 구조와 반응성을 이해하는데 중요한 기본적인 이론적 토대가 되었다. 또한, 실험적인 측면에서는 분광학의 발전 결과 분자 구조와 특성에 대한 다양한 정보가 얻어지면서 미시적인 분자 수준의 성질과 거동을 이해할 수 있게 되었다. 그런데도, 원자와 분자는 매우 작고 (nm 이하) 이들이 반응에 관여하는 시간이 매우 짧기 (피코초) 때문에 이를 직접 관찰하는 일은 20세기 초 만하더라도 불가능한 일이었다. 하지만 최근 펨토초 레이저의 발달과 함께 분광학으로 관찰할 수 있는 영역들이 넓어지면서, 화학 반응 과정을 스냅숏으로 관찰하는 일이 가능해졌다. 물질의 본질에 대해 더 깊이 있는 이해를 하기 위한 연구가 꾸준히 진행되면서 물리 화학의 영역과 깊이는 더욱더 넓고 깊어질 것이다.
다시 말하면, 물리 화학은 물질의 성질을 이해하고자 하는 학문으로, 인간의 감각을 통해 인지할 수 있는 거시적인 현상에서부터 분자 원자 수준의 미시적인 현상에 이르기까지 관찰과 설명을 통해 발전하고 있으며, 화학 평형, 분자 동역학, 통계 역학, 양자 화학, 열역학, 물리학 등을 기반으로 이론적 접근과 실험 연구를 함께 하고 있다.
물리 화학의 관심 분야
물리 화학의 주요 관심 분야를 나열해 보면 다음과 같다.
- 계면 화학 : 여러 가지 물질의 표면 특성 연구
- 고체 화학 : 고체의 조성뿐 아니라 고체의 내부와 고체 사이에서 일어나는 변화 연구
- 반응 속도론 : 화학 반응 속도에 관한 실험 및 이론적 연구
- 복사 화학 : 고에너지를 가진 복사가 물질에 미치는 영향 연구
- 양자 화학 : 분자 속 전자 분포를 분석하고, 분자의 화학적 거동을 전자 구조로 설명
- 열역학 : 화학 반응에 수반되는 에너지 변화와 온도와 압력이 화학 반응에 미치는 영향 연구
- 입체 화학 : 분자 속 원자의 배열 상태를 연구하고, 그로 인한 특성 연구
- 핵화학 : 원자핵 반응을 연구하는 데 화학적 기술 이용
- 분자 동역학 : 분자를 구성하는 원자들 사이의 퍼텐셜을 기반으로 분자와 원자의 동적인 거동 연구
- 분광학 : 빛과 물질의 상호 작용 결과 일어나는 빛의 흡수, 방출, 산란 등에 의한 스펙트럼을 통해 물질의 구조와 변화 연구
이와 같은 물리 화학의 광범위한 관심 분야는 화학의 영역에만 국한된 것이 아니라, 생명 과학과 재료 과학을 포함하여 그 대상에 제한이 없다고 해도 과언이 아니다.
물리 화학의 주요 개념
물리화학의 주요한 개념들은 물질의 화학적인 변화와 관련된 물리적 법칙을 세우는 데 중심을 이룬다. 물리 화학과 관련이 깊은 몇 가지 중요한 개념들은 다음과 같다.
- 물질의 탄성, 가소성, 표면 장력과 같은 물리적 성질에 영향을 주는 분자간 힘
- 화학 반응 속도와 반응물의 농도, 온도, 압력 등의 관계를 설명해 주는 반응 속도론
- 물질의 전기 전도도와 관련이 깊은 전자 또는 이온의 활동도
- 세포막과 같은 다양한 종류의 계면 또는 표면의 다양한 현상을 설명하기 위한 전기 화학과 표면 화학
- 용질의 화학종과 상관없이 농도에만 의존하는 끓는점, 어는점, 증기압, 삼투압 등 총괄성
- 화학 반응 또는 상전이 과정에서 일어나는 열에너지의 흐름과 화학 결합의 관계
- 화학 전지에서 일어나는 산화 환원 반응과 관련된 반쪽 전지 반응과 환원 전위
- 열역학과 관련 있는 상변이, 자유도
- 물질의 기본 단위인 원자와 분자의 전자 구조를 설명하는 양자 역학을 기반으로 한 오비탈
역사와 발전단계
물리화학이란 용어는 1700년대에 최초로 사용되었다. 러시아의 시인이며 물리학자겸 화학자인 미하일 로모노소프(Mikhail Lomonosov, 1711~1765)는 1752년 물리화학이라는 학문의 개념을 처음으로 제안하였다. 물리화학이 학문으로써 널리 인식되기 시작한 것은 1887년 프레드리히 빌헤름 오스발트(Friedrich Wilhelm Ostwald, 1853~1932)와 제이콥스 헨리커스 반트 호프(Jacobus Heinricus Van't Hoff, 1852~1911)가 '물리화학, 반응양론 그리고 친화력에 관한 잡지'(Zeitschrift für Physikalische Chemie, Stoichiometrie und Verwandtschaftslehre)를 창간하면서 부터이다.
오스발트는 화학평형, 화학속도론 및 용액을 연구하였으며 물리화학교재를 처음으로 저술하였다. 그는 조지아 윌리어드 깁스(Josiah Willard Gibbs, 1839~1903)가 화학 열역학 분야에서 선구자적 업적을 달성하도록 하는데 커다란 힘이 되었으며 첫 번째 노벨수상자로서 알버트 아인슈타인(Albert Einstein, 1879~1955)을 추천하였다. 1908년까지도 원자와 분자의 실체가 인정되지 않았던 당시 오스발트, 반트호프, 그리고 스반테 아우구스 아레니우스(Svante August Arrhenius, 1859~1927) 이렇게 3인은 선구자적인 식견을 가졌던 물리화학의 창시자로서 지금까지 그 공로를 인정받고 있다.
1782년과 1784년 사이에 앙투안 로렌 라부아지에(Antonie Laurent Lavoisier, 1743~1794)와 피에르 시몽 라플라스(Pierre Simon Laplace, 1749~1827)는 수많은 화학반응에서 발생하는 열량을 측정하고 열화학의 기반을 수립하였다. 1830년대에 독일의 헨리 헤스(Henri Hess, 1802~1850)는 열량합의 불변 법칙을 만들었고 이 법칙은 열량을 직접 측정하기 어렵거나 불가능한 경우에 반응열을 측정하는데 사용되었다. 1850년대와 1860년대에는 덴마크 화학자 줄리어스 톰센(Julius Thomsen, 1826~1909)과 프랑스인 마르셀린 베르틀로(Marcelin Berthelot)에 의해서 많은 열화학적 측정들이 이루어졌다. 베르틀로는 흡열반응과 발열반응이라는 용어를 도입하고 연소열을 측정할 수 있는 열량계를 발명하였다.
1829년에 토마스 그레이엄(Thomas Graham, 1805~1869)은 기체의 확산에 관한 실험을 수행하여 '기체들의 확산에 관한 상대속도는 밀도의 제곱근에 반비례 한다.' 는 논문을 발표하였다. 분자운동론에 대한 제대로 된 수학적 정리는 1857년 독일의 루돌푸 율리어스 클라우지우스(Rudolph Julius Emmanuel Clausius, 1822~1888)에 의하여 이루어졌다. 이때에는 이미 에너지의 개념이 정의되었으며 기체의 온도가 분자들의 평균 운동에너지와 관련이 있다는 것도 알려졌다. 1859년에 제임스 클러크 맥스웰(James Clerk Maswell, 1831~1879)은 통계학적 기법을 사용하여 분자들의 속도가 넓게 분포되어 있다고 제안하였으며 1871년에 루드빅 에드워드 볼쯔만(Ludwig Eduard Boltzmann, 1844~1906)은 맥스웰의 분포 법칙을 분자들 사이에 힘이 존재하는 경우들에 대해서 일반화하였다.
1873년에 요하네스 반데르 발스(Johannes Diderick van der Waals, 1837~1923)는 이상기체 방정식보다 실제 기체의 행동에 가깝게 나타내주는 기체 방정식을 고안하였다. 반데르 발스가 분자들 사이의 인력과 분자들이 차지하는 일정부피를 고려하여 만든 기체 방정식은 대부분의 기체에 잘 맞았다. 1869년 토마스 앤드루스(Thomas Andrews, 1813~1885)는 압력을 받는 조건에서 기체들의 성질을 연구하였으며 그 이상의 온도에서는 기체가 액체로 될 수 없는 온도인 임계온도의 개념을 제시하였다.
1905년에 알버트 아인슈타인(Albert Einstein, 1879~1955)은 작고 분산된 입자들의 브라운 운동을 분자 간 충돌을 이용하여 설명할 수 있다는 것을 보여주었으며 이 현상에 대한 수학적 처리법을 개발하였다.
최초의 반응속도 연구는 1777년 칼 웬첼(Carl Wenzel, 1740~1793)에 의하여 이루어졌다. 그는 일정한 양의 금속이 산에 녹는데 시간이 얼마나 걸리는가를 측정하여 금속을 산에 대한 친화력 순서로 배열할 수 있다고 제안하였고 주어진 금속과 반응하는 산의 농도를 변화시켜 농도가 절반으로 되면 금속 조각이 녹는데 두 배의 시간이 걸린다는 것을 알아내었다.
1850년에 루드빅 페르디난드 빌헤미(Ludwig Ferdinand Wilhemy, 1812~1864)는 최초로 철저한 반응속도론 연구결과를 발표하였다. 그는 산이 존재하는 조건에서 수크로오스의 가수분해를 연구하였다. 이당류인 수크로오스가 단당류인 글루코오스와 프룩토오스로 가수분해되면 용액의 광학회전이 감소하는 현상을 측정하여 수크로오스의 농도 감소와 산의 농도와의 상관관계가 있다는 것을 알아내었고 광학회전의 반응이 진행되는 동안에는 일정하게 유지된다는 것을 알아내었다.
1884년 반트호프는 『화학역학연구(Etudes de Dynamique Chimique)』라는 제목의 저서에서 반응속도와 반응메커니즘 그리고 온도에 따른 반응속도 변화를 다루었다. 1903년에 아서 랩워(Arthur Lapworth, 1872~1941)는 시안화수소가 카르보닐 화합물에 첨가되는 것을 연구하였는데 노란색을 가진 화합물인 장뇌퀴논을 선택하여 노란색이 없어지는 것을 관찰함으로써 반응경로를 추적할 수 있었다. 그는 산이 반응을 더 느리게 하고 염기는 반응을 촉진시킨다는 것을 알아내었고 실제 반응에서 공격하는 화학종은 시안화이온이라는 결론을 내렸다.
1884년 아레니우스는 산, 염기 그리고 염의 비정상적 성질을 설명해 주는 이론을 제안하였다. 그의 박사학위 논문에서 용액이 묽어지면 전도도가 감소하지만 용질의 농도가 묽어지는 것만큼 감소하지 않는다는 것을 알아내었다. 아레니우스는 이런 용액들의 삼투압, 어는점 내림 등이 용액이 함유하는 여분의 입자들 때문이며 이것은 분자가 이온들로 용해되는 것을 설명하였다. 아레니우스는 전도도 측정을 통해 용질의 분해 정도를 추정할 수 있었다.
산과 염기의 정의는 1923년 요하네스 니꼴라스 브뢴스테드(Johannes Nicolaus Brønsted, 1879~1947)와 토마스 마틴 로우리(Thomas Martin Lowry, 1874~1936)에 의해서 확장되었다. 이들은 산을 수소이온의 주개로 염기를 수소이온의 받개로 생각하였고 산은 산으로부터 수소이온을 받을 수 있는 염기가 존재할 때만 산으로 작용할 수 있다고 하였다. 산-염기 개념은 길버트 뉴턴 루이스(Gilbert Newton Lewis, 1879~1947)에 의해서 더욱 확장되었는데 그는 1938년에 전자쌍을 받아들어 공유결합을 형성할 수 있는 물질을 산으로, 전자쌍을 내 놓을 수 있는 물질을 염기로 정의하였다.
1840년대부터 많은 연구자들은 화합물의 여러 가지 성질들과 분자구조와 연관시키려고 노력하였다. 이러한 분자구조를 결정하는데 적외선 스펙트럼이 많은 정보를 제공하였는데 양자이론의 발전과 함께 분자의 진동과 회전 등의 에너지를 비교하여 구조를 규명하는데 활용되었다. 분자구조의 결정에 사용된 또 다른 물리적 성질은 X-선의 회절이었다. 1956년 도로시 크로우풋 호치킨(Dorothy Crowfoot Hodgkin, 1910~1994)이 8년간 X-선 회절 연구 끝에 비타민 B12의 구조를 결정하였다.
라이너스 폴링(Linus Pauling, 1901~1994)은 수소 결합형성과 일치하는 펩티드 결합의 배열을 생각하여서 단백질의 두 가지 가능성 있는 구조를 제안하였다. 이것들은 α-나선영역과 β-병풍영역 그리고 일부는 혼합 구조로 되어 있음을 제안하였다. 1953년 프란시스 크릭(Francis Crick, 1916~2004)과 제임스 드웨이 왓슨(James Dewey Watson, 1928~)은 폴링과 비슷한 접근 방법을 사용하여 DNA 분자에 대한 이중나선 구조를 제안하였다.
참고자료
같이 보기
| ||||||||||

 위키원
위키원