배위결합
배위결합(配位結合, Coordinate covalent bond)은 두 원자가 공유결합을 할 때 결합에 관여하는 전자가 형식적으로 한 쪽 원자에서만 제공되어 결합된 경우를 말한다. 보통의 공유 결합과 배위결합간의 차이는 인위적으로 구분된 것이지만, 서적 등에 많이 쓰인다. 또한, 결합력과 결합에 대한 설명은 다른 극성 공유 결합과 같다.
배위 결합은 루이스 염기 (전자쌍 주개)가 루이스 산 (전자쌍 받개)에게 전자쌍을 주는 것으로 형성된다. 전자쌍 받개가 음전하를 받아들일 때, 전자쌍 주개가 양전하를 받는다.
삼플루오린화붕소와 암모니아의 결합이 대표적인 예시이다.
개요[편집]
배위결합이란 루이스 산(Lewis acid)과 루이스 염기(Lewis base)가 반응하여 루이스 첨가생성물(Lewis adduct)을 생성할 때, 결합에 참여하는 공유 전자(shared electrons)가 한 쪽의 원자에서 일방적으로 제공되면서 생기는 결합을 말한다. 배위결합을 하는 루이스 첨가생성물을 배위 착화합물(coordination complex)이라 하며 일반적으로 배위 중심(coordination center)이라 불리는 금속 원자나 이온과 주위에 리간드(ligand) 혹은 착화제(complexing agent)로 불리는 분자 또는 이온으로 이루어진다. 금속을 포함한 많은 화합물, 특히 전이 금속 화합물들은 배위 착화합물이며 배위 중심이 금속 원자인 착화합물을 금속 착화합물(metal complex)이라고도 한다. 이전에는 배위 결합이란 용어를 단분자 불균일 분해(unimolecular heterolysis)의 반대 의미로 사용했었으며, 배위 공유(coordinate covalence)나 배위 연결(coordinate link)이라고도 불렀다. 동의어 중 하나였던 공여 결합(dative bond)은 더 이상 사용되지 않는다. 결합 전자의 기원이 형성된 결합의 성질에 영향을 미치지 않는데, 예로 메틸 양이온과 염소 음이온으로부터 메틸 염화물이 형성되는 것이 배위 결합 범주에 포함되는데 반해 메틸 라디칼과 염소 원자가 만나는 경로로 이루어진 결합은 명백히 다른 결합 방법이지만 결과적으로 같은 탄소-염소 결합이 생성된다. 배위(coordination)는 중심 원자 주위의 리간드(ligand)의 수를 설명하기 위해서도 사용되며 반드시 2-전자 결합만을 의미하지는 않는다.
배위결합 화합물의 예[편집]
배위결합 화합물은 주위에서 쉽게 접할 수 있다. 유기 화학에서 염기성 아민(amine)이 산소 원자에 두 개의 전자를 주는 것으로 설명할 수 있는 아래의 아민 산화물과 같은 화합물에 대해 쌍극자 결합(dipolar bond)이란 용어를 사용하기도 한다.
R₃N → O
화살표(→)는 아민 산화물의 질소와 산소 사이의 결합 내 두 전자가 아민에서 비롯된 것임을 나타낸다. 일반적인 공유 결합에서 결합하는 원자는 각각 하나씩의 전자를 제공하기에 아민의 질소와 산소의 결합이 이루어진 후 동시에 질소에 남은 홀 전자가 산소 원자로 전달되는 과정에서 형식 전하(formal charge)가 생성되기 때문에 아민 산화물의 전자 구조는 다음과 같이 표현될 수도 있다.
R₃N+O-
이 전자 구조는 전기 쌍극자(electric dipole)를 가지므로 극성(polar) 결합이다. 실제로 원자는 부분 전하를 가지고 있는데 결합에 관여한 두 개의 원자 중 전기음성도(electronegative)가 큰 원자가 일반적으로 부분 음전하를 띠게 된다. 접두어 쌍극자(dipolar), 공여(dative), 또는 배위(coordinate)는 단순히 결합을 생성하는데 사용된 전자의 기원을 나타내기 위해 사용된 것이다.
배위결합의 또 다른 예로 질소 원자에 비공유 전자쌍(lone pair of electrons)을 가진 루이스 염기인 암모니아(NH₃) 분자와 옥텟 규칙(octet rule)을 만족하지 못하는 붕소 원자를 가진 루이스 산인 트라이플루오린화 붕소(BF₃)의 상호 작용을 들 수 있다. 첨가생성물이 형성되면 붕소 원자는 옥텟 규칙을 만족한다. 암모니아의 최고 점유 분자 오비탈(highest occupied molecular orbital, HOMO)에 있는 비공유 전자쌍이 붕소의 2p 오비탈이 기여한 BF3의 최저 비점유 분자 오비탈(lowest unoccupied molecular orbital, LUMO)과 상호작용으로 첨가생성물을 만들어 전자쌍 주개 NH₃의 HOMO의 전자를 안정화시킨다. 옥텟 규칙을 만족하지 않는 BF₃분자의 경우, 플루오린 원자의 비공유 전자쌍을 붕소의 비어 있는 2p 오비탈이 받는 역결합(back bonding)이 가능해 B-F 결합 길이가 일정 정도 이중 결합 특성을 지녀 짧은 반면, 암모니아와 배위 결합한 첨가생성물의 경우 받을 수 있는 빈 오비탈이 없어 상대적으로 B-F 결합 길이가 길게 된다.
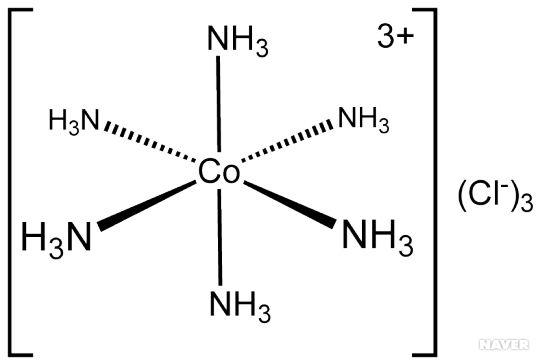
배위결합 착화합물의 전자 구조는 중심 금속에 한 쌍의 전자를 제공하는 리간드의 세트로 설명할 수 있다. 예로 금속 암민 착물은 중심 금속에 한 개 이상의 암모니아가 리간드로 결합된 형태의 화합물을 뜻하며 거의 모든 금속이 암모니아와 착화합물을 형성할 수 있다. 예를 들어, 염화 헥사암민코발트(III)([Co(NH₃)₆]Cl₃)의 경우 암모니아 리간드 여섯 개 각각이 코발트(III) 이온에 비공유 전자쌍을 제공하며, 이 경우 형성된 암모니아와 코발트 사이의 결합이 배위 결합이다.
모든 금속 아쿠아 착화합물([M(H₂O)n]x⁺)의 경우에도 전자 쌍을 제공하는 아쿠아 리간드와 금속 양이온 사이의 결합을 배위 결합으로 표현한다. 앞서 질소와 산소의 결합에서 얻어지는 구조와는 달리, 일산화 탄소(CO)의 경우 탄소 원자가 산소 원자보다 전기음성도가 작음에도 불구하고 탄소 원자가 부분적으로 음전하를 띠는 [C⁻-O⁺] 형식 구조로 나타내는데, 이는 금속-카보닐의 결합을 이해하는 데 도움이 된다. 대부분의 유기금속(organometallic) 화합물과 배위 화합물에서 금속과 리간드간의 상호 작용도 유사하게 기술할 수 있다.
리간드와 착화합물의 구조[편집]
리간드의 종류에 따라 중심 금속과 한 개 이상의 결합을 형성할 수 있으며 이에 따라 리간드의 자리 수가 결정된다. 한 개의 결합을 형성하면 한자리(monodentate) 리간드, 두 개면 두자리(bidentate), 세 개면 세자리(tridentate), 그 이상이면 여러 자리(multidentate 혹은 polydentate) 리간드라고 하며 두자리 이상의 리간드를 킬레이트(chelate)라고 한다. 착화합물의 구조는 일반적으로 배위수(coordination number)와 리간드의 종류 및 크기 등 다양한 요인에 따라 결정되는데, 배위수가 2이면 선형 구조, 3이면 삼각형 구조, 4이면 평면 사각형이나 정사면체 혹은 삼각 피라미드 구조, 5이면 삼각 쌍뿔이나 사각 피라미드 구조, 6이면 주로 팔면체 구조를 갖는다.
결정장 이론과 분광화학적 계열[편집]
결정장 이론(crystal field theory)에서 리간드의 고립 전자쌍을 음전하로 간주하여 중심 금속 이온의 d-오비탈의 전자와 반발함에 따라 결정장에서 d-오비탈의 에너지가 갈라지게 된다. 팔면체 장에서 d-오비탈들 간의 에너지 차이를 팔면체 갈라짐 에너지(octahedral splitting energy, Δo)라고 하며 Δo의 크기는 리간드에 의한 장의 세기에 의해 결정된다. 정의에 의해 센 장 리간드(strong field ligands)는 약한 장 리간드(weak field ligands) 보다 Δo가 크다. Δo의 크기에 따라 리간드를 분류할 수 있고 이 순서는 모든 금속 이온에 대해 거의 변하지 않으며 이를 분광화학적 계열(spectrochemical series)이라고 부른다.
O₂²⁻< I⁻ < Br⁻ < S²⁻< SCN⁻ (S원자 결합) < Cl⁻ < N₃⁻ < F⁻< NCO⁻ < OH⁻ < C₂O₄²⁻ ≈ H₂O < NCS− (N원자 결합) < CH₃CN < 글리신(glycine, gly) < 피리딘(pyridine, py) < NH₃ < 에틸렌다이아민(ethylenediamine, en) < 2,2’-바이피리딘(2,2'-bipyridine, bipy) < 1,10-페난트롤린(1,10-phenanthroline, phen) < NO₂⁻ < PPh₃ < CN⁻ < CO
리간드장 이론[편집]
결정장 이론은 단순히 리간드를 점전하나 쌍극자로 다루고 리간드와 금속 원자 오비탈간의 겹침(overlap)을 고려하지 않았는데, 분광학적 계열은 금속과 리간드의 원자가 오비탈의 대칭성을 고려하여 다원자 분자의 결합처럼 다루는 리간드장 이론(ligand field theory)으로 더 잘 설명할 수 있다. 리간드장 이론에 따라 금속 오비탈과 선형 조합된 리간드 오비탈로부터 만들어진 분자 오비탈 중 리간드가 NH₃ 분자나 F⁻ 이온일 경우 σ 대칭을 갖고 있으며 리간드가 Cl⁻, Br⁻, OH⁻, 그리고 H₂O 리간드의 경우 π 주개 리간드(π-donor ligand), 포스핀(PR₃), N₂, 그리고 CO 리간드의 경우 π 받개 리간드(π-acceptor ligand)로 작용할 수 있다. π 주개 리간드는 Δo를 감소시키고 π 받개 리간드는 Δo를 증가시킨다. 이러한 결합이 가능한 경우 분광화학적 계열은 주로 π 결합의 효과에 의존한다. 따라서 분광화학적 계열의 순서는 리간드와 금속 간의 σ 결합과 π 결합 효과로 아래와 그림과 같이 설명할 수 있다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원