일산화탄소

일산화 탄소(一酸化炭素, carbon monoxide)는 탄소와 산소로 구성된 화합물이다. 분자식은 CO이다. 석탄이나 석유를 다량 연소시키는 공업지대의 대기에 포함되어 있는 경우가 있으며, 가정에 공급되고 있는 도시가스에도 포함되어 있다. 탄소 화합물이 불완전 연소되면 발생한다. 가연성이며 독성이 있어서 취급에 주의가 필요하다. 산소보다 헤모글로빈과의 친화력이 200배 정도 더 좋기 때문에 소량 흡입시에도 호흡 대사를 방해하여 생명 유지가 어려울 수 있으므로 주의해야 한다.
일산화탄소는 연탄의 연소가스나 자동차의 배기가스 중에 많이 포함돼 있다. 또 큰 산불이 일어날 때 주위에 산소가 부족하여 많은 양의 일산화탄소가 발생되기도 하고, 담배를 피울 때 담배연기 속에 함유되어 배출되기도 한다.
개요[편집]
일산화탄소는 무색, 무취이며, 공기보다 약간 낮은 밀도를 갖는다. 35 ppm 이상의 농도에서 인체에 유독한데, 대기 중에서 지역별 농도가 다르며, 반감기가 짧은 편이다. 헤모글로빈과 결합하여 카복시헤모글로빈(carboxyhemoglobin)을 만듦으로써 헤모글로빈의 산소 결합 자리를 차지하여 인체 조직에 산소가 전달되지 못하게 하는 독성 물질이다. 착화합물에 리간드로 일산화 탄소가 포함될 수 있는데, 일산화 탄소 리간드를 카보닐이라고 한다. 끓는점과 녹는점이 질소와 유사하지만, 결합 에너지는 질소보다 커서 가장 강한 화학 결합으로 알려져 있다. 알데하이드나 아세트산 등의 간단한 유기 화합물 생산에 출발 물질로 일산화탄소가 쓰이며, 육류 색소나 환원제로 사용된다.
역사[편집]
아리스토텔레스(Aristotle)가 석탄을 태우면 유독성 연기가 발생한다고 한 것이 일산화 탄소에 대한 첫 번째 기록이다. 실제로 고대 사형 집행 방법으로 밀폐된 목욕탕에서 석탄을 태워 죄수를 죽이는 사례가 있었다. 기원 전후에는 일산화 탄소에 의한 죽음에 대하여 이유를 잘 알지는 못했지만, 공기의 조성에 변화가 생겨 호흡할 때 해를 끼치는 것으로 추정하였다.
1776년 프랑스의 드 라숑(de Lassone)이 산화 아연을 코크스(coke)와 함께 연소시켰을 때 푸른 불꽃의 기체 생성물을 수소라고 주장하였는데, 1800년에 스코틀랜드의 크뤽생크(W. C. Cruikshank)가 이를 정정하여, 발생하는 기체는 탄소와 산소를 포함하는 화합물이라고 발표하였다. 이후 1846년경 버나드(C. Bernard)에 의해 이 기체의 유독성이 철저하게 연구되었다.
2차 세계대전 동안 휘발유나 디젤 연료가 부족한 지역에서는 일산화탄소를 포함하는 기체 혼합물을 사용하였으며, 유대인 수용소에서 일산화 탄소가 대량 살상 기체로 쓰이기도 하였다.
성질[편집]
물리적 성질[편집]
상온에서 무색, 무취, 무미의 기체로 존재한다. 끓는점은 -191.5°C, 녹는점은 -205.0°C이다. 임계 온도는 -139°C이며 임계 압력은 35atm이다. 25°C에서 생성열은 26.62cal/mole, 연소열은 67.62cal/mole이다. 물에는 잘 녹지 않아, 0°C에서 1atm의 일산화탄소와 평형상태에 있는 물 100ml는 0.0044g의 일산화탄소를 포함한다. 알코올, 염화 구리(II) 수용액에는 잘 녹는다. 활성탄에 쉽게 흡착된다.
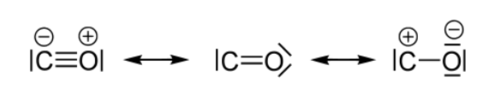
일산화탄소는 다음의 세 공명 구조를 가지고 있다고 볼 수 있다.
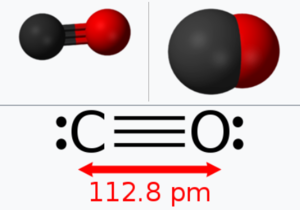
C 원자와 O 원자간의 결합 길이는 1.13Å이다.
화학적 성질[편집]
공기 중에서 점화하면 푸른 불꽃을 내며 연소하여 이산화탄소를 생성한다. 반응식은 다음과 같다.
2CO + O₂ → 2CO₂
일산화 탄소가 다음과 같이 분해되는 일은 온도가 수천도 이상으로 올라가지 않는 한은 잘 일어나지 않는다.
CO → C + 1/2 O
다음과 같은 분해는 상온에서는 팔라듐 촉매 존재 하에 가능하며, 400~700°C에서는 많은 물질의 표면이 다음 분해 반응의 촉매 역할을 한다.
2CO → C + CO₂
수증기와는 가역적으로 반응하여 다음과 같은 반응을 일으킨다.
CO + H₂O ⇄ CO₂ + H₂
그 외에 일산화탄소가 관여하는 대표적인 반응으로는 다음과 같은 것이 있다.
- 코발트, 구리, 철, 납, 망가니즈, 몰리브덴, 니켈, 은, 주석 등의 산화물을 환원시켜 금속의 형태로 만들거나 저급 산화물로 만든다.
- 리간드로서 작용하여 니켈, 철, 코발트, 몰리브덴, 루테늄, 로듐, 오스뮴, 이리듐 등의 금속과 금속 카보닐을 생성한다. 대표적인 것으로는 니켈 카보닐(Ni(CO)₄)이 있다.
- 염소와 반응하여 포스젠을 만든다.
- 수산화 나트륨과 반응하여 폼산 나트륨을 생성한다.
- 적절한 조건, 반응물, 촉매 존재 하에 반응하면 메탄올, 폼산 메틸, 프로피온산, 프로필 알코올 등의 매우 많은 종류의 알코올, 알데하이드, 케톤, 산, 에스터를 얻을 수 있다.
발생[편집]
밀폐된 공간에 있는 내연 기관이나 난로와 같이 이산화탄소가 생성될 만큼 산소가 충분치 않을 경우 부분 산화에 의해 일산화탄소가 발생한다. 대기 중에서 충분한 산소가 존재하면 일산화탄소는 푸른 불꽃을 내며 연소하여 이산화 탄소를 생산한다. 1960년대 이전에는 석탄 기체(coal gas)라고 하여 가정용 불빛, 요리, 난방 등에 일산화 탄소를 중요 연료로 사용했다. 현대 기술에서도 철의 제련 시 일산화 탄소를 부산물로 생성하여 쓰기도 한다.
일산화탄소의 가장 큰 원천은 자연에서 발생하는 것으로 대류권의 광화학 반응으로부터 연간 5×1012 kg이 생성되며, 그 밖에도 화산, 산불, 연소 등으로부터 자연적으로 발생한다. 그런데 일산화 탄소의 자연적 발생량은 해마다 다르므로 정확한 측정은 어렵다.
생물학적으로도 헴 산화 효소(heme oxygenase) 작용에 의한 헤모글로빈 붕괴로부터 생산된다. 이 과정은 인체가 일산화탄소를 호흡하지 않아도 일정량의 카복시헤모글로빈을 생성하게 한다.
생산[편집]
공업적 생산[편집]
과량의 탄소를 고온에서 연소시킬 때 형성되는 일산화탄소와 질소의 혼합물인 발생로 가스(producer gas)가 일산화탄소의 주요 산업적 원천이다. 이다. 초기에 형성되는 이산화탄소는 남아 있는 탄소와 더 반응하여 일산화탄소를 생성하며 평형을 이루는데, 이 반응을 부두아르 반응(Boudouard reaction)이라 하며, 800 °C 이상에서 일산화 탄소가 주요 생성물이다.
CO₂ + C → 2 CO (ΔH = 170 kJ/mol)
또 다른 원천으로 '수성 가스(water gas)'가 있는데, 수성 가스는 수증기와 탄소의 혼합물이 흡열 반응을 하여 생성되는 수소와 일산화 탄소 혼합물을 뜻한다.
H₂O + C → H₂ + CO (ΔH = +131 kJ/mol)
유사한 의미로 '합성 가스(synthesis gas)'도 있는데, 이는 천연가스 및 다른 연료를 수증기와 함께 반응시켜 얻는 일산화 탄소를 포함하는 혼합물을 일컫는다.
일산화탄소는 고체 산화물 전해 전지에서 이산화탄소를 고온 전기 분해하여 얻을 수도 있고,
2 CO₂ → 2 CO + O₂
금속 산화물 광석을 탄소로 환원시킬 때 부산물로 얻을 수도 있다.
MO + C → M + CO
한편, 제한된 산소나 공기 중에서 탄소의 직접 산화를 통하여 생산할 수 있다.
2 C(s) + O₂ → 2 CO(g)
이때 일산화탄소가 기체이므로 환원 과정은 가열을 통해 반응의 엔트로피를 유리하게 하여 진행할 수 있다. 실제로 고온에서는 일산화탄소 생성이 이산화탄소의 생성보다 선호된다고 알려져 있다.
실험적 생산[편집]
실험실에서는 폼산이나 옥살산을 진한 황산으로 탈수시켜 일산화 탄소를 편리하게 얻을 수 있다.
CH₂O₂(폼산) + H₂SO₄(촉매) → CO + H₂O + H₂SO₄(촉매)
또 다른 방법으로 아연 금속과 탄산 칼슘 분말을 곱게 갈아 가열하면 일산화 탄소가 방출되면서 산화 아연과 산화 칼슘이 남는다.
Zn + CaCO₃ → ZnO + CaO + CO
질산은과 아이오도폼의 반응에서도 일산화 탄소가 얻어진다.
CHI₃ + 3AgNO₃ + H₂O → 3HNO₃ + 3AgI + CO
또한, 금속 옥살레이트를 가열하여도 CO가 발생한다.
Na₂C₂O₄ → Na₂CO₃ + CO
용도[편집]
- 화학 산업
일산화탄소는 산업용으로 대량의 화학 약품을 만드는 데 쓰인다. 알켄(alkene), 일산화 탄소, 수소의 하이드로포밀레이션(hydroformylation) 반응에서 알데하이드를 대량으로 제조할 수 있다. 하이드로포밀레이션과 고도 올레핀 공정(higher olefin process)을 접목하여 세탁용 세제의 전구체를 만들 수도 있다.
아이소사이아네이트(isocyanate), 폴리카보네이트, 폴리우레탄을 만드는 데 유용한 포스진(phosgene)도 순도 높은 일산화 탄소와 염소 기체를 다공성 활성탄 촉매에 통과시켜 제조한다.
CO + Cl₂ → COCl₂
메탄올은 일산화 탄소의 수소화 반응으로부터 생산한다. 일산화탄소의 수소화 반응을 탄소-탄소 결합 형성 반응과 연계하면 피셔-트롭슈(Fischer-Tropsch) 공정과 같이 액체 탄화수소 연료를 얻을 수 있다. 이 기술을 이용하면 석탄이나 바이오매스(biomass)를 디젤로 변환할 수 있다.
몬산토(Monsanto) 공정에서 일산화탄소와 메탄올을 로듐 균일 촉매와 아이오딘화 수소산 존재 하에서 반응시키면 아세트산을 얻을 수 있다. 아세트산의 산업용 생산의 대부분은 이 공정을 통하여 이루어진다.
한편, 황 촉매 하에서 불순한 니켈과 순수한 일산화 탄소의 반응으로 얻은 니켈 카르보닐(Ni(CO)₄) 화합물을 고온에서 열분해시키는 몬트(Mond) 공정을 이용하여 금속 니켈을 정제하기도 한다.
- 육류 색소
일산화탄소는 육류나 어류의 포장에 사용된다. 일산화탄소가 미오글로빈과 결합하여 카복시미오글로빈이 생성되면 밝은 체리 색 염료가 되는데, 이는 미오글로빈의 산화된 형태인 옥소미오글로빈(oxomyoglobin)보다 더 안정하다. 하지만 더 산화되면 갈색의 메트미오글로빈(metmyoglobin)으로 변한다. 일산화탄소를 사용한 체리 색 발현이 육류의 부패를 가릴 수 있어 논란의 여지가 있으므로, 일본, 싱가포르, 유럽 연합 등은 육류 포장에 일산화 탄소 사용을 금지하고 있다.
- 의약품
1993년에 일산화탄소가 정상적인 신경전달자(neurotransmitter)라는 첫 보고서가 나왔고, 세포 조직에서 일산화 탄소, 아산화 질소 그리고 황화 수소는 항염증, 혈관 확장, 새 혈관 성장 촉진 등의 기능을 할 수 있다고 알려졌다. 이를 근거로 일산화탄소를 약으로 사용하려는 임상 적용이 진행 중이지만, 과량의 일산화탄소는 중독을 유발하므로 주의가 필요하다.
- 야금 및 레이저
일산화탄소는 강력한 환원제이므로 고대부터 원광으로부터 금속을 환원시킬 때 사용했다. 고온에서 일산화탄소가 금속 산화물의 산소를 빼앗아 이산화탄소가 되면서 금속을 환원시킨다. 이때, 반응로에 일산화탄소를 기체 형태로 공급하는 것이 아니라, 산화 원광과 코크스와 같은 탄소 소재를 함께 가열하여 일산화 탄소를 즉석에서 생산하여 반응에 쓴다. 용광로 공정이 일산화탄소에 의한 금속 환원의 대표적 공정이다. 일산화탄소는 고전압 적외선 레이저에서 레이저 발생 매체로도 사용되고 있다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원