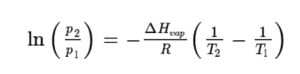증발
증발(蒸發, Evaporation)은 액체의 표면에서 분자간 인력을 끊을 수 있는 입자가 분자간 인력을 끊고 기화하는 현상이다. 정상 상태의 액체 내부에서는 일어나지 않는다. 액체에 열에너지가 투입되어 기화온도까지 올라갈 때 액체의 표면에서 기화현상이 일어나는 것을 의미한다. 기화의 다른 현상으로 액체 내부에서도 기화현상이 일어나는 것을 끓음이라고 한다. 액체 내부에서는 모든 방향으로 분자간 인력이 작용하지만, 액체 표면에서는 절반의 반향만 분자 간 인력이 작용한다. 따라서 적은 에너지에도 기화가 일어난다. 그러므로 끓음은 기화온도에 도달하였을 때 발생하지만, 증발은 그보다 낮은 온도에서부터 발생한다. 표면에서 발생하기 때문에 액체의 표면이 넓을수록 증발하는 양이 많아진다. 물의 증발은 0°이다.
개요
증발은 끓는점 미만의 온도에서 액체 표면의 원자나 분자가 기화하는 현상이다.
액체가 기체로 상전이 하는 방법은 크게 증발과 끓음으로 나눈다. 개별 액체 분자가 기화하기 위해서는 액체-액체 분자 사이의 결합 에너지를 극복할 만큼 충분히 큰 운동에너지(kinetic energy)가 있어야 한다. 끓는점에서 액체에 충분한 열에너지가 공급되어 표면 분자들 뿐만 아니라 표면 아래 액체 내부의 분자들도 기화하는 것을 끓음이라고 하고, 액체 표면의 분자들이 주위로부터 열에너지를 흡수하여 천천히 기화하는 것을 증발이라고 한다.
표면에 있는 분자들은 내부의 분자들에 비해 이웃한 액체 분자들이 적기 때문에 액체-액체 분자간의 잡아당기는 힘이 약하다. 따라서 표면의 분자들은 기체가 되는데 필요한 에너지가 액체 내부의 분자들에 비해 작다. 그러므로 표면의 액체 분자들은 끓는점 이하에서도 주위로부터 열에너지를 흡수하여 천천히 기화할 수 있다. 액체-기체 계면에서 반대의 과정, 즉 운동 에너지가 낮은 기체 분자들이 액체로 액화되는 현상도 같이 일어나지만, 습도가 100% (포화상태) 이하이면 액체가 기체로 바뀌는 증발 속도가 더 빠르다. 이러한 증발(기화) 과정과 액화 과정의 반복으로 미시적으로 분자 수준에서 보면 표면 위 몇 개의 분자층은 액체와 기체 상태가 구별되지 않는 크누센 층(Knudsen layer)이 된다.
증발 과정에서 운동에너지가 높은 분자들이 액체에서 기체로 변하기 때문에, 남은 분자들의 평균 에너지는 낮아지고, 이에 따라 액체의 온도가 낮아진다. 땀이 증발할 때 체온이 내려가는 것은 이 때문이다. 증발되는 액체 때문에 잃는 운동에너지가 공기로부터 액체에 공급되는 열 에너지와 같아질 때까지 증발에 의한 냉각은 계속된다.
닫힌 계에서 증발이 일어나면, 기화된 분자는 액체 위에 증기(vapor)로 축적된다. 이렇게 축적된 증기의 밀도와 압력이 높아짐에 따라 증발된 분자 중 다시 액체로 액화되는 분자의 수도 증가한다. 이렇게 증발(기화)되는 분자의 수와 다시 액화되는 분자의 수가 평형(equilibrium)을 이루면, 증기 압력과 밀도, 그리고 액체의 온도도 변하지않는다. 이 상태를 포화 상태(saturation)라고 하며, 닫힌 계에서는 공기가 포화될 때까지 증발이 일어난다. 순수한 물질의 경우, 증기-액체 평형 상태는 증기압(vapor pressure)에 의해 결정되며, 증기압은 클라우지우스-클라페롱(Clausius-Clapeyron) 관계를 따른다.
여기서 p1, p2 는 각각 온도 T1, T2 에서의 증기압이고, ΔHvap 는 증발열(heat of evaporation), R 는 기체상수(universal gas constant)이다. 열린 계에서의 증발 속도는 닫힌 계에서의 증기압에 의해 결정된다. 액체에 충분히 큰 열에너지가 공급되어 증기압이 주변압력과 같아지면 액체가 끓는다.
증발 속도는 온도, 압력, 밀도, 표면적 등에 의해 결정된다. 물이 대기 중으로 증발되는 경우를 예를 들어 보자. 물 분자의 운동에너지는 온도에 따라 증가하므로, 높은 온도에서 증발률이 더 높다. 압력은 물 분자들이 대기 중으로 나오지 못하도록 가하는 힘으로 작용하므로, 압력이 낮을수록 증발률이 더 높다. 대기가 품을 수 있는 수증기의 양은 한정되어 있으므로 수증기의 밀도(즉, 습도)가 낮으면 증발률이 더 높다. 물의 표면적이 넓으면 상대적으로 표면 분자의 비율이 높으므로 증발률이 더 높다. 또한 공기의 흐름(flow rate)이 크다면, 예를 들어 바람이 많이 부는 경우, 액체 바로 위쪽에 축적된 수증기가 건조한 공기로 빨리 대체될 수 있으므로 증발률이 더 높다. 온도가 높고 건조하고 바람이 많이 부는 날 빨래가 빨리 마르는 것이 이 때문이다.
나프탈렌 등과 같은 물질에서 가끔 고체 상태에서 기체 상태로 증발이 되기도 하는데, 이를 승화(sublimation)라고 한다.
포화증기압
액체가 담긴 용기가 폐쇄공간에 있을 때는 갇힌 기체 분자수가 늘어날수록 액체 표면과 충돌해서 액체 상태로 되돌아가는 확률이 점점 높아지고 따라서 증발과 액화가 같은 속도로 일어나는 일정한 평형상태에 도달하게 된다. 이 평형 상태에서의 증기 압력을 포화증기압 또는 증기압(vapor pressure)이라 하며 이것은 액체가 증발되는 정도를 나타낸다. 증기압이 큰 물질은 잘 증발되며 증기압이 큰 물질을 일반적으로 휘발성 물질이라 한다. 20℃에서 휘발성이 약한 물의 포화증기압은 18mmHg이지만 휘발성이 큰 다이에틸 에테르와 같은 물질은 442mmHg의 증기압을 나타내 큰 차이를 보인다.
또한 증기압은 온도에 따라 달라진다. 온도가 증가할수록 증기압도 증가한다. 더운 날 물이 더 빨리 증발하는 이유가 바로 높아진 온도로 인해 물의 증기압이 높아졌기 때문이다.
증발량
증발량은 강이나 바다의 존재 여부, 에너지(주로 태양복사)의 크기, 대기가 수분을 수용하는 능력(주로 풍속에 관계된다) 등에 의해 달라진다. 토양·수면·설면(雪面) 등 지표에서 증발이 이루어지려면 많은 양의 에너지가 필요하므로 증발이 지구대기 에너지 순환에 미치는 역할은 매우 크다.
또 물 지표 부근의 순환과정에서도 증발은 중요하다. 자연상태의 증발량을 직접적으로 측정하는 일은 어렵다. 간접적으로 측정하는 경우는 그 장소에서 유출하는 유량(流量)을 우량(雨量)에서 빼면 구할 수 있다. 그러나 이 경우, 장기간에 걸쳐 토양의 보수능력(保水能力)의 평균값을 정하여 그 능력이 일정하다고 가정하는 것이므로 반드시 정확한 것은 아니다. 간접측정을 위하여 여러 실험식을 사용하는데, 비교적 많이 사용하는 것은 손스웨이트-홀츠만의 공식이다.
밀폐된 용기에 물을 담아 놓으면 초기에는 물의 양이 줄어들지만 시간이 지난 후에는 물의 양이 일정하게 유지된다. 이는 밀폐된 용기 안에서 증발량과 응축량이 같아져 동적 평형 상태를 이루기 때문이다.
참고자료
같이 보기

 위키원
위키원