규산염
규산염(硅酸鹽, Silicate)은 조암 광물 중 가장 많은 양을 차지하는 광물로 규소와 산소 및 약간의 금속 원소로 이루어져 있다. 일반적으로 녹는점이 높으며, 녹은 것이 냉각할 때 유리로 되기 쉽다. 정장석, 흑운모, 석영 등을 포함하며 유리, 도자기, 내화물의 원료로 쓰인다. 해수에서는 영양염류로 인산염이나 질산염에 비해 많은 양으로 분포한다.
목차
개요[편집]
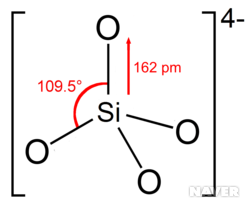
규소와 산소로 이루어진 규산염은 일반적 화학식은 [SiO₄₋ ₓ⁽ ⁴⁻²x⁾⁻]n (0 ≤ x < 2)이며, x 혹은 n 값에 따라 그 종류는 매우 다양하다. 음이온으로서 오쏘규산( SiO₄⁴⁻ (x = 0)), 메타규산(SiO₃²⁻ (x = 1)), 파이로규산(Si₂O₇⁶⁻ (x = 0.5, n = 2)) 등이 대표적인 예이다.
규산 음이온은 사슬, 고리, 이중사슬, 판(sheet) 등 다양한 구조를 가진 거대 고분자이다. 지질학이나 천문학에서 규산염은 규산 이온성 고체를 비롯하여 이러한 성분을 가진 암석을 말하며 그러한 의미에서 실리카(silica)나 석영(quartz)과 같은 이산화 규소(SiO₂, x=2)도 포괄한다. 또한 규산염이라는 용어는 알루미노규산염과 같이 알루미늄이나 원자가 전자가 4개인 다른 원자가 몇몇 규소 원자를 대체하여 있는 경우에도 쓰인다.
제조, 기술, 예술 분야에서의 광범위한 수요에 맞춰, 천연에서 얻은 화강암(granite), 자갈(gravel), 석류석(garnet))은 포틀랜드 시멘트, 세라믹, 유리, 물유리(water glass, sodium silicate) 등의 재료로 주목받고 있다.
규산 음이온(silicate)은 산소와 결합하지 않고 다른 원소와 결합한 헥사플루오린화규산 음이온([SiF₆]²⁻)까지 포함하여 그 정의를 넓히기도 한다.
성질[편집]
일반적으로 녹는점이 상당히 높고, 용해한 것은 냉각 때 유리를 형성하기 쉽다. 물에 잘 안 녹는다(알칼리 금속염을 제외한다). 보통의 산 기타 많은 시약에 잘 안 녹는다. 그러나 플루오르화수소에 의해서는 분해되어 플루오르화규소를 만들고, 또 수산화알칼리 또는 탄산알칼리와 용해하면 물에 가용성인 규산알칼리를 만든다. 규산알칼리는 예외적으로 물에 녹고, 산에 의해 분해되어 이산화규소 수화물(규산)을 만든다.
규산염 구조의 원리[편집]
꼭짓점을 공유하는 사면체 모형[편집]
우리가 알고 있는 대부분의 규산염은 규소가 사면체 중심에 위치하고, 꼭짓점에는 산소가 존재하며, 이들이 여덟 전자 규칙에 맞게 단일 공유결합으로 연결되어 있다.
이들 사면체는 하나의 온전한 형태인 오쏘규산 음이온(SiO₄⁴⁻)으로 존재하기도 하고, 두 개 이상의 규소 원자가 산소와 다양한 방법으로 연결되어 단순한 파이로규산 음이온(Si₂O₇⁶⁻ ) 혹은 메타규산 고리 육합체(metasilicate ring hexamer, Si₆O₁₈¹²⁻)와 같은 복잡한 음이온 형태로 있다.
일반적으로 음전하를 띠지 않는 산소 원자는 두 규소 원자 사이에서 다리 역할을 한다.. 이러한 음이온의 구조는 흔히 규소를 중심에 둔 사면체가 산소 원자 꼭짓점 하나당 2개씩 연결되어 있다.
이처럼 사면체형을 기반으로 하는 규산염과 유사한 구조를 가진 물질로 인(P)와 산소(O)로 구성된 인산염이 있다. 예를 들어, 인산 음이온(PO₄³⁻), 메타인산 음이온((PO₃)n), 파이로인산 음이온(P₂O₇⁴⁻) 등은 각각 규산과 등전자성인 음이온으로 존재한다.
사면체가 아닌 규산염[편집]
사면체가 규소 화합물의 일반적 구조이지만, 규소가 더 큰 배위수를 갖기도 한다. 예를 들어, [SiF₆]²⁻의 경우, 규소 원자는 팔면체 배열에서 6개의 플루오린 원자에 의해 둘러 싸여 있다. 시멘트나 콘크리트가 화학적 공격을 받아 인공적으로 형성되는 규회석고(thaumasite)에서 발견되는 육수산화규산 음이온에서도 팔면체 구조가 발견된다.
매우 높은 압력에서 운석 충돌에 의해 형성된 규산염 광물의 다형체 중의 하나인 스티쇼바이트(stishovite)에서는 SiO₂가 6-배위 팔면체 구조를 형성하기도 한다.
규산염의 화학적 성질[편집]
규산염 고체는 일반적으로 안정하고 알칼리 금속 양이온을 가졌거나 오쏘규산염, 메타규산염, 또는 사슬 모양의 음이온 규산염은 물에 잘 녹는다. 이들은 용액으로부터 결정화할 때 여러 고체 수화물을 형성한다. 물유리라고 알려진 수용성 규산 소듐과 그 혼합물은 중요한 산업 및 가정용 화학물질이다. 알칼리 금속이 아닌 양이온이나 판 형태 또는 3차원의 고분자 규산 음이온이 있는 규산염은 일반 조건에서 물에 거의 녹지 않는다.
규산 음이온의 반응[편집]
규산 음이온은 Si-O-H 작용기를 가진 화합물의 짝염기이다. 예를 들어, 오쏘규산 음이온은 오쏘규산(Si(OH)₄)에서 4개의 H+가 모두 해리된 형태이다. 규산은 일반적으로 약산이며 분리할 수 있다. 수용액에서 이들은 축합반응으로 부분 해리된 음이온 혼합물과 동적 평형 상태에 있다. 이 평형은 가수분해와 축합 반응 그리고 양성자화와 탈양성자화 반응의 동적 평형으로 구성된다.
- ≡Si–O–Si≡ + H₂O ⇌ ≡Si–OH + HO–Si≡
- ≡Si–OH ⇌ ≡Si–O− + H+ .
위의 평형에서 규산 음이온의 농도가 증가하거나 용액의 산성도가 커지면 평형은 더 큰 음이온을 형성하는 쪽으로 이동한다. 예를 들어, 오쏘규산 음이온은 바닷물에 자연적으로 녹아 있는 실리카(silica)로서 농도는 100 ppm 이하이며 pH 12 이상 과량의 수산화 소듐 수용액에 녹아 있는 실리카가 주로 취하고 있는 형태이다. 이 기준보다 농도가 더 높거나 pH가 낮은 경우에 평형은 고분자 음이온 형태를 더 선호한다.
극단적으로 규산 음이온은 규산으로 변환될 수 있는데, 이때 Si-O-Si 연결로 이어진 SiO₄사면체들로 구성된 3차원 그물 형태가 된다. 연관된 축합 과정은 테트라에틸규산염의 솔-젤 공정에서도 볼 수 있다.
규산염의 감지(detection)[편집]
용액 중의 규산 음이온은 몰리브데넘산 음이온과 반응하여 노란색의 규소화몰리브데넘산(silicomolybdate) 착물을 형성한다. 이때, 오쏘규산 음이온은 75초 그리고 이합체 파이로규산 음이온은 10분 반응 시켜 그 결과로서 확인한다. 더 큰 올리고머의 경우에는 반응하는 데 상당히 긴 시간이 필요하다. 더욱이 콜로이드 형태의 실리카 현탁액은 반응하지 않는다.
제올라이트(zeolite) 형성[편집]
수용성 규산염은 산업용 촉매로 유용하며 제올라이트로 알려진 알루미노규산염의 합성에 유용하다.
규산염 광물의 구조에 따른 분류[편집]
1. 독립사면체구조 : [SiO₄]⁴⁻가 단독으로 존재하는 경우이며 오쏘규산염(orthosilicate)이라고 한다. 감람석 (Me·Fe)₂SiO4 등이 그 예이다. 독립사면체 구조의 규산염광물은 경도가 높고 쪼개짐이 발달하지 않아서 연마를 하거나 광택을 낼 때 연마재로 사용되기도 한다.
2. 6각 환형구조 : [SiO₄]⁴⁻가 연결되어 고리 모양을 이룬 경우이며, 녹주석 Be₃Al₂Si₆O₁₈, 전기석, 근청석 등이 여기에 해당한다. 쪼개짐은 단일면으로 쪼개진다.
3. 단일 사슬 구조 : 길다란 사슬 형태의 음이온을 포함하는 규산염광물로 단일 사슬 형태를 이루고 있는 구조이다. 단일사슬구조는 각 사면체가 두 개의 산소를 공유한 사슬형태로 이루어져 있는데 90도를 이루는 두 면으로 쪼개진다는 특징이 있다. 대표적인 예로 휘석 CaMg(SiO₃)₂, 투휘석, 규회석 등이 있다.
4. 이중 사슬 구조 : 단일 사슬 구조에 해당하는 사슬이 두 개의 사슬 형태로 이루어진 구조로서 절반의 사면체는 두 개의 산소를 서로 공유하고 나머지 절반은 세 개의 산소를 공유함으로써 음이온은 (Si4O₁₁)⁶ⁿ⁻의 화학식을 이룬다. 대표적인 예로 각섬석Ca₂Mg₅(Si₄O₁₁)(OH)₂이 있다. 이중 사슬 구조의 경우 쪼개짐은 120도의 각을 이루는 두 면으로서 휘석과 각섬석을 구분할 때에는 이처럼 쪼개짐면의 각도가 다른 점을 이용하여 구분할 수 있다.
5. 층상 구조 : 규산염사면체가 2차원으로 무한히 펼쳐진 구조이다. 층을 이루는 각 판들은 각 사면체들의 3개의 산소가 주위의 사면체들과 공유된다. 따라서 각 사면체를 구성하는 산소들 중 하나는 전자 한 개가 채워지지 않게 된다. 이 산소는 Al³⁺, Mg²⁺, Fe²⁺ 와 결합함으로써 중합체화한 층들을 연결하고 있다. 중합체화된 층의 Si-O 결합은 다른 양이온과 산소의 결합보다 강하므로, 층의 방향으로 쪼개짐이 발달한다. 대표적인 예로 백운모, 흑운모, 카올리나이트 등이 있다.
6. 3차원 망상구조 : 규산염사면체가 3차원으로 퍼져 그물구조를 이룬 구조이다. 대표적인 예로 석영과 장석이 있으며, 석영의 경우 결정형은 육각기둥 모양이고 깨지는 특징이 있다. 장석은 두꺼운 판 모양의 결정형을 갖고 있으며, 2방향으로 쪼개지는 성질이 있다.
용도[편집]
요업(窯業)에 있어서는 규산염의 성질이 여러 가지 이용되고 있다. 녹는점이 높은 성질은 내화물에, 유리 형성의 성질은 유리 제조에, 또 점토 광물의 성질은 각종 성형 조작에, 그외 특성을 가진 규산염을 공업적으로 합성 이용하고 있다.
규산염의 발명 동기는 미국방성에서 야전군 수통의 물이 상하지 않게 하고 인체에 더 좋은 상태로 보존될 수 있는 방법 및 전시 장비를 습기로부터 보호하는(INHIBITOR) 부식억제 작용의 방법으로 개발하는 데서 시작되었다.
지금도 미군들이 수통 속에 조그마한 무색, 무취의 덩어리가 한 개씩 들어있는데 이것이 바로 미국의 정책지원 사업으로 최초 개발한 규산염(Aqua Cria) 덩어리이다.
한국에서는 세계 4번째로 미국, 독일, 일본에 이어 국내 최초로 개발되었으며, 이러한 원료는 규석(Silicate) 즉 차돌을 화학적인 작용에 의해 자정능력을 가진 성분으로 동, 식물에 이로운 원적외선을 가장 풍부하게 가지고 있는 물질이다.
규석은 지구상 만물 중에 가중 순수한 물질이며, Silicate 사면체 성능으로 많은 산소 발생과 태양에너지 즉, 광합성 에너지를 받아서 잠재열을 확산시키는 신비한 기능을 가진 물질이다. 한국에는 가장 순도가 높은 99.9%의 규석이 많이 내장되어 있으며, 미국 NASA에서도 각 분야의 우수한 재료로 인정하고 있다. 이러한 규석을 원자재로 1650℃ 고열로 장시간 가열하여 용융시킨 후 서냉과정을 통해 수용성 물질로 치환하여 제조하여 만든 제품들은 하나같이 친환경 제품들이며 오염된 모든 물질을 본래의 순수성으로 되돌려 주는 기능을 가지고 있다. 그 예로 남한강 물은 자정능력이 좋기로 유명한데 그 이유는 남한강 유역에 순도 높은 규석광이 무제한 존재하기 때문이다. 또한 규사(일명 차돌모래 또는 금모래)가 많은 냇물에 물이 맑은 이유도 바로 규사가 갖는 자정능력 때문이다.
우리 조상들이 전하는 말에 "냇가에서 빨래돌은 차돌바위를 골라 해라"라고 했다. 차돌에는 이끼가 끼지 않아 즉 차돌은 원래 알칼리성 성분으로 물을 맑게 하는 신비로운 능력을 가지고 있다. 이러한 자연적 섭리를 우리 실생활에 매체 시킨 결과가 규산염이고 규산염 방청제는 그중에 한 제품이다.
동영상[편집]
참고자료[편집]
같이 보기[편집]

 위키원
위키원