"원자번호"의 두 판 사이의 차이
(새 문서: '''원자번호'''(原子番號, atomic number)란 주기율표(periodic table)에서 각 원소마다 주어진 원소 고유의 순번으로 원자 번호 1번 수소(Hydrogen,...) |
잔글 |
||
| 1번째 줄: | 1번째 줄: | ||
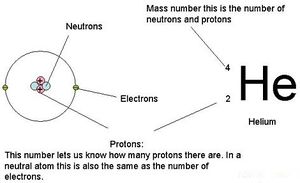
| − | '''원자번호'''(原子番號, atomic number)란 [[주기율표]](periodic table)에서 각 | + | '''원자번호'''(原子番號, atomic number)란 [[주기율표]](periodic table)에서 각 [[원소]]마다 주어진 원소 고유의 순번이다. 원자 번호 1번 [[수소]](Hydrogen, H), 2번 [[헬륨]](Helium, He), 3번 [[리튬]](Lithium, Li)부터 117번 [[테네신]](Tennessine, Ts), 118번 [[오가네손]](Oganesson, Og)에 이른다. 원자 번호는 주어진 원자의 원자핵 내 양성자 수('''''Z''''')와 같으며 원자는 전기적으로 중성이므로 원자가 갖는 전자의 수와도 정확히 일치한다. 원자의 원자 번호('''''Z''''')와 중성자의 수('''''N''''')를 알면 해당 원자의 질량수('''''A''''')를 알 수 있으며, 이때 질량수 '''''A''''' = 원자 번호 '''''Z''''' + 중성자 수 '''''N'''''이다. 원소의 기원을 이해하는데 있어 원자량보다 원자 번호가 기본이 되는데, 실제로 어떤 원소의 원자량은 정수보다 약간 크고, 또 어떤 원소의 경우 정수보다 약간 작다(즉, 원자량은 정수가 아니다). 이는 원소가 생성되는 핵융합 과정(수소 2개와 중성자 2개 융합을 통해 4He → C → O →Ne → Mg ... → Fe)에서 질량 일부가 에너지로 바뀌기 때문으로 주기율표상에서 수소에서 철로 가면서 원자량 값은 약간 크다가 점점 정수 이하로 내려가고 핵이 가장 안정한 철을 지나서는 정수로 다시 접근한다. [[동위원소]](isotope)는 원자핵 내 양성자의 수는 같지만 중성자의 수가 달라 질량수가 다른 원소 사이의 관계를 나타내며, 동위원소는 서로 양성자의 수가 같고 원자 번호는 양성자의 수로 결정되므로 동위원소는 서로 같은 원자 번호를 갖는다. |
== 개요 == | == 개요 == | ||
2024년 11월 5일 (화) 00:06 판
원자번호(原子番號, atomic number)란 주기율표(periodic table)에서 각 원소마다 주어진 원소 고유의 순번이다. 원자 번호 1번 수소(Hydrogen, H), 2번 헬륨(Helium, He), 3번 리튬(Lithium, Li)부터 117번 테네신(Tennessine, Ts), 118번 오가네손(Oganesson, Og)에 이른다. 원자 번호는 주어진 원자의 원자핵 내 양성자 수(Z)와 같으며 원자는 전기적으로 중성이므로 원자가 갖는 전자의 수와도 정확히 일치한다. 원자의 원자 번호(Z)와 중성자의 수(N)를 알면 해당 원자의 질량수(A)를 알 수 있으며, 이때 질량수 A = 원자 번호 Z + 중성자 수 N이다. 원소의 기원을 이해하는데 있어 원자량보다 원자 번호가 기본이 되는데, 실제로 어떤 원소의 원자량은 정수보다 약간 크고, 또 어떤 원소의 경우 정수보다 약간 작다(즉, 원자량은 정수가 아니다). 이는 원소가 생성되는 핵융합 과정(수소 2개와 중성자 2개 융합을 통해 4He → C → O →Ne → Mg ... → Fe)에서 질량 일부가 에너지로 바뀌기 때문으로 주기율표상에서 수소에서 철로 가면서 원자량 값은 약간 크다가 점점 정수 이하로 내려가고 핵이 가장 안정한 철을 지나서는 정수로 다시 접근한다. 동위원소(isotope)는 원자핵 내 양성자의 수는 같지만 중성자의 수가 달라 질량수가 다른 원소 사이의 관계를 나타내며, 동위원소는 서로 양성자의 수가 같고 원자 번호는 양성자의 수로 결정되므로 동위원소는 서로 같은 원자 번호를 갖는다.
목차
개요
화학 원소의 원자 번호는 원자핵 속에 있는 양성자의 수 또는 원자핵의 전하수이다. 원자 번호는 원소를 구별하는 기준이다. 전하를 띠지 않는 원자의 원자 번호는 그 원자가 가진 전자의 수와 일치한다.
원자의 질량수 A는 원자 번호 Z와 중성자수 N의 합이다. 전자의 질량은 충분히 무시할 만하고, 양성자와 중성자는 거의 같은 질량을 가지고 핵자 결합의 질량 결손은 항상 핵자 질량보다 작기 때문에, 상대적인 동위원소 질량을 결정하는 원자 질량 단위로 나타내면 원자 질량은 전체 질량수 A의 1% 이내이다.
원자 번호 Z가 같지만 중성자수 N 이 다른, 즉 원자 질량이 다른 원자들을 동위 원소라고 한다. 적어도 4분의 3 이상의 천연 원소들이 동위원소의 혼합물로 존재하며(참고), 평균 원자량은 원소의 표준 원자량으로 정의됐다. 역사적으로 이는 19세기 화학자들이 측정할 수 있었던 원소(수소와 비교해서)의 원자량이었다.
기호 Z가 사용되며, 독일어로 숫자를 상징하는 Zahl에서 유래되었다. 원자 번호는 현대에 들어서 물리와 화학이 통합되기 전에는 당시 원자량에 따라 정리된 불완전한 주기율표에서 단순히 원소들의 숫자적인 위치를 나타낼 뿐이었다. 1915년이 되어서야 원자번호가 핵 전하이고 물리적인 특징이라는 주장과 근거가 나와 Atomzahl|원자 번호라는 단어가 쓰이게 되었다.
역사
주기율표와 각 원소의 자연수
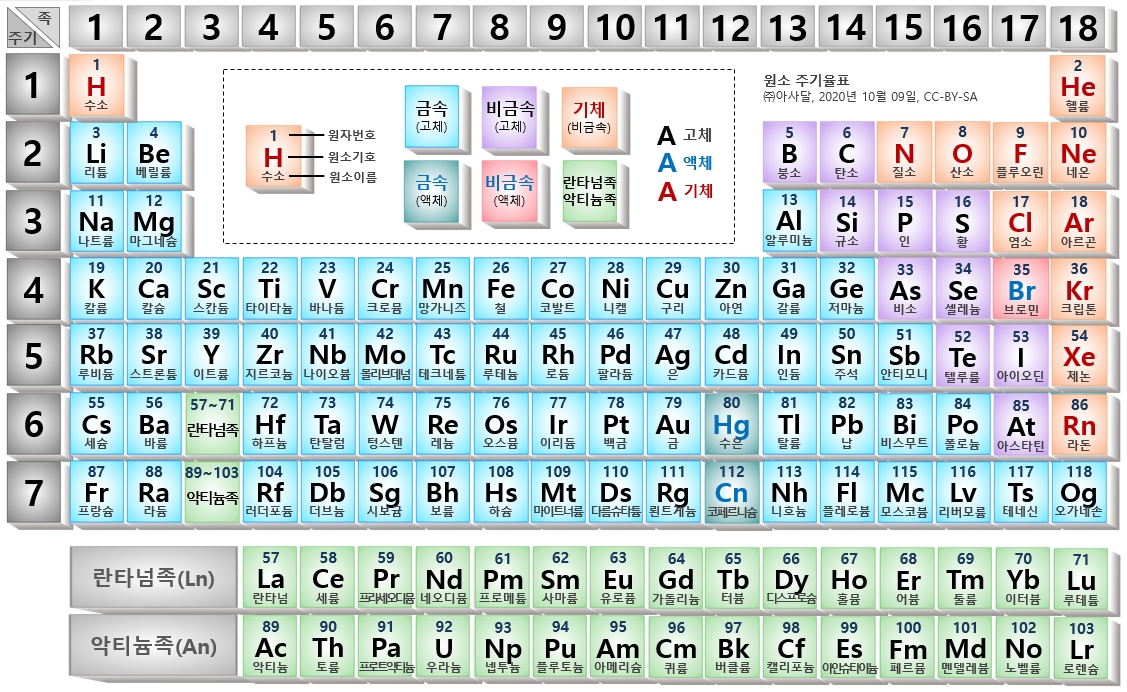
원자 번호에 따라 원소들을 나열한 표를 주기율표라고 부르며, 원소들의 주기성이 나타난다.
드미트리 멘델레예프는 처음에 원자량에 따라 원소들을 배열해 주기율표를 만들었다. 하지만, 원소의 화학적 특성들을 고려해서 그는 약간 순서를 바꿔 텔루륨(원자량 127.6)보다 아이오딘(원자량 126.9)을 먼저 배치했다. 이러한 배치는 양성자 수인 Z를 기준으로 하는 현재의 주기율표와 일치하지만 그 당시에는 이상한 부분이었다.
하지만 단순히 주기율표의 위치에 따라 번호를 매긴 것은 문제가 많았다. 아이오딘과 텔루륨의 경우를 제외하고는 아르곤과 포타슘, 코발트와 니켈 같은 다른 경우들은 후에 거의 같거나 순서가 뒤바뀐 원자량을 가진 것으로 밝혀졌고, 그래서 화학적 특성을 맞추기 위해 배열 순서를 변경해야 했다. 그러나 원자 번호가 명확하지 않은 화학적으로 유사한 란타넘 원소들이 점점 더 많이 발견되면서 루테튬(71) 후부터 원소를 주기적으로 번호 매기는 것은 불확실하고 모순적이었다. (하프늄은 그 당시 발견되지 않았다)
러더퍼드-보어 모형과 반 덴 브로에크(van den Broek)
1911년에 어니스트 러더퍼드는 중심핵이 원자 질량의 대부분을 차지하고, 전자의 전하 단위에서 수소 원자의 개수로 표현하면 원자 질량의 절반과 거의 같은 양전하가 중심핵에 밀집되어 있는 모형을 제시했다. 이 때 원자핵의 전하는 원자 질량의 약 절반이 된다. (비록 러더포드가 추측한 단일 금 원자는 1=Z = 79, 1=A = 197로 약 25%가 다르더라도 말이다.) 러더퍼드가 금의 원자핵이 약 100의 전하를 가진다(주기율표에서 금의 1=Z = 79이다)고 생각했음에도 불구하고, 러더퍼드의 논문이 나온 지 한 달 후에 어니스트 반 덴 브로에크는 중심핵의 전하와 원자 내 전자의 개수가 주기율표에서 원소의 위치, 즉 원자 번호(Z)와 정확히 같다고 공식적으로 최초로 주장했다. 그리고 이것은 끝내 입증되었다.
1913년 모즐리의 실험
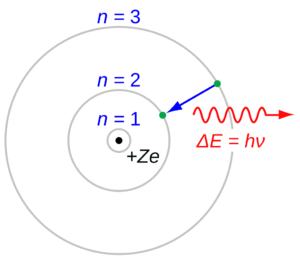
1913년, 헨리 모즐리는 이를 실험적으로 입증했다. 반 덴 브로에크의 가설을 통해 보어 원자 모형을 제시했고 마침 같은 실험실을 쓰고 있던 보어와 의논한 끝에, 모즐리는 들뜬 원자에서 방출하는 스펙트럼선을 관찰해서 보어 이론의 가정대로 스펙트럼선의 진동수와 원자 번호(Z)가 비례하는지를 확인함으로써 반 덴 브로에크의 가설과 보어의 가설을 실험적으로 직접 증명해 보고자 했다.
이를 위해 모즐리는 X선 관에서 이동시킬 수 있는 양극 표적인 알루미늄(Z = 13)부터 금(Z = 79)까지의 원자가 방출하는 가장 안쪽 껍질(K과 L) 전자의 파장을 측정했다. 이러한 전자들(X선)의 진동수의 제곱근은 등차수열을 이루었다. 이를 통해 모즐리는 원자 번호와 계산된 원자핵의 전하, 즉 Z가 일치한다고 결론지었고, 이를 모즐리의 법칙이라고 한다. 거기에 모즐리는 당시 제대로 밝혀지지 않았던, 란타넘족 원소들이 15개(란타넘부터 루테튬까지)인 사실을 알아냈다.
미발견 원소들
모즐리가 1915년에 죽은 후에, 수소부터 우라늄(Z = 92)까지 그 당시 알려진 모든 원소들의 원자 번호가 모즐리의 방법을 통해 조사되었다. 그 결과 당시 발견되지 않은 원자 번호 43, 61, 72, 75, 85, 87, 91인 7개의 원소(Z < 92)가 확인되었다. 1918년부터 1947년까지, 이 미발견 원소 7개는 모두 발견되었다. 이때까지 4개의 초우라늄 원소들이 발견되어, 주기율표가 퀴륨(Z = 96)까지 빈틈없이 채워졌다.
전자와 원자핵 전하에 대한 견해
1915년, 원자핵 전하가 Z 배수로 양자화되는 이유는 현재는 원자 번호와 같기 때문인 것으로 밝혀졌지만 당시에는 이상한 부분이었다. 프라우트의 가설이라 불리는 오래된 견해는 모든 원소가, 가장 가벼운 원소이자 보어-러더퍼드 모형에서 단일 전자와 단일 전하를 가진 수소의 잔재물 또는 원질로 만들어졌다고 가정했다. 하지만 이미 1907년에 러더퍼드와 토마스 로이즈는 +2 전하를 가지는 α 입자가 질량이 수소의 2배가 아닌, 4배인 헬륨의 원자핵임을 보여주었다. 만약 프라우트의 가설이 맞다면, 일부는 더 무거운 원자의 핵에 존재하는 수소 원자핵의 일부 전하가 상쇄되어야 했다.
1917년에 러더퍼드는 α 입자와 질소 기체 사이에서의 핵반응을 통해 수소 원자핵들을 생성하는 데 성공했고, 자신이 프라우트의 법칙을 증명했다고 생각했다. 1920년 그는 생성된 핵 입자들을 양성자라고 명명했다. (이전에는 프라우트의 이름을 딴 프라우톤(prouton)이나 원질이라 불렀다) 모즐리의 연구를 통해 무거운 원자들의 원자핵들이 수소 원자핵들로 만들어진 그 원소들로부터 예측되는 질량보다 2배는 더 된다는 것이 확실해졌고, 따라서 모든 무거운 원자핵에 존재하는 추가적으로 예상되는 양성자들이 어떻게 상쇄되었는지에 대한 대한 가설이 필요했다. 헬륨 원자핵은 두 전하를 상쇄하기 위해 4 개의 양성자와 2개의 핵 전자(핵 내부에 결합되어 있는 전자)로 구성되어 있다고 생각하였다. 주기율표의 반대쪽 끝에서 수소 질량의 197배인 금 원자핵은 118개의 핵 전자를 가짐으로서 +79의 전하를 가져 원자 번호와 일치한다고 보았다.
중성자의 발견으로 양성자의 수가 된 Z
핵 전자를 둘러싼 수많은 논쟁들은 1932년 제임스 채드윅이 중성자를 발견하며 종결된다. 금 원자는 이제 118개의 핵 전자가 아닌 118개의 중성자를 가진 것으로 보고 있고, 양전하는 온전히 79개의 양성자로부터 발생하는 것으로 보고 있다. 따라서 1932년부터 원소의 원자번호 Z는 핵의 양성자 수와 같은 것으로 여기고 있다.
기호 Z
원자번호를 나타내는 기호인 Z는 독일어 단어인 Atomzahl(원자 번호)에서 유래된 것으로 보고 있다.하지만 1915년 이전에도 Zahl(숫자) 라는 단어가 주기율표에서 원소들의 할당 번호로 사용되었다.
화학적 특성
각각의 원소는 중성 원자에 존재하는 전자의 수, 즉 Z (원자 번호)에 따라 특정한 화학적 특성을 가진다. 전자 배치는 양자역학의 원리를 따른다. 각 원소의 전자껍질에 있는 전자들, 그중에서도 가장 바깥 껍질에 있는 최외각전자의 수는 화학 결합을 결정하는 중요한 요인이다. 따라서 원소의 화학적 특성을 결정하는 것은 원자 번호 뿐이다. 그러한 이유로 원소는 동일한 원자 번호를 가지는 원자들의 집합으로 정의내릴 수 있다.
새로운 원소
새로운 원소의 탐구는 원자번호를 통해 이루어진다. 2018년 기준으로, 1부터 118번까지의 원소가 모두 발견되었다. 새로운 원소의 합성은 중금속 표적 원자에 이온을 충돌시킴으로써 이루어지며, 표적 원소와 이온의 원자 번호의 합은 합성되는 원소의 원자 번호와 동일하다. 일반적으로 원자 번호가 증가하면 반감기는 짧아지지만, 특정한 수의 양성자와 중성자를 가진 미발견 동위원소에 대해서는 "안정성의 섬"이 존재할 수 있다.
목록
원자번호 기호 원소 영문 표기 원자량 녹는점 (m.p.) 1 H 수소(水素) Hydrogen 1.0079 -259.14℃ 2 He 헬륨 Helium 4.0026 -272.2℃(26atm) 3 Li 리튬 Lithium 6.94 180.54℃ 4 Be 베릴륨 Beryllium 9.01218 1280℃ 5 B 붕소(硼素) Boron 10.81 2300℃ 6 C 탄소(炭素) Carbon 12.011 3550℃(비결정성) 7 N 질소(窒素) Nitrogen 14.0067 -209.86℃ 8 O 산소(酸素) Oxygen 15.9994 -218.4℃ 9 F 플루오린(弗素) Fluorine 18.998 -219.62℃ 10 Ne 네온 Neon 20.17 -248.67℃ 11 Na 나트륨(소듐) Sodium 22.9898 97.90℃ 12 Mg 마그네슘 Magnesium 24.305 650℃ 13 Al 알루미늄 Aluminium 26.98154 660.4℃ 14 Si 규소(硅素) Silicon 28.085 1414℃ 15 P 인(燐) Phosphorus 30.973 44.1(황린) 16 S 황(黃) Sulfur 32.06 112.8℃(α) 17 Cl 염소(鹽素) Chlorine 35.45 -100.98℃ 18 Ar 아르곤 Argon 39.94 -189.2℃ 19 K 칼륨(포타슘) Potassium 39.0983 63.5℃ 20 Ca 칼슘 Calcium 40.08 850℃ 21 Sc 스칸듐 Scandium 44.9559 1539℃ 22 Ti 타이타늄(티타늄) Titanium 47.9 1675℃ 23 V 바나듐 Vanadium 50.9415 1910℃ 24 Cr 크로뮴(크롬) Chromium 51.996 1907℃ 25 Mn 망가니즈(망간) Manganese 54.938 1,962℃ 26 Fe 철(鐵) Iron 55.84 1538℃ 27 Co 코발트 Cobalt 58.9332 1494℃ 28 Ni 니켈 Nickel 58.7 1455℃ 29 Cu 구리(銅) Copper 63.549 1084.5℃ 30 Zn 아연(亞鉛) Zinc 65.38 419.6℃ 31 Ga 갈륨 Gallium 69.72 29.78℃ 32 Ge 저마늄(게르마늄) Germanium 72.59 958.5℃ 33 As 비소(砒素) Arsenic 74.9216 817℃(28atm) 34 Se 셀레늄 Selenium 78.96 144℃(결정) 35 Br 브로민(브롬) Bromine 79.904 -7.2℃ 36 Kr 크립톤 Krypton 83.3 -156.6℃ 37 Rb 루비듐 Rubidium 85.4678 38.89℃ 38 Sr 스트론튬 Strontium 87.62 769℃ 39 Y 이트륨 Yttrium 88.9059 1495℃ 40 Zr 지르코늄 Zirconium 91.22 1852℃ 41 Nb 나이오븀(니오븀) Niobium 92.9064 2468℃ 42 Mo 몰리브데넘]](몰리브덴) Molybdenum 95.94 2610℃ 43 Tc 테크네튬 Technetium 97 2200℃ 44 Ru 루테늄 Ruthenium 101.17 2250℃ 45 Rh 로듐 Rhodium 102.9055 1963℃ 46 Pd 팔라듐 Palladium 106.4 1555℃ 47 Ag 은(銀) Silver 107.868 961.9℃ 48 Cd 카드뮴 Cadmium 112.41 321.1℃ 49 In 인듐 Indium 114.82 156.63℃ 50 Sn 주석(朱錫) Tin 118.69 231.97℃ 51 Sb 안티모니(안티몬) Antimony 121.75 630.7℃ 52 Te 텔루륨(텔루르) Tellurium 127.6 449.8℃ 53 I 아이오딘(요오드) Iodine 126.904 113.6℃ 54 Xe 제논(크세논) Xenon 131.3 -111.9℃ 55 Cs 세슘 Cesium 132.9054 28.5℃ 56 Ba 바륨 Barium 137.33 725℃ 57 La 란타넘(란탄) Lanthanum 138.9055 920℃ 58 Ce 세륨 Cerium 140.12 795℃ 59 Pr 프라세오디뮴 Praseodymium 140.9077 935℃ 60 Nd 네오디뮴 Neodymium 144.24 1024℃ 61 Pm 프로메튬 Promethium 147 1080℃ 62 Sm 사마륨 Samarium 150.4 1072℃ 63 Eu 유로퓸 Europium 151.96 826℃ 64 Gd 가돌리늄 Gadolinium 157.2 1312℃ 65 Tb 터븀(테르븀) Terbium 158.9254 1356℃ 66 Dy 디스프로슘 Dysprosium 162.5 1407℃ 67 Ho 홀뮴 Holmium 164.93 1461℃ 68 Er 어븀(에르븀) Erbium 167.26 1522℃ 69 Tm 툴륨 Thulium 168.9342 1545℃ 70 Yb 이터븀(이테르븀) Ytterbium 173.04 824℃ 71 Lu 루테튬 Lutetium 174.97 1652℃ 72 Hf 하프늄 Hafnium 178.49 2150℃ 73 Ta 탄탈럼(탄탈) Tantalum 180.947 2996℃ 74 W 텅스텐 Tungsten 183.8 3387℃ 75 Re 레늄 Rhenium 186.207 3180℃ 76 Os 오스뮴 Osmium 190.2 2700℃ 77 Ir 이리듐 Iridium 192.2 2447℃ 78 Pt 백금(白金) Platinum 195.09 1772℃ 79 Au 금(金) Gold 196.9665 1064℃ 80 Hg 수은(水銀) Mercury 200.59 -38.86℃ 81 Tl 탈륨 Thallium 204.3 302.5℃ 82 Pb 납 Lead 207.2 327.5℃ 83 Bi 비스무트 Bismuth 208.9804 271.44℃ 84 Po 폴로늄 Polonium 209 254℃ 85 At 아스타틴 Astatine 210 336.8℃ 86 Rn 라돈 Radon 222 -71℃ 87 Fr 프랑슘 Francium 223 27℃ 88 Ra 라듐 Radium 226.03 700℃ 89 Ac 악티늄 Actinium 227.03 1050℃ 90 Th 토륨 Thorium 232.0381 ~1800℃ 91 Pa 프로트악티늄(프로탁티늄) Protactinium 231.0359 1230℃ 92 U 우라늄 Uranium 238.029 1133℃ 93 Np 넵투늄 Neptunium 237.0482 640℃ 94 Pu 플루토늄 Plutonium 244 639.5℃ 95 Am 아메리슘 Americium 243 1176℃ 96 Cm 퀴륨 Curium 247 1340℃ 97 Bk 버클륨 Berkelium 247 986℃(β) 98 Cf 캘리포늄(칼리포르늄) Californium 251 900℃ 99 Es 아인슈타이늄 Einsteinium 252 860℃ 100 Fm 페르뮴 Fermium 257 1527℃ 101 Md 멘델레븀 Mendelevium 258 827℃ 102 No 노벨륨 Nobelium 259 827℃ 103 Lr 로렌슘 Lawrencium 266 1627℃ 104 Rf 러더포듐 Rutherfordium 267 2100℃ 105 Db 더브늄 Dubnium 268 106 Sg 시보귬 Seaborgium 269 107 Bh 보륨 Bohrium 270 108 Hs 하슘 Hassium 277 109 Mt 마이트너륨 Meitnerium 278 110 Ds 다름슈타튬 Darmstadtium 281 111 Rg 뢴트게늄 Roentgenium 282 112 Cn 코페르니슘 Copernicium 285 10 ± 11 °C 113 Nh 니호늄 Nihonium 286 114 Fl 플레로븀 Flerovium 289 −73 °C 115 Mc 모스코븀 Moscovium 290 430 °C 116 Lv 리버모륨 Livermorium 293 440 °C 117 Ts 테네신 Tennessine 294 450 °C 118 Og 오가네손 Oganesson 294 52 ± 15 °C
참고자료
- 파일:2020-10-09 원소 주기율표 (서창녕).pdf
- 〈원자 번호〉, 《위키백과》
- 〈원자 번호〉, 《화학백과》
- 〈번호〉, 《나무위키》
같이 보기

 위키원
위키원