유전자가위
유전자가위(gene scissor)는 특정 염기서열을 인지하여 해당 부위의 DNA를 절단하는 제한효소로서, 인간 세포와 동식물 세포의 유전자를 교정하는 데 사용된다.
유전체(게놈)에서 특정한 유전자 염기서열을 인지하여 해당 부위의 DNA를 절단하는 인공 제한효소(restriction endonuclease)로서 인간 및 동식물 세포의 유전자 교정(genome editing)에 사용된다. 유전자 교정은 미리 특정하게 조작된 인공 제한효소가 유전체에서 특정한 DNA 구간을 절단한 후 이를 수리하는 과정에서 원하는 유전자를 짜깁기하듯이 빼거나 더하는 방식으로 이루어진다.
유전자가위는 1세대 징크핑거 뉴클레아제(ZFN;Zinc Finger Nucleases), 2세대 탈렌(TALEN;Transcription Activator-Like Effector Nucleases), 3세대 크리스퍼(CRISPR;Clustered regularly interspaced short palindromic repeats)의 단계로 발전하였다.
목차
개요
유전자가위는 인간세포와 동식물세포의 유전자를 교정(genome editing)하는 데 사용하는 기술이다. 동식물 유전자에 결합해 특정 DNA부위를 자르는데 사용하는 인공 효소로 유전자의 잘못된 부분을 제거해 문제를 해결한다. 구체적으로 보면 DNA의 30억 염기쌍 가운데 일부(타깃)를 절단해 형질을 바꾸는 것이다.
유전자가위는 쉽게 말해 '지퍼 (DNA)'가 고장 났을 때 이빨이 나간 부위 (특정 유전자)만 잘라내고 새로운 지퍼 조각을 갈아 끼우는 '유전자 짜깁기' 기술로 불리기도 한다.
2000년대 처음 등장한 1세대 유전자가위는 'ZFN'이다. 타깃으로 안내하는 '아연집게 단백질'에 가위 역할을 하는 핵산분해효소(뉴클레아제)를 결합해 만들었다. 2세대인 '탈렌'을 넘어 현재 각광받고 있는 것은 3세대 유전자가위 크리스퍼이다. 세대가 높아질수록 자르는 효율과 정교함이 높아진다.
크리스퍼는 세균이 천적인 바이러스를 물리치기 위해 관련 DNA를 잘게 잘라 기억해 두었다가 다시 침입했을 때 물리치는 면역체계를 부르는 용어다. 이를 이용해 개발한 게 크리스퍼 유전자가위다. 과거 유전자 하나를 잘라내고 새로 바꾸는 데 수개월에서 수년씩 걸리던 것이 이제는 며칠이면 된다. 한 번에 여러 군데의 유전자를 동시에 손볼 수도 있다.
유전자가위는 유전자 변형 농산물(GMO)에 대한 우려를 줄이는 대안으로도 주목받고 있다. 병충해에 강한 GMO 콩은 식물에 동물 유전자를 집어넣는 기술을 활용해 나온 것이다. 인위적으로 외부 유전자를 넣다 보니 생태계 혼란에 대한 우려가 나올 수밖에 없었다. 하지만 크리스퍼 유전자 가위로 식물의 약한 유전자를 잘라내고 스스로 강한 유전자를 복원하도록 할 수 있다.
유전자 교정 기술이 발전하면서 새로운 논란도 불거졌다. 2014년 중국 과학자들은 크리스퍼 유전자 가위로 원숭이의 배아에서 특정 유전자를 바꿨다. 이를 사람에게 적용하면 정자 난자의 DNA를 바꿔 원하는 유전자를 가진 '맞춤형 아기'로 발전시킬 수 있다.
유전자가위의 필요성과 탄생 배경
질병을 치료하는 방법에는 일반적으로 약물치료와 외과적 수술이 있다. 그러나 유전자 돌연변이에 의해 발생하는 유전질환의 경우 약물과 수술은 근본적인 치료방법이 될 수 없다. 이런 유전질환을 원천적으로 치료하는 방법이 유전자치료(gene therapy)이다.
1990년대에 면역결핍증을 치료하기 위해 유전자치료를 처음 사용했을 때 혁신적 유전질환 치료법으로 주목을 받았다. 그러나 1999년 오르니틴 카르바밀 전이효소 결핍증(ornithine carbamyltransferase deficiency)이라는 유전질환을 치료하기 위해 건강한 유전자를 주입 받았던 18세의 환자가 4일 만에 사망하는 사건이 발생하자, 효과와 정확성 문제가 제기되었고 의학계는 신중론으로 돌아섰다.
그런데 최근 분자생물학의 비약적 발전으로 새로운 유전자 치료법이 각광받고 있다. 기존의 유전자 치료법은 고장난 유전자는 그대로 두고 정상 유전자를 추가하는 방식으로 바이러스를 이용하여 유전자를 전달하였다. 그러나 유전자가위를 이용하여 잘못된 유전자 자체를 정상으로 교정해 주는 유전자교정(gene editing)은 효과성이나 정확도 측면에서 기존 방법을 훨씬 능가한다.
유전자가위는 비교적 최근에 개발된 기법이지만 단시간 내에 비약적으로 발전하고 있다. 현재 개발되어 있는 유전자가위로는 징크핑거 뉴클레이즈(ZFNs·Zinc Finger Nucleases), 탈렌(TALENs, Transcription Activator-Like Effector Nucleases), 크리스퍼(CRISPR-Cas9)가 있는데각각 1세대, 2세대, 3세대라고 불린다. 비교적 최근 2015년에 개발된 CRISPR-Cpf1은 4세대 유전자가위이다.[1]
역사
제한효소
유전 공학의 서막을 연 제한효소(restriction enzyme)의 작용도 일종의 유전자 가위 기술이다. 그러나 4 – 8 개 염기서열을 인식하는 이 기술로는 각 유전체의 너무 많은 부분을 인식하고 자르게 되어 정밀한 유전체 교정 도구로는 미흡하다.
징크핑거뉴클라아제
징크핑거 뉴클레아제는 징크핑거와 3~4개의 뉴클레아제(핵산분해효소)가 결합한 것이다. 징크핑거는 1985년에 아프리카 발톱개구리의 유전자를 연구하면서 발견한, 아연(Zn)이 결합된 손가락(finger) 모양의 단백질 구조에서 유래하였다. 1990년대 중반에 미국 존스홉킨스대학의 스리니바산 찬드라세가란(Srinivasan Chandrasegaran)이 특정 DNA 염기서열을 인식하여 결합할 수 있는 징크핑거 단백질 6개를 엮고, 이것을 세균들이 단백질 절단을 위하여 사용하는 제한효소 'Fokl'과 결합함으로써 DNA 인식능력과 절단능력을 결합한 1세대 유전자가위가 탄생하였다. 이 유전자가위는 2000년대 초반부터 유전자 교정기술로 이용되기 시작하여 후천성면역결핍증(AIDS)·혈우병·알츠하이머병 등의 유전적 치료에 활용되고 있다.
탈렌
제2세대 프로그램가능한 뉴클레아제 시스템인 탈렌(TALENs)은 ZFN 에 비해 단일 염기쌍을 인식하는 도메인들을 연결하여 제작되어 제작의 복잡성이 줄어들고 좀 더 수월한 디자인이 가능하게 되었다. TALEN 기술은 특허권이 오픈되어 있어 여전히 이를 이용한 연구 및 작물 개발에 적용하려는 시도가 계속되고 있다.
탈렌은 설계와 제작 과정이 복잡하고 비용이 많이 드는 데다가 사용 중 오작동이 많이 발생하는 징크핑거 뉴클레아제의 문제점을 개선하기 위하여, 식물성 병원체인 잔토모나스(Xanthmonas)를 이용하여 개발한 것이다. 탈렌을 구성하는 아미노산 서열은 절단하는 DNA의 염기서열과 일치하기 때문에 탈렌의 아미노산 서열을 변경하면 결합 대상인 DNA의 염기서열도 달리할 수 있어 단백질을 맞춤식으로 변형하기가 훨씬 수월하다. 탈렌은 징크핑거 뉴클레아제와 마찬가지로 DNA를 절단하는 효소로 Fokl을 사용하는데, 2개의 결합체가 유전자 측면해서 접근해 들어가서 이중나선을 절단하여 세포가 복구할 수 없게 만든다. 2009년 개발되어 2011년 말부터 활용되기 시작한 탈렌 기술에 의하여 C형간염과 고콜레스테롤혈증 등과 같은 질병 모델이 만들어졌다.
크리스퍼-카스9
제3세대 프로그램가능한 뉴클레아제인 크리스퍼-카스9(CRISPR-Cas9) 시스템은 세균의 적응 면역시스템에서 유래된 정교한 유전자 가위로 알려졌다. CRISPR(Clustered Regularly Inter-Spaced Palindromic Repeat)이 발현된 RNA 단일 가닥과 CRISPR-연관 단백질(CRISPR-associated protein 9; Cas9)이 복합체를 이루어 타겟 인식 및 DNA 절단 활성을 모두 갖게된다.
3세대인 크리스퍼 유전자가위는 교정하려는 DNA를 찾아내는 RNA(리보 핵산)와 DNA를 잘라내는 제한효소인 Cas9를 결합하여 만든 것으로, 2012년 말에 개발되었다. 안내 역할을 하는 RNA가 교정을 목표로 하는 DNA 염기서열에 달라붙으면 Cas9가 DNA의 특정 부위를 잘라내는 방식으로 진행되는데, 1세대 및 2세대와 달리 복잡한 단백질 구조가 없고 DNA 절단 정도가 더욱 깊다. 이전 세대의 유전자가위들과 달리 오작동에 대한 보호장치가 없어 자칫하면 엉뚱한 부분을 잘라내 돌연변이를 일으킬 수 있다는 것이 치명적 단점이긴 하지만, 과거에는 유전자 하나를 잘라내고 새로 바꾸는 데 수개월에서 수년씩 걸리던 것이 크리스퍼가 개발되면서 수일 이내로 단축되었을 뿐 아니라 동시에 여러 군데의 유전자를 손볼 수도 있게 되는 등 유전자 교정에 획기적인 발전이 이루어졌다. 개발 이후 각종 동물이나 식물의 형질 개량, 질병 치료, 해충 퇴치부터 인간 배아의 유전체를 교정하는 실험까지 여러 방면의 연구에 활용되고 있으나, 이에 따른 생태계 파괴나 윤리적 문제에 대한 우려도 제기된다.
- 신형 크리스퍼 Cpf1 유전자가위(CRISPR Cp1)
크리스퍼 Cpf1 유전자가위는 현재 널리 이용되는 크리스퍼 Cas9 유전자가위와 다른 종류다. 크리스퍼 Cpf1은 DNA를 자르는 Cpf1 단백질과 염기서열을 찾아가는 크리스퍼RNA(crRNA)를 혼합해 만든다. Cpf1 단백질 구조는 Cas9 단백질과 달라 결합하는 RNA 길이가 짧아 제작에도 수월한 장점이 있다. 무엇보다 Cpf1 단백질은 타이미닌이 풍부한 염기서열을 찾아가기 때문에 크리스퍼 Cas9이 표적할 수 없었던 염기 서열의 유전체 교정이 가능하다. Cas9은 구아노신이 풍부한 염기서열을 찾아들어가기 때문이다.
IBS 연구진이 신형 크리스퍼 Cpf1 유전자가위(CRISPR Cp1)를 사용해 생쥐 배아의 유전자 교정에 최초로 성공했다. Cpf1 단백질이 지난해 학계에 보고된 이후 동물 개체 수준에서 유전자 교정에 시도해 성공한 첫 번째 사례다.[2]
프라임 에디팅
크리스퍼 유전자 가위의 정확도를 높이거나 다양한 기능을 할 수 있는 새로운 기술도 등장하고 있다. 4세대 유전자 가위로도 불리는 프라임 에디팅이 대표적이다. 프라임 에디팅은 2019년 미국 브로드연구소에서 개발한 유전자 가위다. 기존 유전자 가위보다 정확도가 높다는 장점이 있다.
유전자 치료를 하려면 크리스퍼 유전자 가위로 고장난 염기서열을 잘라 편집하고, 정상적인 염기서열을 끼워 넣는 교정도 해야 한다. 그러나 크리스퍼 유전자 가위를 이용하면 교정 성공률은 10% 미만에 불과하다.
프라임 에디팅은 유전자 편집과 교정을 한번에 할 수 있게 해 교정 성공률을 최대 89%까지 끌어 올렸다.[3]
기타
DNA 대신 RNA를 편집할 수 있는 유전자 가위도 최근 주목받고 있다. DNA를 편집하는 과정에서 오류가 생기면 예상치 못한 부작용이 발생할 수 있고, 다시 고치는 것도 불가능하다. 그러나 RNA를 편집하면 오류가 있더라도 일시적인 부작용만 나타난다. DNA 편집보다 안전성이 높아 유전자 치료제 개발에 활용할 수 있을 것으로 주목받고 있다.[3]
유전자가위의 작동 원리
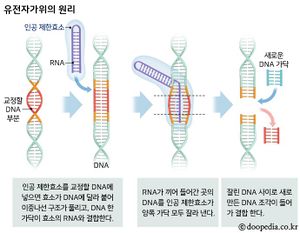
유전자가위의 기본 작동 원리는 특정 표적 위치의 DNA 를 정확하게 절단하는 것에서 시작된다. 이러한 절단 작용으로 DNA 이중 가닥이 절단되면 세포에서는 절단된 DNA를 수선하게 되는데, 이 수선과정에서 다양한 유전적 변이가 도입되게 된다. 이러한 변이는 1개의 염기 혹은 여러 개의 염기의 결실 혹은 삽입의 형태로 도입되고, 이로 인해 단백질로 번역하는 과정에서 틀이동(frameshift)을 유도하여 갑작스런 종결코돈이 생성되어 비정상적인 단백질로 번역되게 된다. DNA 2중 가닥의 수선과정은 크게 서열 상동성 재조합 혹은 비상동성 말단 접합의 방식을 통해 이루어지며, 특히 비상동성 말단 접합의 방식은 별도로 상동성 DNA 조각을 넣어줄 필요가 없고, 수선 과정에서 변이 생성이 높은 것으로 알려져 있다. 특정 표적 위치에 대한 특이성은 ZFNs 과 Talens은 각 단백질의 DNA 인식 부위를 분자생물학적 방법을 통해 제작하여 적합한 도메인들로 구성되도록 제작한다. 반면 크리스퍼 시스템은 DNA 결합 및 핵산분해효소 작용을 모두 가지고 있는 Cas9 단백질은 표적 특이적으로 제작할 필요가 없고, 표적 위치의 약 20개의 염기서열에 상응하는 단일가닥의 가이드 RNA만을 제작하면 된다.
유전자 가위의 적용 및 발전 가능성
유전자 가위는 유전자 편집 혹은 유전체 교정에 가장 핵심적인 역할을 담당한다. 유전자 가위의 정확성과 효율성 측면에서 제3세대 유전자 가위인 크리스퍼 시스템은 현재까지의 유전자 가위 중 가장 정확성 및 효율성이 향상된 도구로서, 식물, 동물, 인간 등 모든 생물체에 대한 유전자 편집 및 조절 작용에 획기적으로 이용 가능하다. 명확한 녹아웃을 만들어 기능 상실을 유도하거나 새로운 유전자의 기능을 확인하는 연구 뿐 아니라 이를 응용한 유전자 발현 조절, RNA 편집, DNA 메틸레이션 조절 등 무궁무진한 확장성을 가지고 있다.
유전자 편집 아기 탄생과 윤리적 논란
2018년 중국 남방과기대 허젠쿠이(賀建奎) 부교수가 유전자 가위로 후천성 면역결핍증(AIDS)을 발생시키는 HIV 바이러스를 막기 위해 특정 유전자를 제거한 쌍둥이를 출산한 것으로 알려져 파문이 일었다.
허젠쿠이 연구진의 유전자 편집 아기는 HIV 보균자 남성과 비보균자 여성을 대상으로 진행됐다. 부모로부터 얻은 정자와 난자를 결합해 수정란을 만들고, 유전자 가위를 통해 HIV를 받아들이는 유전자 CCR5를 제거했다. 생존한 배아는 유전자 검사를 거쳐 자궁에 착상시켰고, 이에 유전자 편집 아기가 탄생했다.
그러나 남성이 HIV 감염자라도 정자 자체에는 HIV가 없기 때문에 태아가 HIV에 감염될 가능성이 없다는 점에서 의학적으로 시급한 사항이 아닌데도 맞춤형 아기를 시도해 파문이 일었다.
동영상
참고자료
- 〈유전자가위〉, 《두산백과》
- 〈유전자가위〉, 《한경 경제용어사전》
- 〈유전자 가위〉, 《식물학백과》
- 〈유전자가위〉, 《시사상식사전》
- 이병철 기자, 〈“10년 전 탄생한 크리스퍼 유전자 가위…앞으로 10년 세상 바꿀 것”〉, 《조선비즈》, 2023-01-22
- 대외협력실 고은경, 〈신형 유전자가위 Cpf1으로 생쥐 유전자 교정 성공〉, 《기초과학연구원》, 2023-11-28
- 청해지기, 〈유전자가위 원리와 개발과정- 크리스퍼(CRISPR-Cas9, Cpf1)〉, 《네이버 블로그》, 2016-06-07
같이 보기
- ↑ 청해지기, 〈유전자가위 원리와 개발과정- 크리스퍼(CRISPR-Cas9, Cpf1)〉, 《네이버 블로그》, 2016-06-07
- ↑ IBS 대외협력실 고은경, 〈신형 유전자가위 Cpf1으로 생쥐 유전자 교정 성공〉, 《기초과학연구원》, 2023-11-28
- ↑ 3.0 3.1 이병철 기자, 〈“10년 전 탄생한 크리스퍼 유전자 가위…앞으로 10년 세상 바꿀 것”〉, 《조선비즈》, 2023-01-22

 위키원
위키원