"배아줄기세포"의 두 판 사이의 차이
(새 문서: 300px|섬네일|right|인간의 배아줄기세포 파일:Stem cells diagram.png|300px|섬네일|right|만능성의 배아줄기세포는 태반을 제...) |
(차이 없음)
|
2024년 11월 25일 (월) 12:04 기준 최신판
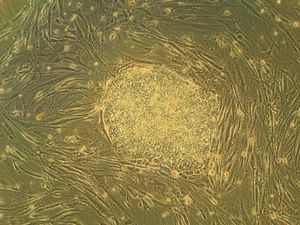
배아줄기세포(Embryonic stem cell, ES cells)는 배반포의 내부세포괴에서 유래한 만능성 줄기세포로, 초기 착상 전 배아이다. 수정 후 인간의 배아는 4-5달 후 배반포를 형성하며, 그 때 배아는 50-150개의 세포로 구성된다. 배반포의 안쪽에는 내세포괴라고 하는 세포들의 덩어리가 있는데, 이 세포들은 세포분열과 분화를 거쳐 배아를 형성하고, 배아는 임신기간을 거치면서 하나의 개체로 발생하게 된다. 이 과정에서 내세포괴의 세포들이 혈액, 뼈, 피부, 간 등 한 개체에 있는 모든 조직의 세포로 분화하게 된다. 때문에 배아 단계에서 추출한 줄기세포는 뼈, 간, 심장 등 장기로 발전할 수 있는 만능세포라고 불린다.
배아줄기세포로 각종 난치병 치료에 쓰이는 장기 세포를 시험관에서 무한정 만들어 이식할 수 있다면 인류의 꿈인 무병장수가 실현될 수 있다. 기증된 장기가 부족한 현실에서 꼭 필요한 기술이다. 현재 백혈병, 파킨슨병, 당뇨병 등에 걸린 환자에게 장애가 생긴 세포를 대신하는 정상 세포를 외부에서 배양, 주입하여 치료하려는 시도가 행해지고 있다.
또한 무엇보다도 불임부부에게 새로운 희망을 줄 수 있다. 즉 성세포(정자)에 문제가 있어서 정상적인 방법으로는 수정이 불가능한 부부를 위해 여러 가지 방법들이 강구되어 왔지만 체세포핵 이식술을 이용하면 정자가 없이도 수정이 가능하므로 이 문제를 완전히 다른 차원에서 해결할 수 있는 길이 열린다. 수핵 세포질로 어머니의 난자를 이용하고 세포핵으로 어머니, 혹은 아버지의 체세포를 이용한다면 어머니와 꼭 닮은 딸, 혹은 아버지와 꼭 닮은 아들을 낳을 수도 있는 것이다. 또 수정란의 배 분리 기술을 이용하면 자궁에 이식하기 전에 수정란을 검사하여 결함이 있는 것을 걸러 내거나 혹은 그 유전자만을 교정하여 원하는 건강한 아기를 얻을 수 있다.
쥐의 배아줄기세포는 8마이크로미터에 가깝고 사람의 배아줄기세포는 약 14마이크로미터이다.
목차
배아줄기세포의 발생[편집]
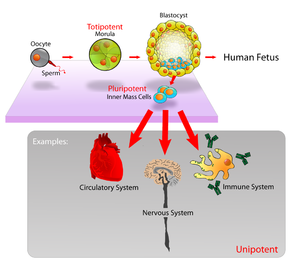
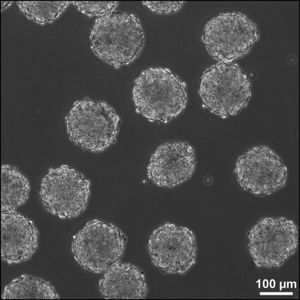
정자와 난자가 만나 수정이 되면 매우 복잡한 세포 분열과 분화를 통해 배아를 형성하고 결국 하나의 개체로 탄생하게 된다. 수정 후 초기 발생단계에서는 하나의 세포가 하나의 개체를 형성할 수 있는 만능(totipotent)세포이지만 분열과 분화를 거듭하면서 각 세포는 자신의 운명이 결정지어진다. 수정란의 난할 과정에서 배아에 빈 공간이 생기는 시기를 포배 또는 배반포라 한다. 이 시기 배아의 바깥쪽 세포는 나중에 태반이 되고 내부 세포 덩어리(inner cell mass)에서 분리된 세포가 배아줄기세포로 혈액, 피부, 뼈, 간, 심장 등 한 개체에 존재하는 모든 조직의 세포로 분화될 수 있다1). 그러나 이 배아줄기세포는 태반으로는 분화될 수 없으므로 하나의 개체를 형성할 수는 없다. 배아줄기세포는 체내에 자연적으로 존재하는 세포가 아니며 발생 중인 배반포의 내부 세포 덩어리로부터 분리해 실험적으로 얻은 세포이다.
배아줄기세포는 자가복제(self-renewal)가 가능하며 적절한 조건하에서 체내에 존재하는 특정 세포로 분화할 수 있는 잠재력을 가지고 있기에 신체의 손상된 세포나 조직을 줄기세포로부터 분화된 같은 종류의 새로운 세포로 대체시켜 난치병을 치료하기 위한 연구들이 활발히 진행되고 있다.
속성[편집]
초기 포유류 배아의 배반포 단계로부터 유래한 배아줄기세포는 모든 다른 세포 유형으로 분화할 수 있는 능력과 번식 능력에 의해 구별된다. 배아줄기세포의 특성은 일반적인 핵형을 가지고, 높은 텔러머라제 활성을 유지하며, 장기적으로 증식할 수 있는 능력을 가진다.
만능성[편집]
내부세포괴의 배아줄기세포는 만능성이며, 이는 배아줄기세포가 원시외배엽을 발생하기 위해 분화할 수 있고, 이는 궁극적으로 낭배형성 동안 3가지 주요 배엽의 파생물인 : 외배엽, 내배엽 및 중배엽으로 분화된다. 배아줄기세포는 성인 신체에 220가지 이상의 각각 세포 유형이 있다. 만능성은 성인에 있는 성체줄기세포와 배아줄기세포를 구별한다. 배아줄기세포는 신체의 모든 세포 유형을 발생할 수 있는 반면, 성체줄기세포는 다능성 줄기세포이며, 오직 제한된 수의 세포 유형으로만 생산할 수 있다. 배아줄기세포의 만능성을 시험관 내에서 이용할 수 있다면, 그것은 사실상 세포 또는 조직 형태를 도출하는 수단일지도 모른다. 이것은 연령, 질환 또는 외상으로 인한 조직의 손상 또는 기능 상실을 초래하는 조건에 대한 다양한 새로운 치료법을 제공한다.
2012년 노벨 생리학·의학상은 John B. Gurdon과 Shinya Yamanaka 공동 연구로 성체 세포는 만능성으로 재프로그램 될 수 있다는 발견에 기인하였다.
증식[편집]
게다가 정의된 조건 하에, 배아줄기세포는 미분화 상태에서 자신을 무기한으로 증식할 수 있고, 분화하기 위해 적절한 신호가 제공될 때, 전구세포 형성을 통해 거의 모든 성체 세포 표현형으로의 능력을 가진다. 배아줄기세포는 지속적인 실험과 임상적인 사용을 위해 자신을 무한하게 생산할 수 있기 때문에, 이는 배아줄기세포가 연구와 재생의학 모두를 위해 유용한 도구로 사용될 수 있게 한다.
유용성[편집]
자가 재생에 대한 배아줄기세포의 가소성과 잠재적인 무한 능력 때문에, 부상 또는 질병 후에 배아줄기세포 치료법은 재생의학과 조직대체를 위해 제안되었다. 잠재적으로 만능성 줄기세포로 치료될 수 있는 질환은 혈액과 관련된 면역 체계의 유전적 질환, 암 및 장애, 소아형 당뇨, 파킨슨병, 실명 및 척추부상 등을 포함한다. 줄기세포 치료의 윤리적인 문제 이외에 동종 줄기세포 이식에 관련된 이식편대숙주병의 기술적 문제점이 있다. 그러나 조직 접합성과 관련된 이러한 문제는 자가 기증자 성체줄기세포와 치료용 복제를 사용하여 해결될 수 있다. 체세포 핵 이식(SCNT)이라는 방법에 따라 행해져 치료 복제는 미토콘드리아 DNA (mDNA의) 변이된 질환에 대한 유리한 경우가 있다.
정의된 요소와 체세포의 재프로그래밍하여 더 최근에는 세포 은행 또는 줄기에 이용된다. 배아줄기세포는 기증자 조직 부족문제를 극복하고, 또한 수용자의 면역접합성을 갖는 세포를 만듦으로써 문제를 극복할 수 있다는 희망을 제공한다. 배아줄기세포의 다른 잠재적인 사용은 초기 인간 발달의 조사, 유전자 질환의 그리고 독성 검사를 위한 체외 실험 시스템을 포함한다.
활용[편집]
잠재적인 임상적 활용(잠재적 진단용)[편집]
2002년 PNAS 실린 기사에 따르면, "인간 배아줄기세포는 다양한 세포 유형으로 분화할 수 있는 잠재력을 가지고 있다. 그러므로, 이식 혹은 조직 공학용 세포의 원천으로서 유용할 수 있다."
현재 연구는 배아줄기세포를 세포 대체 요법으로 사용하기 위해 다양한 세포 유형으로 구별하는 것에 중점을 두고 있다(CRTs). 현재 있거나 개발 중인 세포 유형 중 일부는 심근 세포(CM), 신경 세포, 간 세포, 골수 세포, 섬 세포 및 내피 세포를 포함한다. 그러나, 배아줄기세포로부터 그러한 세포 유형의 기원은 장애물 없이는 불가능하다. 따라서 현재 연구는 이 장벽을 극복하는데 중점을 두고 있다.
게다가, 미래에는 장기 이식의 중요한 대안이 되고, 배아줄기세포는 독성학 분야 및 저분자의약품으로 개발될 수 있는 신물질을 밝히기 위한 세포 검진으로 사용되고 있다. 연구 결과는 배아줄기세포로부터 얻은 심근세포는 약물 반응에 대해 실험하고, 독성 프로파일을 예측하기 위해서 시험관 모델에서 검증된 것을 보여줬다. 배아줄기세포에서 유래된 심근세포는 약리학적 자극에 반응하는 것으로 나타났으므로, 다형성심실빈맥 같은 심장 독성을 평가하기 위해서 사용할 수 있다.
또한 배아줄기세포에서 유래된 간세포는 신약개발의 전임상 단계에서 사용될 수 있는 유용한 모델이다. 그러나, 배아줄기세포로부터 간세포의 발생은 어려운 것으로 밝혀졌고, 이것은 약물대사를 시험하는 능력을 저해한다. 그러므로, 현재 연구는 안정된 단계Ⅰ과 Ⅱ 효소 활성을 갖는 완전한 기능성 배아줄기세포 유래 간세포를 설립하는데 초점을 맞추고 있다.
연구자들은 또한 배아줄기세포를 파킨슨병 치료에 사용할 수 있다는 희망을 가지고 도파민 생산하는 세포로도 구분했다. 최근 건강한 난모세포에 후각 초성화 세포를 체세포 핵 치환한 후의 배아줄기세포 발생은 신경변성질환에 권장되었다. 배아줄기세포는 또한 자연 살해 세포(NK 세포)와 뼈 조직으로 분화되어왔다. 당뇨병에 대한 대체 치료법을 제공하기 위해 배아줄기세포가 포함된 연구도 진행 중이다. 예를 들어, D’Amour et al.은 배아줄기세포를 인슐린 생산 세포로 분화시킬 수 있었고, 하버드 대학의 연구자들은 배아줄기세포로부터 췌장 베타 세포를 대량으로 생산 할 수 있었다.
유전 질환 모델로서의 인간 배아 줄기 세포[편집]
이 문제를 해결하기 위한 몇 가지 새로운 연구가 시작되었다. 이것은 세포를 유전적으로 조작하거나 최근에는 산전유전학진단(PGD)에 의해 확인된 질병 세포주를 얻음으로써 행해져 왔다. 이 접근법은 취약 X 증후군, 낭포성 섬유증 및 믿을만한 모델 시스템이 없는 다른 유전병 같은 장애를 연구할 때 매우 유용할 수 있다.
배아와 세포 유전학(유전자 세포학)을 전문으로 연구하는 러시아 계 미국인 의학 연구원인 Yury Verlinsky는 일반적인 양수 검사보다 한달 반 앞당겨 유전자 및 염색체 질환을 결정하는 산전 진단 테스트 방법을 개발했다. 이 기술은 현재 많은 임산부 및 예비 부모, 특히 유전적 기형 병력이 있거나 유전학적으로 관련된 질환의 위험이 높은 35세 이상의 여성에게 사용된다. 또한, 부모가 유전적 장애가 없는 배아를 선택할 수 있게 함으로써, 무병 후손의 세포를 사용하여 이미 유사한 장애와 질병을 가진 동기의 삶을 피할 수 있게 한다.
과학자들은 인간 배아 줄기 세포를 유도하는 새로운 기술을 개발했다. 상실배와 전체 배반포를 포함한 배아의 다른 출처로부터 정상 배아줄기세포주들이 확립되었다. 이 결과는 연구자들이 다른 유전적 기형을 가진 배아로부터 배아줄기세포주를 만들 수 있게 한다.; 따라서, 질병 진행을 저해할 수 있는 분자 수준의 메커니즘을 찾을 수 있다. 유전적 및 염색체 기형을 가진 배아에서 유래한 배아줄기세포주는 유전적 결함의 경로를 이해하는데 필요한 데이터를 제공한다.
기증자 환자는 하나의 결함 유전자 복제본과 하나의 정상 복제물을 얻으며, 이 두 사본 중 하나만 복제에 사용된다. 2개의 정상적인 복제본을 가지는 배아 줄기 세포에서 발생한 난자 세포를 선택함으로써, 연구자들은 다양한 질병에 대한 다양한 치료법을 발견할 수 있다. 이 이론을 테스트하기 위해 McLaughlin 박사와 그의 동료 중 일부는 처녀 생식 배아 줄기 세포가 탈라세미아 매개물이 있는 마우스 모델에서 사용될 수 있는지 여부를 조사했다. 이 질병은 유전되는 혈액 질환으로서, 헤모글로빈이 부족하여 빈혈을 야기하는 질병이다. 사용된 마우스 모델에 결함이 있는 유전자 복제본이 하나가 있었는데, 질병에 걸린 마우스에 있는 미수정 난자로부터 배아줄기세포를 채취하였고, 건강한 헤모글로빈 유전자만 포함하는 줄기세포가 식별되었다. 건강한 배아 줄기 세포주는 보균자 마우스에 이식된 세포로 전환되었다. 5주 후, 이식 실험 결과, 이 보균자 마우스는 정상적인 혈구 수와 헤모글로빈 수치를 보였다.
DNA 손상 복구[편집]
분화된 체세포와 배아줄기세포는 DNA 손상을 처리하기 위해 다른 전략을 사용한다. 예를 들어,체세포의 한 유형인 인간 포피 섬유 아세포는 모든 세포주기 단계에서 이중 가닥 파손을 복구하기 위한 경로로서 오류가 발생하기 쉬운 DNA 복구 과정인 비상동말단부착을 사용한다. 그 오류가 발생하기 쉬운 성질 때문에, 비상동말단부착은 세포의 복제 자손에 돌연변이를 일으키는 경향이 있다.
배아줄기세포는 이중 가닥 파손을 다루기 위해 다른 전략을 사용한다. 배아줄기세포는 생식세포계열의 세포를 포함하여 생물체의 모든 세포 유형을 생성하기 때문에, 잘못된 DNA 복구로 인해 배아줄기세포에서 발생하는 돌연변이는 분화된 체세포에서 보다 더 심각한 문제이다. 결과적으로, DNA 손상을 정확하게 복구하기 위해서는 배아줄기세포에서 강력한 메커니즘이 필요하고, 복구가 실패하면 DNA가 손상된 그 세포를 제거하는 것이 필요하다. 따라서, 마우스 배아줄기세포는 주로 이중 가닥 파손을 고치기 위해서 높은 정확도의 상동 재조합 회복을 사용한다. 이러한 유형의 수리는 S 단계 동안 형성되는 두 자매 염색체의 상호작용에 의해 결정되며, 세포 주기의 G2 단계 동안 같이 존재한다. 상동 재조합 회복은 다른 자매 염색체의 온전한 정보를 사용하여 자매 염색체의 이중 가닥 파손을 정확하게 복구할 수 있다. 세포 주기의 G1기(즉, 다음 복제 단계드 이전이지만 중기/세포 분열 이후)의 세포는 각 염색체의 단 하나의 복제본을 갖는다(즉, 자매 염색체는 존재하지 않는다). 마우스 배아줄기세포에는 G1 관문이 없으며, DNA 손상을 입으면 세포주기가 정지되지 않는다. 오히려 그들은 DNA 손상에 대한 반응으로 프로그램된 세포 사멸(apoptosis)을 겪는다. 세포 사멸은 돌연변이와 암 진행을 방지하기 위해서 DNA 손상된 세포를 제거하는 이중 안전 장치 전략으로 사용될 수 있다. 이 전략과 일치하게, 마우스 배아줄기세포는 동질 유전자형의 마우스 체세포보다 돌연변이 빈도가 약 100배 낮다.
부작용[편집]
치료를 위해 배아줄기세포를 환자에게 이식할 수 있다는 것에 대한 주요한 우려는 기형종을 포함한 종양을 형성하는 능력이다. 안전 문제로 FDA는 최초의 배아줄기세포 임상시험(아래 참조)을 보류했으나, 종양은 관찰되지 않았다.
잠재적 임상 용도를 위해 배아줄기세포의 안전성을 향상시키는 주요 전략은 종양을 유발하는 능력을 감소시키거나 제거한 특정 세포 유형(예 : 뉴런, 근육, 간 세포)으로 분화시키는 것이다. 분화 후, 세포를 추가 정제하기 위해 유동 세포 계수법에 의해 분류한다. 배아줄기세포는 유전적으로 암과 관련된 c-Myc 같은 유전자로 변형되지 않기 때문에, 본질적으로 유도만능줄기세포보다 안전할 것으로 예측된다. 그럼에도 불구하고, 배아줄기세포는 매우 높은 수준의 유도만능줄기세포 유도 유전자를 발현하며, Myc을 포함한 이 유전자들은 배아줄기세포의 자가 재생 및 만능성에 필수적이다. 그리고, c-Myc 발현을 제거함으로써 안전성을 향상시킬 수 있는 잠재적 전략은 세포의 줄기세포능을 보존하기 어려울 것이다. 그러나, N-Myc 및 L-Myc은 c-Myc 대신에 유도만능줄기세포를 유사한 효율로 유도하는 것으로 확인되었다.
역사[편집]
1964년 Lewis Kleinsmith and G. Barry Pierce Jr.는 생식세포에서 유래된 것으로 알려진 종양인 기형암종으로부터 한 세포를 분리하였다. 기형암종으로부터 분리한 세포들은 세포배양을 통해 줄기세포로 복제되고 자라서 지금은 배아암종(EC) 세포로 알려져 있다. 비록 형태학 및 분화 가능성(전분화능)의 유사성은 초기 마우스 발달을 위한 시험관 모델로서 배아암종세포의 이용을 유도하였지만, 배아암종세포는 유전적 변이와 종종 기형암종의 발생동안 축적된 비정상적인 핵형을 가진다. 이러한 유전적 비정상은 내부세포괴로부터 직접 만능성 세포를 배양할 필요성을 강조했다.
1981년 배아줄기세포는 마우스 배아에서 독집적으로 두 그룹으로 나뉘었다. 자궁에서 마우스 배아를 배양하여 세포 수를 증가시키고, 이들 배아의 배아줄기세포를 유도할 수 있는 새로운 기술을 케임브릿지 대학교 유전학과의 Martin Evans와 Matthew Kaufman은 7월 1일에 발표하였다. 샌프란시스코 캘리포니아 대학 해부학과의 게일 R 마틴 (Gail R. Martin)은 12 월에 그녀의 논문을 발표하고 “배아줄기세포”라는 용어를 만들었다. 그녀는 배아가 시험관 모델에서 배양될 수 있다는 것 과 배아줄기세포는 이 배아에서 추출할 수 있음을 보여주었다. 1998년 위스콘신-매디슨 대학(University of Wisconsin-Madison)의 제이슨 톰슨(James Thomson)이 이끄는 연구원들은 처음으로 세포 배양에서 인간 배아 줄기 세포를 분리 및 성장시키는 기술을 처음으로 개발했을 때, 큰 전환점이 발생하였다.
임상 시험[편집]
2009년 1월 23일, 인간배아줄기세포에서 파생된 희돌기교세포(뇌와 척추의 세포 유형)를 척수 손상 환자들에게 이식하는 1 단계 임상시험은 미국식품의약국(FDA)으로부터 승인을 받았는데, 이것은 세계 최초의 인간 대상의 인간배아줄기세포 실험이다. 과학적 발전을 이끈 이 연구는 캘리포니아 대학의 Hans Keirstead와 그 동료들 그리고 Irvine에 의해 진행되었으며, Michael D. West 박사에 의하여 설립된 CA(California) Menlo Park의 Geron Corporation의 지원을 받았다. 1단계 임상시험은 반흔 조직이 형성되기 전에 세포가 주입되어야 하기 때문에, 임상시험 시작 2주 전에 부상을 입은 약 8 ~10명의 하반신 불수 환자들을 등록하도록 설계되었다. 연구진들은 세포를 주입하는 것이 환자를 완치하는 것과 기동성을 복구시키는 것이 기대되지 않는다는 것을 강조하였다. 설치류 실험 결과들을 토대로, 연구진들은 수초의 복원과 발생 할지도 모르는 이동도의 증가를 추측하였다. 이 첫 번째 실험은 주로 이 절차의 안정성을 시험하기 위해 고안되었고, 만약 모든 것이 잘 진행된다면, 더 심각한 장애를 가진 사람들이 포함된 미래 연구로 이어질 것으로 기대되었다. 이 실험은 치료를 받은 여러 쥐 모델에서 소수의 낭포 발견에 대해 미국식품의약국의 우려로 2009년에 중단되었지만, 2010년 7월 30일에 재개되었다.
2010년 10월에 연구진은 애틀란타의 Shepherd Center에서 첫 번째 환자에게 ESTs를 등록하고 관리했다. 줄기세포 치료의 창시자 Geron Corporation은 줄기세포가 복제되고 GRNOPC1치료가 성공 또는 실패 여부를 평가하는데 수개월이 걸릴 것으로 추정했다.
2011년 11월 Geron은 재정적인 이유로 줄기세포 연구를 중단하고 실험을 멈췄지만, 기존 환자들을 지속적으로 모니터링하고 그들의 연구를 지속할 수 있는 파트너를 찾는 시도를 계속할 것이라고 발표했다. 2013년에 CEO Dr. Michael D. West가 운영하는 BioTime(AMEX: BTX)은 척추 손상 연구에 대한 Geron의 배아줄기세포 기반의 임상시험을 재개하겠다는 공식적인 의사와 Geron의 줄기 세포 자산을 인수하였다.
BioTime의 자회사인 Asterias Biotherapeutics (NYSE MKT: AST)는 California Institute for Regenerative Medicine (CIRM)로부터 척수 손상에 대한 세계 최초의 배아줄기세포기반의 인간 임상시험 연구를 재개하기 위하여, California Institute for Regenerative Medicine (CIRM)으로부터 1,430만 달러의 전략적 제휴 액수가 승인되었다. 캘리포니아의 공적 자금의 지원을 받는 CIRM은 줄기 세포 관련된 연구 개발에 최대 자금 제공자이다.
이 상은 Asterias에게 척수손상에 관한 AST-OPC1의 임상 개발을 재개하는 것과 미래 중추적인 연구를 위해 타겟집단에 상승용량의 따른 임상시험 확대를 위해서 기금을 제공한다.
AST-OPC1은 희돌기교세포전구체(OPCs)를 포함한 인간배아줄기세포(hESCs)에서 파생된 세포집단이다. 희돌기교세포전구체와 희돌기교세포라고 불리는 그들의 성숙한 파생세포는 신경 척수와 뇌의 신경 세포에 중요한 기능적인 지원을 제공한다. Asterias는 최근 신경학상으로 완전한 흉부척수손상을 가진 환자들에게 저용량으로 AST-OPC1 투여에 대한 1단계 임상시험 결과를 발표하였다. 이 결과는 AST-OPC1이 척수 손상 부위에 성공적으로 전달된 것을 보여주었다. AST-OPC1 투여 후 2~3년 추적한 환자들에게서 빈번한 신경계 검사 및 MRI를 포함한 상세한 후속 평가에서 세포와 관련된 심각한 부작용이 없다는 것을 보여주었다. 이식 후 일 년 동안 실험 환자의 면역 모니터링은 AST-OPC1에 대한 항체 기반 또는 세포 면역반응이 없음을 보여준다. 5명의 실험 환자들 중 4명은, 2-3년 추적 관찰 기간 동안 수행된 연속적인 MRI 스캔은 감소된 척수 캐비테이션의 발생과 AST-OPC1가 척수 조직 악화를 감소시키는데 긍정적인 효과가 있을지도 모른다는 것을 시사한다. 신뢰도 높고 척수손상환자의 신경학적 평가방법인 International Standards for Neurological Classification of Spinal Cord Injury (ISNCSCI)의 평가에 의하면, 임상시험에서 5명의 환자에게서 예상치 못한 신경의 악화 또는 향상은 없었다.
CIRM 자금은 실험에 대하여 FDA 승인 및 Asterias와 CIRM 간의 최종적인 합의 완료 그리고 사전 정의된 프로젝트의 특정 업적 달성에 대한 Asterias의 지속적인 진전에 달려있다.
유래와 배양 기술 및 조건[편집]
인간에서 유래[편집]
시험관 수정은 다중 배아를 생성한다. 잉여의 배아는 임상적으로 사용되지 않거나 환자에게 이식하기에 부적합하므로, 기증자가 동의하여 기증할 수 있다. 인간 배아 줄기 세포는 이러한 기증된 배아로부터 유래될 수 있거나, 추가적으로 환자의 세포 및 기증된 난자를 사용하여 복제된 배아로부터 추출될 수 있다. 배아의 배반포 단계에서 내부세포괴는 배아 외성 조직으로 분화할 수 있는 영양외배엽 세포에서 분리된다. 항체가 영양 외배엽에 결합되고, 다른 용액에 의해 제거되는 과정인 면역 수술 및 기계적인 분석은 분리하기 위해 수행된다. 생성된 내부세포괴 세포는 지지를 제공할 세포에 둘러지게 된다. 내부세포괴 세포는 부착되고 더 확장되어 미분화된 인간 배아세포주를 형성한다. 이 세포는 매일 영양분이 공급되고, 4-7일마다 효소적 또는 기계적으로 분리된다. 분화가 일어나기 위해서는 인간 배아 줄기 세포주가 지지 세포에서 제거되어 배양체를 형성하고, 필요한 신호를 포함하는 혈청과 공동 배양된다.
다른 동물에서 유래[편집]
배아줄기세포는 기증자 모체 동물로부터 채취된 초기 배아의 내부세포괴로부터 유도된다. Martin Evans와 Matthew Kaufman은 배아 이식을 지연시켜 내부세포괴를 증가시키는 기술을 발표했다. 이 과정에는 기증자의 난소를 제거하고, 프로게스테론을 투여함으로써 호르몬 환경을 변화시켜 배아를 자궁에서 자유롭게 유지하는 과정이 포함된다. 자궁 내 배양 4-6일 후에, 배아를 채취한다. 그리고, 내부세포괴가 단일 세포로 분리되고 mitomycin-c로 처리한 섬유 아세포에 둘러싸여 “난자 원통형 구조”를 형성할 때까지 체외 배양한다. (섬유 아세포 유사 분열을 예방하기 위해서) 복제 세포주는 단일 세포가 자라서 만들어진다. Evans와 Kaufman은 이 배양에서 성장한 세포가 기형종과 배양체를 형성할 수 있고, 체외 배양에서 분화할 수 있음을 보여주었는데, 이들 모두는 세포가 만능성임을 나타낸다.
Gail Martin은 배아줄기세포를 다르게 유도하였다. 그녀는 교미 후 약 76 시간에 기증자 모체에서 배아를 제거하고, 혈청을 함유한 배지에서 하룻밤 동안 배양했다. 다음날, 그녀는 현미경수술을 사용하여 후기 배반포에서 내부세포괴를 제거했다. 추출된 내부세포괴는 혈청을 함유하는 배지에 mitomycin-c를 처리하고, 배아줄기세포에 의해 길들여진 섬유 아세포에서 배양했다. 약 1주일 후, 세포 집단이 자랐다. 이 세포들은 배지에서 자랐으며, 기형종을 형성하고, 시험관 내에서 분화하고, 배양체를 형성하는 능력에 의해 입증된 것처럼 만능성 특징을 입증했다. Martin은 이 세포들을 배아줄기세포로 언급했다.
배양보조세포가 백혈병 억제 인자(LIF)을 제공하고, 혈청이 배아 줄기 세포가 분화되는 것을 막는데 필요한 뼈 형성 단백질들(BMPs)을 제공한다는 것이 현재 알려져 있다. 이러한 요소들은 배아줄기세포를 유도하는데 매우 중요하다. 게다가, 배아줄기세포를 분리하는데 여러 마우스 종류가 다른 효율을 보였다. 마우스 배아줄기세포에 대한 현재의 사용은 넉아웃 마우스를 포함하여 유전자 이식 마우스의 발생을 포함한다. 인간 치료를 위해서는, 환자 특이적 만능성 세포가 필요하다. 인간 배아줄기세포의 생성은 어렵고, 윤리적인 문제에 직면한다. 따라서, 인간 배아줄기세포 연구 외에도 많은 그룹이 유도만능줄기세포(iPS cells)의 생성에 중점을 두고 있다.
유도만능줄기세포[편집]
유도만능줄기세포 기술은 2006년 일본 교토의 Shinya Yamanaka의 실험실에서 개척되었으며, 이는 전사인자를 코딩하는 4개의 특정 유전자를 도입하면 성체 세포를 만능성 줄기세포로 전환시킬 수 있다는 것이다. 그는 성숙한 세포가 만능성을 가지기 위해 재프로그램 될 수 있다는 사실을 발견한 John Gurdon과 함께 2012년 노벨상을 수상했다.
2007년에 배아줄기세포와 매우 유사한 만능성 줄기세포가 세 가지 유전자(Oct4, Sox2 및 Klf4)를 분화된 세포에 전달함으로써 생성될 수 있음이 밝혀졌다. 이 유전자의 전달은 분화된 세포를 만능성 줄기 세포로 “재프로그램”하여, 배아 없이 만능성 줄기세포를 만들 수 있게 한다. 배아 줄기 세포에 관한 윤리적인 우려는 전형적으로 종결된 배아에서 유래된 것이므로, 이러한 “유도만능줄기세포”(iPS 세포)로의 재프로그램은 논란의 여지가 덜 하다. 인간과 마우스 세포는 모두 이 방법론에 의해 재프로그램되어 배아 없이 인간 만능성 줄기세포와 마우스 줄기 세포를 생성할 수 있다.
이것은 잠재적으로 세포 대체 요법에 사용될 수 있는 환자 특이적 배아줄기세포주의 생성을 가능하게 할 수 있다. 또한 다양한 유전 질환을 앓고 있는 환자의 배아줄기세포주를 생성할 수 있으며, 이는 연구할 수 있는 귀중한 모델을 제공할 것이다.
그러나 유도만능줄기세포(iPSc) 세포 기술이 빠른 속도로 연속적으로 새로운 치료제로 사용될 수 있다는 첫 번째 징후로, Rudolf Jaenisch이 주도하는 연구팀이 매사추세츠주 케임브리지의 생물 의학 연구소 (Whitehead Institute for Biomedical Research)에서 겸상 적혈구 빈혈증인 쥐를 치료할 수 있다고 2007년 12월 6일 사이언스 저널의 온라인 판에 보고하였다.
2008년 1월 16일, 캘리포니아 기반의 회사인 Stemagen은 성인으로부터 추출한 단일 피부 세포로부터 최초의 성숙한 복제 인간 배아를 만들었다고 발표했다. 이 배아는 배아 줄기 세포와 일치하는 환자를 위해 추출될 수 있다.
세포 배양에 사용되는 시약에 의한 오염[편집]
Nature Medicine의 온라인 판에 2005년 1월 24일 연구를 발표했다. 이 연구는 연방 기금 연구에 사용할 수 있는 인간 배아 줄기 세포가 세포를 성장시키는데 사용된 배지에서 어떤 분자로 오염되었다고 발표했다. 활발하게 줄기세포를 분열시키는 만능성을 유지하기 위해서 마우스 세포와 다른 동물세포를 사용하는 것이 일반적인 기술이다. 샌디에고 캘리포니아 대학의 과학자들에 따르면, 성장 배지에 시알산이 인간의 배아 줄기 세포의 잠재적인 용도를 손상시키는 것으로 밝혀졌다.
그러나, 2005년 3월 8일 Lancet Medical 저널의 온라인 판에 발표된 연구는 완전히 세포와 혈청이 없는 조건하에서 인간 배아에서 유래된 새로운 줄기 세포주에 대한 정보를 상세히 알렸다. 미분화된 증식이 6개월 이상 지속된 후에, 이 세포들은 시험관 및 기형종 모두에서 3가지 배엽의 유도체를 형성할 수 있는 가능성을 증명하였다.
배아줄기세포연구의 생명윤리적 문제점[편집]
인간수정란 및 배아에 대한 연구, 특히 줄기세포를 추출하여 활용하고자 하는 연구는 그 배아의 죽음을 전제로 한다. 배아 자체를 자궁에 착상시키면 온전한 인간 개체로 발전할 수 있기 때문에, 이는 윤리적으로 심각한 물음을 제기한다. 배아의 도덕적 지위가 온전한 인간과 동일하다면, 어떤 경우에도 배아를 활용한 연구나 배아의 사용은 윤리적으로 정당화 되기 어렵다. 수정란 및 배아는 추후 인간으로 발달하기 위한 모든 잠재성(potentiality)을 갖추고 있는 존재이기 때문이다. 그러므로 인간 배아의 생산, 잉여 배아의 연구, 배아로부터의 배아줄기세포 추출을 통한 치료의 시도 모두가 윤리적으로 정당화될 수 없는 것이라는 의견이 있다. 하지만, 배아의 도덕적 지위가 인간과 동등하다고 볼 수 있는가? 만일, 불 속에 배아 20개와 어린 여자아이가 있다면 배아 20개를 구하는 것이 정당화 될 수 있는가? 이는 모순된 결과를 초래한다. 즉, 배아의 도덕적 지위는 인간과 온전히 유사하다고 판단할 수 없다. 포배에서부터 착상된 배아, 태아, 그리고 신생아에 이르기까지 발달상 연속성이 존재한다고 해서 포배와 신생아가 도덕적으로 동일하다는 결론이 성립되지 않는다. 그렇다고 해서 배아를 우리가 원하는 어떤 목적으로든 사용해도 된다는 것은 아니다. 배아를 단순한 사물로 간주한다면 그것이 잠재적인 인간 생명체로서 갖는 의미를 무시하는 것이다. 마땅히 존중받아야 한다는 것이 배아에게 인격을 부여하는 행위는 아니다. 배아가 인격체라는 확신은 도덕적인 이분법에서 유래된 것인데, 모든 것은 존중받을 가치가 있는 인격체이거나 혹은 마음대로 이용할 수 있는 사물로 구분된다는 것이다. 이러한 이원론은 도를 지나친 관점이다. 따라서 배아줄기세포의 연구와 연구용 복제를 무조건 금지할 것이 아니라, 초기 인간의 존엄성을 지키기 위한 적절한 도덕적 규제를 마련하는 것이 바람직하다.
현재 체외수정기술은 일반적으로 받아들여지고 있고, 그 결과 폐기될 운명인 잉여 배아들이 양산되고 있기 때문에 이를 활용한 제한적인 연구에 대한 윤리적인 반감은 비교적 덜하다고 할 수 있다. 물론 종교계 일각에서는 잉여 배아를 양산하는 체외수정기술부터가 윤리적으로 그릇된 것으로 간주하지만, 현실적으로 폐기될 수 밖에 없는 잉여 배아를 인간의 복지와 건강 증진을 위해 연구용으로 활용한다는 데는 꽤 많은 사람들이 동의하고 있으며, 이미 언급한 과학기술부 생명윤리자문위원회의 권고안도 이런 사실을 배경으로 하고 있다. 하지만 연구 등의 응용 목적으로 배아를 창출하는 것은 특정한 목적을 위해 인간을 수단화한다는 강력한 비판을 받을 수 있다. 대부분의 경우에 정자나 난자를 기증하는 목적은 다른 방법으로는 아기를 가질 수 없는 불임부부를 돕는데 있으며, 기증 절차상의 동의 역시 그렇게 한정되어 있으므로 이들을 임의로 활용하여 배아를 창출한다면, 기증자의 의사를 무시하였다는 윤리적인 문제가 발생한다. 배아를 창출하려는 연구의 목적으로 정자나 난자를 기증하는 행위도 받아들일 수 없는데, 이는 정자나 난자 등의 성세포는 그 자체로는 기증자의 신체 일부이고, 이것이 결합하여 수정이 되면 전혀 다른 개체(가 될 잠재성이 있는 존재)이기 때문이다. 기증 받은 성세포를 이용해서 자의적으로 수정란, 혹은 배아를 창출할 수 있다는 생각, 혹은 그런 목적으로 쓰일 것을 알고 생식세포를 기증하는 행위는 현재의 사회적 분위기 하에서는 윤리적으로 정당화되기 어렵다.
체세포 핵치환 기술 이용[편집]
난자의 핵을 제거시킨 후 환자의 체세포를 집어 넣어 분열시켜 만든다. 수정란에서 유래한 배아 줄기세포의 경우 환자에게 이식하면 면역 거부반응을 일으키는 반면, 체세포 핵치환 기술을 이용한 배아 줄기세포를 환자에게 이식하면, 환자의 체세포로부터 만들어진 것이기 때문에, 면역 거부 반응이 일어날 가능성이 매우 적다. 다만, 난자를 제공받기 어려울 뿐만 아니라, 불법적인 방법으로 난자를 획득 할 경우 윤리적 문제가 발생한다. 또한, 체세포 핵치환 기술로 만들어진 배아를 대리모의 자궁에 넣고 착상 시킨다면 인간 복제가 될 가능성도 있다. 참고로, 돌리는 체세포인 젖샘 세포를 핵이 제거된 난자에 넣은 후 대리모의 자궁에 넣어 착상 시킨 후 태어난 체세포 복제 동물이다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원