유도만능줄기세포
유도만능줄기세포 (induced pluripotent stem cell, iPS cell/iPSC)는 체세포에서 유래한 만능줄기세포의 한 종류를 의미한다. 유도만능줄기세포를 만드는 iPSCR(induced Pluripotent stem cell Reprogramming) 기술은 야마나카 신야와 타카하시 카즈토시가 개발했다. 2006년 두 연구자는 4개의 특정 유전자(Oct3/4, Sox2, Klf4, 그리고 c-Myc)를 체세포에 형질도입하여 만능줄기세포로 리프로그래밍하는 것이 가능함을 보여주었다. 이미 성숙하고 분화된 세포를 미성숙한 세포로 역분화시켜서 다시 모든 조직으로 발전시킬 수 있다는 사실을 발견하고 증명한 공로가 인정되어, 야마나카 신야 교수는 존 거든 박사와 공동으로 2012년 노벨 생리학·의학상 수상자로 선정되었다.
만능줄기세포(pluripotent stem cell, PSCs)는 무한정으로 분열하고 태반을 제외한 모든 기관, 조직으로 분화가 가능하다. 따라서 손상이나 질병으로 손상된 세포를 대체하는데 사용될 수 있다. 이러한 만능줄기세포의 대표적인 예시로는 배아줄기세포와 유도만능줄기세포가 있다. 그러나 배아줄기세포의 제작은 착상 전 배아의 파괴(또는 조작)이 필요하다. 이러한 특성은 배아줄기세포의 활용에 대한 논란을 불러 일으켰다.
그러나 유도만능줄기세포는 체세포조직에서 만들어 낼 수 있기 때문에 배아가 필요하지 않으며, 환자 맞춤형으로 제작할 수 있다. 이는 모든 사람이 그들의 만능 줄기세포주를 가질 수 있다는 의미이다. 이러한 특성은 면역거부반응이 없는 이식조직(또는 장기)를 만드는 데 이용할 수 있다. 그러나 유도만능줄기세포가 개발되기 전에는 배아줄기세포를 사용하여야 했고, 난자 역시 필수적으로 사용해야 했다. 비록 유도만능줄기세포로 만들어진 조직(또는 세포, 장기가) 치료에 사용될 정도로 발전되지는 못하고 있다. 그러나 유도만능줄기세포는 개개인별로 맞춤 약물을 개발하고 환자 개개인에 대한 질병을 이해하는데 사용되고 있다.
목차
원리 및 기전[편집]
발생 조절자(master regulator)는 특정 유형의 세포로 특성화 될 때 발현하는 전사인자이다. 이러한 발생 조절자는 세포 특유의 유전자 발현을 조절하고, 본래의 세포 유형으로 다시 되돌릴 수 있는 능력이 있다. 이와 같은 발생 조절 능력은 브리그(Robert Briggs)와 킹(Thomas J King), 고든 (John Gurden, 1962)이 난자에 체세포 핵을 이식하는 것을 통해 발견해 낸 핵 등가성과 발생 능력의 회복을 기초로 발전해 왔다. 포유류인 양에서 핵 이식을 통해 복제에 성공함으로써 난자 세포질 내 물질들의 능력이 재증명 되었다.
2006년 야마나카(Shinya Yamanaka)는 전사인자인 Oct3/4 (Pou5f1), Sox2, c-Myc, Klf4를 생쥐 섬유아세포에 주입하여 포배의 내세포괴와 같은 특징을 갖는 세포를 만들었다. Sox2와 Oct4(Oct3/4)는 Nanog를 활성화하여 다능성을 구축함으로써 분화를 억제하는 다른 전사인자를 활성화한다. c-Myc은 염색사의 구조적 변형을 유도하여 Sox2, Oct4, Nanog가 각 표적 유전자 전사 조절부위에 결합할 수 있게 하다. Klf4는 세포 생존을 유지하는 데 관여한다. 1세대 유도 만능 줄기세포를 만들 때 이용되었던 전사인자 조합의 변화 혹은 배양 조건을 향상시켜 2세대 유도 만능 줄기세포를 만들었으며, 이 세포들을 이용한 키메라의 생산 및 제작 과정에 대한 기준을 제시해 주었다. 유도 만능 줄기세포를 만드는데 생쥐의 경 1-2주, 사람의 경우 3-4주 정도 소요되며, 성공률은 약 0.01에서 0.1% 정도로 낮다. 거의 모든 유형의 세포에서 유도 만능 줄기세포를 만들 수 있는 것으로 알려져 있다.
배아 줄기세포처럼 유도 만능 줄기세포주는 만능적 특성을 갖는 딸세포들로 증식하여 콜로니를 형성하며 염색체 수의 이상 없이 특정 배양 조건하에서 증식한다. 따라서 배아를 사용하지 않고 배아 줄기세포와 같은 분화 능력을 가진 개인별 만능성 줄기세포를 직접 얻을 수 있다. 유도 만능 줄기세포주와 배아 줄기세포는 분화능력에 있어서는 동일한 것으로 알려져 있으나 그 특성에 있어서는 완전히 동일하지 않다. 모든 유도 만능 줄기세포가 서로 동일하지 않은데 그 이유는 유도 만능 줄기세포를 만든 원래 세포의 각인 기억을 유지하고 있기 때문이다. 많은 발생학자들은 이러한 각인 기억을 풀기 위한 노력을 또한 경주하고 있다.
사람의 분화된 세포를 이용한 유도 만능 줄기세포의 제작은 2007년 일본의 야마나카 그룹과 미국의 위스콘신 의대의 톰슨(James Thomson) 그룹에서 발표되었다. 유도 만능 줄기세포를 개인별로 만들 수 있다는 사실은 기적이다. 그 이유는 획기적으로 개인의 발생학적 특징을 정성과 정량적으로 이해 할 수 있는 길을 열었기 때문이다. 이를 바탕으로 현재 의학계에서 다양한 적용 시도들이 경주되고 있다. 그 대표적인 예로, 재생의학 관점의 접근, 질환 병리 연구를 위한 환자 특이 유도 만능 줄기세포주 구축, 질병치료를 위한 환자특이 유도 만능 줄기세포에 유전자 치료 접목, 유도만능줄기세포 유래 특정 유형의 전구세포를 이용한 세포 치료제로의 활용, 유도 만능 줄기세포 유래 특정 유형 세포를 이용한 약물검사, 오르가노이드 제작을 통한 조직이나 기관 이식 등이 있다. 생쥐에서 만든 유도 만능 줄기세포를 그 생쥐에 이식하였을 때 면역 거부반응이 일어나지 않았다.
고든과 야마나카는 핵이식, 난자의 세포질 능력, 유도 만능 줄기세포 형성 등을 통해 발생 조절인자와 재프로그램 등을 밝힌 공로로 2012년 노벨생리의학상을 수상하였다.
만능성의 개념[편집]
만능성 (pluripotency)은 세포가 세포 배양 환경이나 배아 내의 신호에 의해 성체를 구성하는 모든 계통의 세포로 분화할 수 있는 능력이다. 정상 발달 과정을 거치면서 세포들은 처음의 분화되지 않은 상태에서 점차적으로 분화되어 기능이 전문화된 상태로 변화한다. 수정란의 세포들은 전능 (totipotent)한데, 이는 그 세포들이 태반과 같은 배아 이외의 구조 비롯하여 모든 종류의 조직들로 발생할 수 있다는 것을 의미한다. 발달 단계가 진행되면서 배반포 (blastocyst)가 되면, 내부세포괴 (inner cell mass)와 바깥쪽 세포들로 구분 할 수 있는데, 이 때 안쪽의 세포들은 모든 종류의 배아 체세포와 생식세포로 발생할 수 있는 만능성 (pluripotent)을 가진다.
유도만능줄기세포의 장점[편집]
배반포의 내부세포괴에서 추출한 배아줄기세포는 만능성을 가지고 내배엽, 중배엽, 외배엽 세포로 모두 분화가 가능한 세포이다. 인간 배아줄기세포는 파킨슨병, 척수손상, 당뇨 등의 질병을 치료하는 데에 이용될 수 있다고 알려져 있다. 그러나 배아줄기세포는 배아를 파괴한다는 윤리적 문제와 환자의 몸 속에 이식하였을 때 이식거부반응이 일어날 수 있다는 한계가 존재하였다. 그러나 유도만능줄기세포는 수정란에서 발생하고 있는 배아를 파괴해야만 줄기세포를 얻을 수 있는 기존 배아줄기세포 연구의 윤리적인 문제를 한 번에 해결했다는 점에서 큰 의미를 갖는다. 또한 환자의 체세포를 줄기세포로 전환시키므로 면역 거부 반응 문제가 없다는 장점이 있다.
유도만능줄기세포의 유도방법[편집]
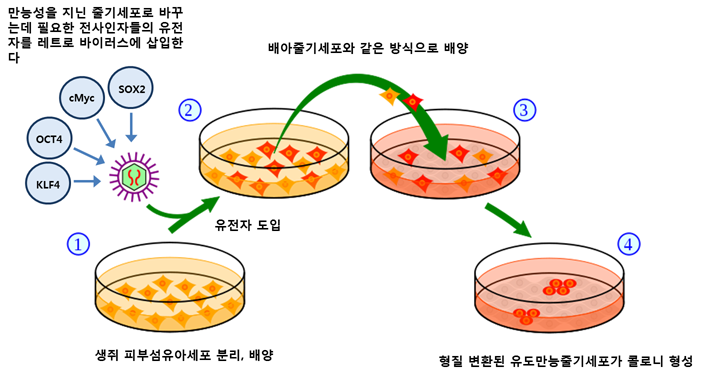
일본 교토대 야마나카 신야 교수팀은 레트로바이러스 (retrovirus)를 이용하여 생쥐의 피부 섬유아세포에 Oct3/4, Sox2, c-Myc, Klf4 유전자를 형질도입시켜 유도만능줄기세포를 만들었다. 야마나카 신야 교수는 체세포에 이 네 가지 전사인자를 발현시켜 만능성을 충분히 유도할 수 있는 것을 밝혔다.
야마나카 교수는 난자에 체세포 핵치환을 하거나 체세포와 배아줄기세포를 융합시켰을 때 세포에 만능성이 유도된다는 것에 기초하여, 배아줄기세포 안에서 만능성을 유지에 중요한 역할을 하는 유전자들이 체세포에 만능성을 유도하는 데에 중요한 역할을 할 것이라는 가설을 세웠다. 그리고 배아줄기세포 안에서 만능성을 유지하게 하는데 중요한 역할을 하는 여러 가지 유전자들 중 24 개의 유전자 (Ecat1, Dpp5(Esg1), Fbx015, Nanog, ERas, Dnmt3l, Ecat8, Gdf3, Sox15, Dppa4, Dppa2, Fthl17, Sall4, Oct4, Sox2, Rex1, Utf1, Tcl1, Dppa3, Klf4, b-cat, cMyc, Stat3, Grb2)를 후보로 선별하였다.
24 개의 유전자를 체세포에 도입하기 전에 생쥐의 피부 섬유아세포의 Fbx15 프로모터 옆에 neomycin/lacZ 유전자를 상동재조합으로 삽입하였다. Fbx15는 만능성을 가진 줄기세포에서 활성화되는 프로모터로써 neomycin/lacZ를 발현하는 유전자는 G418 (단백질합성의 저해에 의해 강력한 세포독성을 나타내는 아미노배당체계 항생물질의 하나)에 저항성을 가진다. 그 다음, 레트로 바이러스를 이용하여 24개의 유전자 모두를 이 생쥐 피부 섬유아세포들에 형질도입 시켰다. 이 세포들을 약 0.3 mg/ml G418이 포함된 STO 지지세포 위에서 배양한다. 유전자가 도입된 세포 중 일부 세포가 생쥐의 배아줄기세포와 유사한 콜로니 (colony)를 형성하는 것을 확인하였다.
24개의 유전자 중 체세포에 만능성을 유도하는 중요한 유전자를을 알아내기 위해, 유전자를 하나씩 없애가며 생쥐 피부 섬유아세포에 형질도입해 유도만능줄기세포를 유도하였다. 이때, 생쥐의 배아줄기세포와 유사한 콜로니가 형성되는 정도를 측정하여 생쥐 피부섬유아세포를 만능성을 지닌 줄기세포로 바꾸는 위해 필요한 네 개의 전사인자 (Oct3/4, Sox2, c-Myc, Klf4)를 찾았다. 이로써 야마나카 교수는 네 개의 전사인자를 사용하여 유도만능줄기세포를 만드는 데 성공하였다.
유도만능줄기세포는 배아줄기세포와 비슷한 성질을 나타낸다는 것을 볼 수 있다. 배아줄기세포와 유도만능줄기세포는 세포의 형태 (morphology)와 발현되는 유전자들의 양상 (RT-PCR, DNA 마이크로어레이를 통해 비교), DNA메틸화 (바이설파이트 게놈서열분석을 통해 비교) 패턴이 비슷하다.
2006년, 생쥐 섬유아세포에 네 개의 전사인자를 도입하여 유도만능줄기세포를 만드는 데 성공한 야마나카 교수는 2007년에 레트로바이러스 시스템을 이용하여 인간 피부 섬유아세포에 네 개의 전사인자 (Oct3/4, Sox2, c-Myc, Klf4)를 형질도입 시켜 인간 유도만능줄기세포 유도에 성공하였다. 같은 해에 제임스 톰슨 교수팀은 렌티바이러스 시스템을 이용하여 야마나카 교수와는 다른 네 개의 유전자 (Oct4, Sox2, Nanog and Lin28)를 도입하여 인간 피부세포로부터 유도만능줄기세포를 만드는데 성공하였다.
유도만능줄기세포를 유도하는 것은 일반적으로 느리고 비효율적인 과정이다. 생쥐 세포의 경우 1 – 2주, 인간 세포의 경우 3 – 4 주가 소요되며 효율성은 약 0.01 – 0.1%이다. 따라서 유도만능줄기세포를 유도하기 위한 시간을 줄이고 효율성을 향상시키기 위해 많은 방법들이 연구되고 있다.
또한, 유도만능줄기세포를 생산하기 위해 섬유아세포를 얻으려면 피부 생검 (biopsy)이 필요하기 때문에 더 쉽게 접근할 수 있는 세포 유형을 식별하려는 노력이 있었다. 2008년에는 하나의 모발을 뽑아서 얻을 수 있는 인간 각질형성세포로부터 유도만능줄기세포가 유도되었다. 2010년에는 말초 혈액 세포로부터 유도만능줄기세포가 유도되었으며, 2012년에는 소변의 신장 상피 세포로부터 유도만능줄기세포가 만들어졌다.
리프로그래밍 (reprogramming)을 위한 시작 세포 유형을 선택할 때 다른 고려사항은 돌연변이 부하 (예: 피부 세포는 UV 노출로 인해 더 많은 돌연변이를 가질 수 있음), 시작 세포 집단을 확장하는 데 걸리는 시간, 특정 세포 유형으로 분화할 수 있는 능력이 있다.
유도 세부 과정[편집]
생쥐의 섬유아세포가 유도만능줄기세포로 진행되는 과정은 유전자들이 순차적으로 활성화되는 일련의 단계를 거친다.
- alkaline phosphatase (AP) → stage-specific embryonic antigen 1 (SSEA1) → endogenous Nanog와 Oct4 유전자
이 중 AP는 네 가지 유전자(Oct4, Sox2, Klf4, c-Myc)를 세포 내에 발현시킨 뒤 3일부터 발현되기 시작하고, SSEA1은 9일부터, 그리고 Oct4와 Nanog는 16일부터 발현되기 시작해 유도만능줄기세포로 변화되게 된다. 따라서 12 - 16일간 동안은 네 가지 유전자의 계속적인 발현이 있어야 완전한 유도만능줄기세포를 형성할 수 있다.
관련 전사인자[편집]
Sox2 (SRY (sex determining region Y)-box 2)[편집]
Sox2 유전자는 만능성을 유지하는데 결정적 역할을 한다. Sox2는 윈트 신호전달 경로를 억제하는 또 다른 유전자 'Dkk1'의 발현을 좌우함으로써 결과적으로 성체줄기세포의 '다분화능(multipotent)'을 유지할 뿐 아니라 특정 세포로의 분화 과정도 조절한다. 이 같은 'Sox2-Dkk1-윈트신호' 체계에 따른 Sox2 유전자의 작용 원리는 성체줄기세포뿐 아니라 배아줄기세포나 유도만능줄기세포에서도 같다. Sox2는 유도만능줄기세포 유도에 사용된 초기 유전자이며, Sox 계열의 다른 전사 인자도 유도만능줄기세포 유도 과정에서 작동하는 것으로 밝혀졌다. Sox1은 Sox2와 유사한 효율로 유도만능줄기세포를 생성하며, 유전자 Sox3, Sox15 및 Sox18도 효율은 떨어지지만 유도만능줄기세포를 생성한다.
c-Myc (Cellular myelocytomatosis oncogene)[편집]
c-Myc 유전자는 세포 증식과 형질전환을 촉진시키는 역할을 한다. 또한 히스톤아세틸전달효소와 관계하여 히스톤을 아세틸화 시켜서 DNA와의 접촉이 느슨하게 함으로써 유전자의 전사억제상태를 완화시킨다. 이를 통해 Oct3/4와 Sox2가 특정한 유전자 위치에 잘 결합하여 전사를 유도할 수 있도록 한다. 그러나 이 유전자는 암 유전자의 일종으로 야마나카 교수가 뒷날 세포를 초기화시키는데 필수적이지 않다는 사실을 밝혀냈다.
Klf4 (Kruppel-like factor 4)[편집]
Klf4는 p53을 직접 억제하는 것으로 알려졌다. p53은 배아줄기세포의 분화과정에서 Nanog를 억제하는 것으로 알려져있다. 유도만능줄기세포는 p53 단백질의 발현이 섬유아세포보다 적다. 그러므로 Klf4는 p53을 억제시키므로써 Nanog를 활성화시키고 배아줄기세포에서 특별히 발현되는 유전자를 활성화 시킬 것이다.
Oct-3/4 (Octamer-binding transcription factor 3/4)[편집]
Oct-3/4 또는 POU5F1 (POU domain, class 5, transcription factor 1)로 알려진 이 전사 인자는 신체에서 POU5F1 유전자에 의해서 암호화된 단백질이다. Oct-3/4는 POU 가계의 호메오 도메인 전사인자이다. 이 단백질은 미분화 된 배아줄기세포의 자가재생에서 중요하게 관련되어있다. 이와 같이, 이 전사인자는 미분화 세포에 대한 마커로서 사용된다. Oct-3/4의 발현은 꼭 통제되어야한다. 너무 많이 혹은 너무 적게 Oct-3/4가 발현되면 미분화 세포가 분화되는 원인이 된다.
Nanog (Homeobox protein NANOG)
Nanog는 만능성을 유지하고 세포 결정 인자를 억제함으로써 유도만능줄기세포를 생성하는 효율성을 높이는 전사 인자이다. H3K27me3와 같은 히스톤 표지를 억제하여 염색질 접근성을 촉진하는 방식으로 작동한다. Thomson 연구팀은 Nanog를 유도만능줄기세포를 유도하기 위한 전사인자 중 하나로 사용하여 유도만능줄기세포를 생성할 수 있음을 확인하였다.
Lin28 (Lin-28 homolog A)
Lin28은 배아줄기세포 및 배아암종세포 (embryonal carcinoma)에서 발현되는 mRNA 결합 단백질이다. Thomson 연구팀은 Lin28이 Oct4, Sox2 및 Nanog와 결합하여 유도만능줄기세포를 생성한다는 것을 입증하였다.
Glis1 (Glis family zinc finger 1)
Glis1은 수정되지 않은 난자와 1세포기 배아에서 높은 발현 양상을 보인다. 야마나카 연구팀은 Glis1이 암유전자인 c-Myc 대신 OSK (Oct-3/4, Sox2, Klf4)와 함께 발현되었을 때, 마우스와 인간의 섬유아세포에서 유도만능줄기세포의 생성을 현저히 향상시키는 것을 확인하였다.
유도만능줄기세포 제작을 위한 여러 방법들[편집]
역분화 인자를 발견한 야마나카 신야 교수는 레트로바이러스를 이용하여 세포에 유전자를 주입하였고 해당 유전자의 과 발현을 통해 역분화가 일어나게 하여 만능성을 얻었다. 그러나, 유전자 도입 시 레트로바이러스를 이용할 경우 바이러스에서 유래된 유전자가 세포에 같이 삽입되어 유전자의 변화를 일으키거나 다른 위험이 발생될 수 있다. 따라서 유전자 내 외래 유전자 삽입을 하지 않는 접근 방법이 고안되었다.
레트로바이러스가 아닌 다른 벡터를 사용한 역분화[편집]
야마나카 신야가 처음 사용한 레트로 바이러스로 인한 암 발생의 위험과 낮은 수율 이라는 문제점을 극복하기 위해 아데노바이러스, 플라스미드, 그리고 naked DNA 또는 단백질 복합체와 같은 대안이 등장하였다. 2008년, 콘라드 호체들링거 박사팀은 역분화에 필요한 전사인자를 아데노바이러스를 통해 마우스의 피부와 간 세포에 도입하였다. 그 결과 피부와 간 세포를 유도만능줄기세포로 만들 수 있었다. 2009년에는 Freed 연구팀이 아데노바이러스를 사용해 인간의 체세포를 유도만능줄기세포로 역분화시키는 방법을 개발하였다. 아데노바이러스는 레트로바이러스와 다르게 숙주의 유전체에 자신의 유전자를 삽입하지 않기 때문에 유전체 삽입으로 인한 돌연변이의 위험을 피할 수 있다. 또한 2008년, 야마나카 연구진은 레트로바이러스 가 아닌 플라스미드를 사용하여 역분화에 필요한 4개의 유전자를 세포에 넣는 방법을 개발하였다. 야마나카 연구진은 c-Myc 유전자를 담은 플라스미드 한 개와 나머지 세 유전자(Oct4, Klf4, Sox2)를 담은 플라스미드 한 개, 총 두 개의 플라스미드를 형질도입하여 마우스 체세포를 역분화 시키는 방법을 개발하였다. 비록 이 방법은 바이러스를 사용하지 않지만, 암 유전자를 포함한다는 문제를 가지고 있다. 또한 레트로바이러스를 사용한 방법에 비해서 역분화 효율이 떨어진다는 단점을 가지고 있다. 또한 간혹 형질도입된 플라스미드가 숙주의 유전체에 삽입되는 경우가 있기에 잠재적인 유전자 삽입에 의한 돌연변이의 위험을 가지고 있다. 레트로바이러스가 아닌 다른 방법은 낮은 역분화 효율을 가지고 있기 때문에, 연구자들은 piggyBac Transposon System이라고 알려진 기술을 사용해 역분화 효율을 높이고자 하였다. 이 방법을 사용하였을 때의 장점은 숙주세포의 유전체에 돌연변이를 일으키지 않으며 효과적으로 필요한 유전자를 전달한다는 점이다. PiggyBac Transposon System은 Transposase 효소를 사용해 외래 유전자를 다시 제거하는 것이 가능하다. 따라서 유전자 삽입으로 인한 돌연변이 우려를 피할 수 있다. 또한 형질도입된 플라스미드를 세포 내의 핵에 삽입하기 위해서 또 다른 나노캐리어인 Xfect를 사용한다. 이 방법을 통해서도 유도만능줄기세포주를 수립할 수 있다.
전사인자를 모방한 화합물을 사용한 유도만능줄기세포로의 역분화[편집]
전사인자를 모방한 화합물을 사용한다면 낮은 효율과 유전체 삽입과 같은 문제를 피할 수 있다. 이 화합물들은 효과적으로 표적 유전자를 발현 시키지 못하는 역분화인자들을 대체할 수 있다. 또한 리프로그래밍을 방해하는 다른 요인을 방해하여 역분화 효율을 높일 수 있다. 이 전략을 가능하게 한 핵심 연구는 Melton 연구진이 발표한 2008년 논문이다. 연구자들은 히스톤 탈아세틸화효소(HDAC, histone deacetylase)의 저해제인 Valproic 산을 처리 하였다. 그 결과 기존 방법에 비해 리프로그래밍 효율이 100배 높아진 것을 확인할 수 있었다. 연구자들은 이 화합물을 사용해 전사인자 c-Myc 의 신호전달경로를 모방하기에 이런 결과가 나온다고 주장하였다. 2008년, Hong Kui deng 박사팀은 세포막의 칼슘채널 활성화와 동시에 히스톤메틸화효소의 저해제를 사용하여 역분화효율을 향상시켰다. 여기서 더 나아가 2013년에는 DZNep이라는 약물을 포함한 7개 약물이 포함된 용액을 사용하여 유도만능줄기세포로의 역분화를 성공시켰다. 특히 2013년의 연구에서는 기존의 역분화 효율과 비슷한 수준의 0.2% 효율을 달성하였는데, 이는 어떠한 유전적인 조작 없이 달성하였기에 큰 의미를 가진다.
단백질을 사용한 유도만능줄기세포로의 역분화[편집]
2009년 4월, 재조합단백질처리를 통해 마우스의 성체세포의 어떠한 유전적 변화 없이 iPSC를 만들어내는 방법이 발표되었다. 이를 개발한 Zhou Hong yan 박사팀은 이 유도만능줄기세포에 piPSCs(protein-induced pluripotent stem cell)이라는 이름을 붙였다.
RNA 분자를 사용한 유도만능줄기세포로의 역분화[편집]
MicroRNA는 mRNA에 상보적으로 결합하는 서열을 가진 짧은 RNA분자를 말한다. 유도만능줄기세포에서 발현되는 microRNA들이 어떤 것이 있으며 얼마나 많이 발현 되는 지를 확인하면 해당 세포의 분화능을 예상하는데 사용할 수 있다. 또한 micro RNA는 유도만능줄기세포로의 역분화잠재력을 높이는 데 사용될 수 있다. 이를 설명하는 여러가지 방법이 제안 되었는데, 배아줄기세포에서만 발현되는 microRNA분자(miR-291, muR-294, miR-295등)는 c-Myc유전자의 다운스트림에 작용하여 iPSC로의 리프로그래밍 효율을 높일 수 있다. 또한 MicroRNA는 4개의 주요 전사조절인자(OCT4, SOX2, Klf4, c-Myc)유전자의 발현을 막는 억제자(suppressor)을 막을 수 있다. 이를 통해 세포 외부에서 도입된 전사인자 없이도 역분화를 일으킬 수 있을 것으로 보인다.
독시사이클린을 사용한 유도만능줄기세포로의 역분화[편집]
유전자 변형 생쥐를 이용하여 유도만능줄기세포를 생산하는 기술이 있다. 이 방법은 역분화인자의 발현이 독시사이클린에 의해 조절되는 세포로부터 만들어진 생쥐를 이용한다. 이렇게 수립된 유도만능줄기세포는 기존의 유도만능줄기세포보다 분화 능력이 뛰어나다고 분석되고 있다. 기존의 방법은 피부세포 1000개에 역분화를 시도하였을 때 그 중 1개가 유도만능줄기세포가 되는 매우 낮은 리프로그래밍 효율을 나타냈다.
STAP(Stimulus-triggered acquistition of pluripotency)세포[편집]
2014년, 하루코 오보타카에 의해 약산성(pH5.7) 용액에 cell을 담가 reprogramming이 가능하다고 주장하는 논문이 셀 (잡지)에 투고 되었다. 동년 4월 1일, 리켄에 의해 연구부정행위가 적발되어 2014년 6월 4일에 논문이 철회되었다. 따라서 이는 iPSC를 만들어 낼 수 없는 방법이다.
STAP을 제외한 여러 역분화 기술의 효율은 아래 표와 같다.
| 방법 | 유전체
삽입여부 |
시간(일) | 효율(%) | 여러 Cell type의 역분화 여부 |
|---|---|---|---|---|
| 레트로바이러스 | Yes | 25–35 | 0.02–0.08 | Yes |
| 렌티바이러스 | Yes | 20–30 | 0.02–1 | Yes |
| 렌티바이러스(miRNA) | No | 18–26 | 10.4–11.6 | No |
| miRNA(직접형질주입) | No | 20 | 0.002 | Yes |
| 아데노바이러스 | No | 25–30 | 0.0002 | No |
| 센다이바이러스 | No | 25 | 0.5–1.4 | Yes |
| mRNA | No | 20 | 0.6–4.4 | No |
| 단백질 | No | 56 | 0.001 | No |
| 에피좀(Episomal) | No | 30 | 0.0006–0.02 | Yes |
| Piggybac | Yes | 14–28 | 0.02–0.05 | No |
| minicircles | No | 14–16 | 0.005 | No |
유도만능줄기세포의 적용[편집]
역분화 기술의 발전[편집]
초기에는 체세포에 유전자를 도입시킬 때 레트로바이러스 벡터를 사용했다. 레트로바이러스 벡터를 사용하기 때문에 도입 시킨 유전자들이 게놈에 무작위로 삽입되어 암을 유발하는 부작용이 있었다. 2008년 야마나카 신야 교수팀은 바이러스 벡터 없이 Oct3/4, Sox2, c-Myc, Klf4를 포함하는 cDNA를 쥐의 체세포에 삽입하여 테라토마 등의 부작용이 없는 유도만능줄기세포를유도하였다. 또한 최근에는 바이러스 시스템 대안으로 저분자 화합물, 단백질, 비바이러스성 비삽입성 벡터(에피솜 벡터) 등을 이용하여, 만능성을 유지하게 하는 유전자들이 체세포의 게놈에 통합되지 않고도 세포 내로 전달될 수 있게 하는 방법을 사용하고 있다. 이러한 역분화 기술들이 개발되고 있으나 바이러스 이용 기법에 비해 현저히 낮은 역분화 효율 문제와 재현성 확보 문제가 지속적으로 제시되고 있다.
체세포가 유도만능줄기세포가 되도록 유도할 때 발암유전자(c-Myc,Klf4)를 레트로 바이러스를 이용하여 도입하기 때문에 암 유발 및 세포기능 변화 가능성이 있다는 위험이 있었다. 하지만 2008년 야마나카 신야 교수팀은 Myc 유전자 없이도 유도만능줄기세포를 만들 수 있는 방법을 개발하였다. 이후 역분화를 유도하는 원로세포를 피부세포가 아닌 내재적으로 Sox2, Myc, Klf4를 발현하고 있는 성체줄기세포인 신경줄기세포를 사용하여 나머지 3개의 인자 중 다른 발암유전자인 Klf4도 없이 역분화 줄기세포를 제작하였고 이후 피부세포 에서도 C-Myc, Klf4를 발현하고 있어서 후속 연구에서 Oct4와 Sox2만으로도 역분화에 성공한 보고가 있다. 이로써 발암유전자를 사용하지 않고 유도만능줄기세포를 만드는 것이 가능하게 되었다.
특정한 종류의 세포들의 만능성을 유도하는 데 있어서, 네 가지 요인(Oct3/4, Sox2, c-Myc, Klf4)보다 더 적은 요인만 있어도 가능하다는 것이 밝혀졌다. 예를 들어, 쥐의 신경 줄기세포를 유도할 경우 오직 Oct4만이 필요하다. 유승권 고려대학교 생명공학부 교수팀은 'Id3' 유전자를 쥐의 체세포에 넣어 일단 신경줄기세포를 만든 뒤, 이를 'Oct4' 유전자만 사용해 만능줄기세포로 유도하였다.
향후 다양한 시장수요에 맞는 품질의 유도만능줄기세포를 만들어내고 그 상용화시기를 앞당기기 위해서는, 먼저 임상적으로 안전하면서 효율이 높은 역분화 기술을 개발하는 것이 필수적으로 선행돼야 한다.
이후 2010년 세계 최초로 배아줄기세포에서 추출한 단백질을 체세포에 주입해 유도만능줄기세포를 만드는 데 성공한 서울대병원 김효수 교수와 의생명연구원 권유욱 교수팀이 2015년 생물재료학 분야의 국제 학술지인 '바이오머티리얼스' 5월호에 실은 논문에는 배아줄기세포가 아닌 iPS에서 추출한 단백질을 체세포에 주입할 경우 역분화 과정의 효율을 크게 향상시킬 수 있다고 한다. 김 교수와의 인터뷰에서 김교수는 "배아줄기세포의 단백질을 주입했을 때보다 유도만능줄기세포에서 추출한 단백질을 주입한 체세포는 유도만능줄기세포로 역분화하는 속도가 10배 이상 빨랐다"고 말했다. 김 교수팀은 이런 효과를 낳는 물질이 유도만능줄기세포 단백질 중 '지스캔4'(Zscan4)란 것도 밝혀냈다. 김 교수는 "이 단백질이 체세포를 젊게 만드는 작용을 하면서 체세포의 리프로그래밍이 훨씬 더 효율적으로 이뤄지도록 했다"고 말했다. 리프로그래밍이란 특정 세포가 어떤 세포로 분화할지 하는 운명을 결정하는 프로그램을 다시 바꾸는 것을 가리킨다.
체세포를 역분화 시키는 것이아닌 성체줄기세포인 신경줄기세포에 역분화를 유도하는 방법이 있다. 이러한 방법을 이용하면 일반적인 체세포인 피부세포가 1000개에 역분화를 유도시켰을 때 그중 1개가 역분화줄기세포가 되는 것과 같이 굉장히 낮은 효율을 보여주는데 성체줄기세포인 신경줄기세포를 역분화를 유도시키면 체세포보다 약 100배에서 3000배 높은 역분화 효율을 나타내었다. 또한 역분화 시간도 체세포의 역분화 시간인 2주에 비해 약 5배 빠른 역분화를 보여주며 높은 효율을 나타냈다. 결론적으로 역분화 유도에 내부적으로 역분화 인자를 발현하는 세포인 성체줄기세포를 사용하면 외부적으로 그 인자를 처리해 주어도 역분화를 유도할 수 있다는 것이다.
줄기세포치료제로써의 유도만능줄기세포[편집]
유도만능줄기세포를 포함한 줄기세포들은 파킨슨병이나 제 1형 당뇨병과 같은 질병으로 인해 손상된 세포들을 대체할 수 있다. 유도만능줄기세포를 이용한 줄기세포치료는 자가이식이 가능하므로 환자가 면역 거부 반응을 일으킬 확률을 낮춘다. 하지만 돌연변이나 다른 유전적인 이상을 일으킬 수도 있다는 문제점들이 있다. 따라서 환자들에게 안전하게 사용되기 위해서 많은 후속 연구가 필요하다.
의학적 연구에 사용[편집]
유도만능줄기세포의 생산 과제는 위에서 언급한 문제 때문에 계속 연구해야 할 주요 절충안은 유전공학적인 장벽에 의존하지 않는 대부분의 방법은 비효율적인 반면, 외부유전자의 도입에 의존하는 방법들은 방대한 기술과 방법이 시도되었지만 불완전한 재프로그래밍과 종양 발생의 문제에 직면하고 있는 실정이다. 또 다른 대규모 전략들은 유도만능줄기세포의 단백질 특성화를 수행하는 것이다. 추가 연구와 새로운 전략은 최적의 해결책을 제시해야 한다. 한 가지 접근방식은 이러한 전략의 긍정적인 측면을 활용하여 유도만능줄기세포에 대한 세포 재프로그래밍을 위한 효과적인 기법으로 결합하려고 시도할 수 있다.
또 다른 접근법은 질환표현형을 구현할 수 있는 치료용 약물을 식별하기 위해 환자로부터 파생된 유도만능줄기세포를 사용하는 것이다. 예를 들어, p63 유전자가 변이되는 EEC(Ectoderal Edysplasia Syndrome)의 영향을 받는 환자로부터 파생된 유도만능줄기세포는 리프로그래밍 요인(OSKM)에 의해 리프로그래밍 되어 역분화줄기세포로 되고, 이를 분화시켜 환자 특이적 맞춤형 세포치료제를 개발할 수 있는데에 의의가 있다.
질환표현형에 적합
체세포를 얻어 유도만능줄기세포를 만들어서 체외에서 분화시킴으로써 여러 가지 질병의 경과를 연구하여 질병 모델을 얻을 수 있다. 현재 다양한 질병에 걸린 환자들로부터 유도만능줄기세포가 만들어져 연구되고 있으며, 이러한 질병 모델들에게서 질환과 관계된 표현형들이 관찰되고 있다. 예를 들어 척수근위축증 환자의 유도만능줄기세포들의 경우, 점진적으로 운동 뉴런이 소실되는 것이 관찰되었다. 알파1-안티트립신-결핍증 환자의 유도만능줄기세포를 간세포로 분화된 이후에 관찰한 결과 지질과 글리코겐의 축적 정도가 증가하였다. 알츠하이머병의 질병모델링에도 유도만능줄기세포가 사용된다.
신약 개발에서의 세포 기반 연구[편집]
유도만능줄기세포들에 기초하여 생체 외에서 분화된 세포들은 신약의 개발과 신약의 안전성 검사에 많이 이용한다. 예를 들어 키네틴의 경우 가족성자율신경실조증의 원인이 되는 IKBKAP 유전자의 비정상적인 이어 맞추기를 부분적으로 정상화한다는 것이 밝혀졌다. 또한 QT 연장증후군에서 베타차단제와 이온채널차단제 역시 표현형을 조절하는 데 효과적이라고 밝혀졌다.
불임치료[편집]
2009년 7월 8일, 영국 뉴캐슬 대학과 뉴잉글랜드 복잡계 연구소(NESCI)의 카림 나예니아 박사 연구팀은 인간 배아줄기세포에서 세계 최초로 시험관 정자를 생산했다. 배아줄기세포는 어떤 종류의 세포로도 분화할 수 있지만 정자로 성장시키는 데 성공한 것은 이들이 처음이다. 그러나 유도만능줄기세포를 이용한 것은 아니다. 이란 출신 카림 나예니아 박사는 독일에서 연구하다가, 독일 정부가 인간 배아줄기세포 연구를 금지시키자, 2006년 영국 뉴캐슬 대학으로 이주해 연구를 계속했다.
2011년 8월 5일, 일본 교토대 사이토 미치노리(齊藤通紀) 교수 연구팀은 세계 최초로 쥐의 체세포를 조작해 유도만능줄기세포로 만들고 다시 조작해 정자를 만들어 체외에서 수정해 새끼 쥐를 출산시키는데 성공했다. 같은 날 셀 지 인터넷판에도 소개되었다. 쥐의 배아줄기세포에서 정자를 만든 것도, 쥐의 유도만능줄기세포에서 정자```를 만든 것도, 정자를 통해 수정 및 출산에 성공한 것도 세계 최초다.
2012년 미국 피츠버그 대학 연구팀이 생식기능이 정상인 남성의 피부세포를 유도만능줄기세포로 환원시켜, 정자전구세포를 만드는데 세계최초로 성공했다.
2014년 5월 1일, 미국 스탠퍼드 대학 줄기세포생물학·재생의학연구소의 레이호 페라 박사는 Y염색체 이상으로 정자가 없는 무정자증 남성의 피부세포를 유도만능줄기세포로 환원시켜 이를 쥐의 고환에 주입, 초기단계의 정자세포인 정자전구세포로 자라게 하는 데 성공했다. 세계최초로 무정자증 남성의 피부로 정자를 만들었다
항노화적 특징
다분화능을 가진 중간엽 줄기세포는 만능성 줄기세포로 유도될 때 노화의 표현형을 늦추거나 되돌릴 수 있는 높은 가능성을 가지고 있다. 이러한 항노화적 특성은 2017년 전 임상 단계에서 입증되었다. 2020년 스탠퍼드 대학 연구진들은 노화가 일어난 쥐를 연구한 후에 야마나카 인자를 주입한 늙은 인간의 세포가 역노화가 일어났고, 젊은 세포와 구분이 불가능한 수준으로 회춘했다고 보고하였다.
인공혈액
헌혈로 얻어지는 혈액 1팩에는 약 2조 개의 적혈구가 있고 전 세계적으로 1억 700만 건 이상의 헌혈이 이루어지고 있지만, 여전히 수혈을 위한 혈액이 부족한 현실이다. 2014년 스코틀랜드 국립 수혈국 (Scottish National Blood Transfusion Serivce)에서는 유도만능줄기세포를 이용하여 O형의 적혈구를 만들었다. 이 세포들은 중배엽으로 유도되었고 차례로 혈구, 적혈구로 분화되었다. 마지막 단계는 이 세포들의 핵을 제거하고 정확하게 성숙되도록 하는 것이었다. O형은 모든 환자에게 수혈할 수 있다. 인간에 대한 임상은 2016년 이전에는 시행되지 않을 것으로 예상된다.
기관 재생
2021년에는 쥐에서 종양이 형성되지 않은 손상된 심장을 재생시키는 데 야마나카 인자 리프로그래밍 기반의 접근법이 시행되었으며 이는 심장 발작이 일어나기 직전 혹은 직후에 이루어질 경우 성공적인 결과를 보였다.
조직 회복
배아의 제대혈 세포는 플라스미드 DNA를 사용하여 만능성 줄기세포로 유도된다. 세포 표면 내피/주변세포 표식인 CD31과 CD146을 사용하여 연구자들은 '혈관 전구체', 즉 고품질의 다분화능 혈관 줄기세포를 식별했다. 유도만능줄기세포가 쥐의 손상된 망막의 유리체에 직접 주입된 후, 성장하고 혈관을 회복시키는 것을 확인했다.
표지된 유도만능줄기세포 유래 신경줄기세포가 뇌 병변을 가진 실험 동물에 주입되었을 때, 이 세포들이 병변이 발생한 부위로 이동하는 것이 관찰되었고 동물의 운동 기능이 개선된 것을 확인하였다.
심근세포
유도만능줄기세포 유래의 심근세포는 화학적으로 정의된 분화 방법을 이용하여 대량으로 생산이 가능하다. 이러한 방법은 일반적으로 심장 발달에 필요한 성장관련 신호전달 경로를 조절한다. 유도만능줄기세포 유래 심근세포는 유전적인 부정맥과 심장 약물 반응을 재현해 낼 수 있다. 왜냐하면 이 세포들은 공여자와 같은 유전적 배경을 보이기 때문이다.
2014년 6월, Takara Bio는 교토대학의 유도만능줄기세포 연구소인 iHeart Japan으로부터 기술 이전을 받았다. 이를 통해 아시아에서 유도만능줄기세포를 심장근육세포로 분화시키는 기술과 특허를 독점적으로 사용할 수 있게 되었다. 이 회사는 심장 질환과 관련된 새로운 약물 개발을 돕기 위해 심장근육세포를 제약 회사와 대학에 판매하겠다고 밝혔다.
2018년 3월 9일, 오사카 대학의 특정 재생의학 위원회 (Specified Regenerative Medicine Committee of Osaka University)는 세계 최초로 유도만능줄기세포를 이용하여 만들어낸 "심장 시트 (Myocardial sheet)"를 중증 심부전 환자의 심장에 이식하는 임상 연구 계획을 공식적으로 승인하였다. 오사카 대학은 같은 날 보건노동복지부에 신청서를 제출했다고 밝혔다.
2018년 5월 16일, 임상 연구 계획이 보건노동복지부에 의해 조건부 승인되었다.
2019년 10월, 오키야마 대학의 한 연구진은 유도만능줄기세포로부터 분화된 심근세포를 이용하여 허혈성 심장 질환 모델을 개발했다.
장기 생성
일본의 연구자들이 보고한 유도만능줄기세포를 이용하여 이식을 위한 인간의 장기를 생성할 수 있다는 개념증명 (proof-of-concept)이 있다. 3가지의 다른 줄기세포에서 인간의 간싹 (Liver buds)을 생성해 냈다. 3가지 줄기세포는 각각 유도만능줄기세포에서 유도된 간세포 (간 기능을 위해); 제대혈에서 얻어낸 내피 줄기세포 (혈관의 내막 형성); 중간엽 줄기세포 (결합조직 형성을 위해)이다. 이러한 새로운 방법은 다양한 세포가 태아의 발달 과정을 모방하여 복잡한 형태인 장기를 형성할 수 있도록 한다. 실험실 내에서 몇일간 성장 후, 간싹은 쥐에 이식 되었고 빠르게 쥐의 혈관과 연결되어 지속적으로 성장했다. 가장 중요한 것은, 이식된 간이 약물을 대사하고 간 특이적 단백질을 생산하는 등 정상적인 간 기능을 수행하였다는 것이다. 추가 연구는 이식된 장기의 수명 (동기화 되거나 탈락을 피하는 능력)과 종양으로 변화하는지 여부를 모니터링 하는 것이다. 이 방법을 이용하면, 한 마리의 쥐에서 얻은 세포를 이용하여 간 질환을 치료하기 위한 1,000가지의 약물을 시험하고 사용되는 동물의 수를 최대 50,000마리까지 줄일 수 있다고 주장한다.
임상 시험
자가 유래의 유도만능줄기세포를 사용한 첫 번째 임상 시험이 2014년 일본 보건부에 의해 승인되었으며 고베의 리켄 발달생물학 센터 (Riken Center for Developmental Biology)가 이를 실시할 예정이었다. 그러나 이 계획은 2015년 11월에 일본의 새로운 재생 의학 법이 시행되어 기존의 지침이 강화되어 법적인 문제가 발생해 중단되었다. 황반변성 (Wet-AMD)를 가진 6명의 환자의 피부 세포로부터 만든 유도만능줄기세포는 망막색소상피(RPE) 세포로 분화가 유도되었다. 이 세포는 퇴행이 일어난 RPE조직을 제거한 망막에 이식될 예정이었다. 안전성 및 시력 복원에 대한 추적은 1~3년 동안 이루어질 예정이었다.
2017년 3월 마사요 다카하시(Masayo Takahashi)의 연구진들은 기증자로부터 얻어낸 유도만능줄기세포 유래 망막 세포를 고도의 황반변성을 가진 사람의 눈에 성공적으로 이식하였다. 그러나 이 환자들이 현재 합병증을 겪고 있다는 보고가 있었다. 자가 유래의 유도만능줄기세포를 사용하는 이점으로는 이론적으로 이식 거부반응의 위험이 없으며 윤리적인 문제점이 없다는 것이다. 하지만 이 실험에 사용된 유도만능줄기세포의 경우 자가 유래가 아닌 다른 사람의 세포로부터 유도된 것으로 밝혀졌다.
유도만능줄기세포를 이용한 새로운 임상 시험은 현재 일본뿐만 아니라 미국과 유럽에서도 진행 중이다. 2021년에 클리니컬트라이얼즈(Clinicaltrials.gov)에 유도만능줄기세포가 언급된 129개의 항목이 있었지만, 대부분 중재되지 않았다.
한계
2006년, 야마나카 연구팀은 체세포에서 다능성을 유도할 수 있는 24개의 유전자를 후보군으로 선정하였다. 이중 Oct3/4 와 Sox2가 유도만능줄기세포의 생성에 필수 인자임을 밝히고, 이전 연구들에서 pluripotency를 유지하는 핵심 전사 인자 중 하나로 알려졌던 Nanog는 실제 리프로그래밍 기전에는 관련이 없다고 보고하였다. 또한 c-Myc 과 Klf4 여시 유도만능줄기세포의 생성에 중요한 역할을 한다는 것을 밝혀냈고, 이 두가지의 종양 관련 인자들은 다른 암유전자들은 다른 암유전자들(E-Ras, Tcl1, ß-catenin, Stat3)로는 대체 불가능하다고 보고하였다.
이후 2007년, Thomson 연구팀은 Yamanaka 연구팀의 실험과 다른 조합(Oct4, Sox2, Nanog, Lin28)을 이용하여 실험을 실행하였는데, 그 결과 기존의 연구에서 리프로그래밍 기전에 관련이 없는 것으로 알려졌던 Nanog 인자가 리프로그래밍의 효율을 높이며 리프로그래밍 된 세포의 초기 생존률을 높이는데 기여하는 것을 밝혔으며, Lin28 역시 유도만능줄기세포의 생성에 관여한다고 보고하였다.
여러 연구에서 유도만능줄기세포의 기본 메커니즘을 분석하고, 기술의 완성도를 높이기 위한 시도들이 이뤄졌지만 유도만능줄기세포는 아직 임상적 적용에 있어 몇 가지 한계점을 가지고 있다. 유전자 도입에 바이러스를 이용한다는 점(integrated iPSCs)과 c-Myc, Klf4 등의 인자가 가지는 tumorigenicity는 유도만능줄기세포의 대표적인 한계점으로 꼽힌다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원