"유기물"의 두 판 사이의 차이
잔글 |
잔글 (→같이 보기) |
||
| (같은 사용자의 중간 판 2개는 보이지 않습니다) | |||
| 63번째 줄: | 63번째 줄: | ||
* [[유기화합물]] | * [[유기화합물]] | ||
* [[무기화합물]] | * [[무기화합물]] | ||
| + | * [[탄수화물]] | ||
| + | * [[단백질]] | ||
| + | * [[아미노산]] | ||
| + | * [[생명체]] | ||
| − | {{ | + | {{물질|검토 필요}} |
| + | {{생물}} | ||
2022년 3월 1일 (화) 16:58 기준 최신판
유기물(有機物, organic matter)은 자연적이고 공학적인, 육상과 수생 환경에서 발견되는 탄소 기반 화합물의 대규모 조직을 가리킨다. 이는 식물이나 동물과 같은 생물의 잔류물과 환경의 폐기물에서 온 유기화합물로 구성된 물질이다. 유기 분자는 생명을 수반하지 않는 화학반응에 의해서도 만들어질 수 있다. 기본 구조는 셀룰로스, 탄닌, 큐틴 및 리그닌과 함께 다양한 단백질, 지질 및 탄수화물로 만들어진다. 유기물은 환경의 영양소 이동에 매우 중요하며 지구 표면의 수분 유지에 중요한 역할을 한다.
상세[편집]
유기물은 탄소 뼈대를 중심으로 여러 입자들이 곁가지로 붙은 물질을 총칭하는 용어이다. 여기서 기(機)라는 한자어는 화학적 관점에서 탄소를 지칭한다.
한편 탄소뼈대에 곁가지로 붙은 입자는 대개 수소이기 때문에, 유기물의 기본구조는 탄화수소(Hydro Carbon) 형태라고 해도 과언이 아니다. 이외에 산소와 질소가 흔하게 붙는다.
유기물을 분류하기 시작하던 아주 옛날에는 유기물이 대개 생물체 내에서만 존재하는 것으로 알았기 때문에 유기물을 Organic compound 라고 불렀다. 그러나 현대에 와서는 유기물이 생물체 밖에서도 흔히 발견됨이 분명해졌다. 따라서 엄밀히 말하면 Organic compound 란 용어는 정확한 표현이 아니라고 볼 수 있다. 다만 생물체 밖보다는 생물체 내에서 훨씬 다양한 종류의 유기물이 존재하기 때문에 Organic compound라는 용어는 아직도 유효하게 사용되고 있다.
- 유기물의 뼈대를 이루는 탄소(C)와 대표적 첨가원소들의 특성
원소의 화학적 성질을 결정하는 것은 최외곽전자의 수, 즉 원자가전자의 수라고 하였다. 그리고 옥텟 규칙에서는 원자번호 20번 내의 물질들에 대해, K껍질에 2개, 다음의 껍질들에는 8개씩을 채워야 안정된다고 하였다. 그렇다면 주요 원소들의 원자가전자 수와 안정성 여부를 살펴보면 수소는 원자가전자가 1개로서, 안정화되려면 전자 1개가 더 필요하다. 탄소는 원자가전자가 4개로서, 안정화되려면 전자 4개가 더 필요하다. 질소는 원자가전자가 5개로서, 안정화되려면 전자 3개가 더 필요하다. 산소는 원자가전자가 6개로서, 안정화되려면 전자 2개가 더 필요하다. 한편 이렇게 안정되지 못하는 원소가 안정화되는 길이란 대개 공유결합을 통해서 이뤄지고, 옥텟규칙을 만족하기 위해 추가로 필요한 전자수는 공유결합의 횟수와 일치한다. 다만 이중공유결합은 2회의 공유결합, 삼중공유결합은 3회의 공유결 합으로 간주한다. 결국
수소는 1회의 공유결합을 하게 되고,
탄소는 4회의 공유결합을 하게 되며,
질소는 3회의 공유결합을 하게 되고,
산소는 2회의 공유결합을 하게 되는 것이다.
- 메탄
탄소가 4회의 공유결합을 하는 경우의 수가 수없이 많을텐데, 가장 단순한 방법을 생각해보면, 다른 네개의 물질들과 네번의 단일 공유결합을 하는 방식이 있을 수 있다.
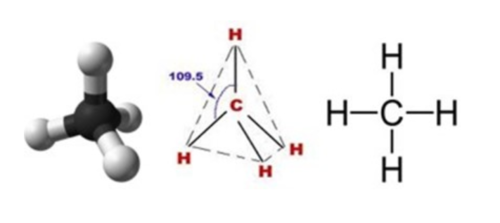
다만 탄소와 결합되는 각각의 물질들도 스스로 안정화되기 위해서 공유결합을 하는 것이므로, 단일 공유결합을 통해서 전 자 한개를 추가로 획득함으로써 안정화되는 물질이어야 한다. 곧바로 수소가 연상되었다면 아주 잘 따라오고 있는 것이다. 이런 구조를 가진 물질을 메탄이라고 부른다. 오른쪽 그림은 메탄의 구조도인데 가운데 짙은 색의 원자가 탄소(C)이고, 주 변의 흰색 원자가 수소(H)이다. 안정적인 피라미드 구조를 취하고 있는 점이 인상적이다. 이러한 구조를 특히 포화구조 (saturated structure) 라고 한다. 화학적으로 매우 안정적이다. 대개 단일 공유결합만을 가지는 탄화수소 화합물이 포화 구조를 취한다.
- 에틸렌
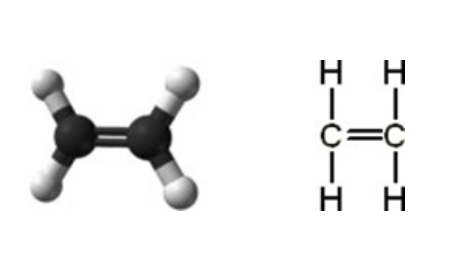
탄소가 4개의 전자를 추가로 획득하기 위한 경우의 수를 한가지 더 들어보면 먼저 탄소가 주변의 탄소와 이중 공유결합을 할 수도 있을 텐데, 이때는 2개의 전자를 획득하게 된다. 따라서 추가로 획득해야 할 전자는 2개만 남는다. 그리고 그 2개의 전자는 2개의 수소와 단일 공유결합을 하면 충족할 수 있다.
이러한 구조를 가진 물질을 에틸렌(or 에텐) 이라고 부른다. 다만 안정적인 피라미드 구조는 아니기 때문에, 이를 특히 불 포화구조(unsaturated structure) 라고 한다. 화학적으로 불안정하다. 대개 다중 공유결합이 존재하는 탄화수소 화합물들이 불포화구조를 가진다.
탄소가 4개의 전자를 획득하기 위한 경우의 수는 엄청나게 많기 때문에 자연계에는 그렇게도 많은 유 기물이 존재하는 것이다.
- 분류
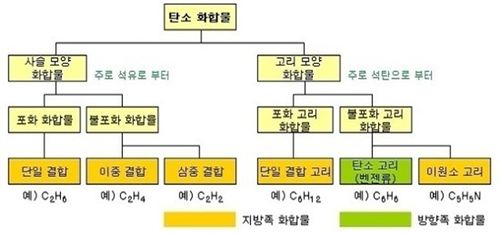
탄소가 4개의 전자를 획득하는 경우의 수를, 일정한 규칙에 따라 분류하면 기본적인 탄화수소 화합물은 탄소뼈대가 길게 늘어선 사슬모양 화합물 (Chain Compound) 과, 탄소뼈대가 순환적으로 연결된 고리모양 화합물(Ring Compound) 로 대별된다.
① 그리고 사슬모양 화합물은 탄소간의 결합에 있어서, 단일 공유결합만 있는 알칸(Alkane), 이중 공유결합도 나타나는 알켄(Alkene), 삼중 공유결합도 나타나는 알킨(Alkyne) 으로 나뉜다.
참고로 알칸에서 수소 한개가 떨어져 나간 것을 알킬(Alkyl) 이라고도 부른다. 수소가 떨어져 나간 부위의 탄소가 전자 한 개를 추가로 필요로 하기 때문에 다른 물질들과 단일 공유결합하여 안정화되려는 속성이 강하다. 즉 화합물의 결합사례에서 알킬이 자주 나온다. 이러한 결합사례의 작명시 알킬부분을 앞에, 결합되는 본체를 뒤에 표기하는게 관행적이다.
② 한편 고리모양 화합물도, 단일 공유결합만 있는 싸이클릭 화합물(Cyclic Compound) 과, 다중 공유결합이 나타나는 아로마틱 화합물(Aromatic Compound) 로 나뉜다.
이들중 알칸, 알켄, 알킨, 싸이클릭 화합물은 대개 지용성 성격을 띈다고 하여 한때 지방족 화합물(Aliphatic Compound) 로 분류하기도 하였다. 그러나 정확한 분류는 아니다. 한편 아로마틱 화합물(Aromatic Compound)은 냄새를 강하게 풍긴다고 하여 방향족 화합물로 번역하고 있다. 그러나 이 또한 정확한 표현은 아니고 관행적으로 사용할 뿐이다.
- 탄화수소 유도체
한편 유기물은 위와같이 탄소 뼈대에 수소가 붙는 것이 가장 기본적인 구조지만, 산소(O), 질소(N), 황(S) 등이 붙을 수 도 있다. 이들을 탄화수소 유도체(Hydro Carbon derivative) 라고 총칭한다. 대체로 이렇게 삽입된 물질들이 탄화수소의 화학적 특성을 결정짓는 경향이 있다.
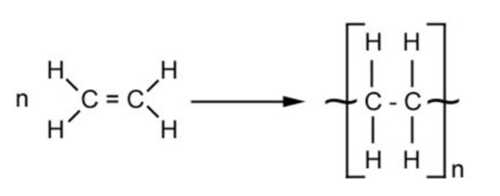
한편 기본적인 탄화수소 화합물이든, 탄화수소 유도체이든, 그 낱개의 화합물 자체로는 단량체(Monomer)라고 부른다. 그리고 이러한 화합물이 수없이 연결되면 중합체(Polymer) 라고 부른다.[1]
각주[편집]
- 이동 ↑ 잡동사니, 〈(12) 유기물의 분류〉, 《네이버 블로그》, 2012-06-26
참고자료[편집]
- 〈유기물〉, 《위키백과》
- 잡동사니, 〈(12) 유기물의 분류〉, 《네이버 블로그》, 2012-06-26
같이 보기[편집]
| ||||||||||||||||||||||

 위키원
위키원