니켈 카드뮴 배터리
니켈 카드뮴 배터리(nickel–cadmium battery, NiCd battery, NiCad battery)는 니켈과 카드뮴을 쓰는 알칼리 축전지이다. 니카드 배터리(NiCad)로도 불린다. 휴대용 전자기기와 장난감에 널리 쓰이며, 알칼라인 전지와 같은 1차전지를 대신해서 쓰이기도 한다. 납축전지보다 무게에 비해 효율이 좋고 수명이 길기 때문에 비행기의 시동을 거는 데에 쓰이고 전기 자동차에도 쓰인다. 그러나 충전식 전지에서 완전 방전되지 않은 채 충전하면 구동시간이 처음보다 짧아지는데, 이런 니켈카드뮴 배터리의 큰 단점으로 인한 사용의 불편과 더불어 니켈 수소 배터리의 출현으로 현재는 사용량이 급격히 줄어들었다.
개요[편집]
니켈 카드뮴 배터리는 전지의 양(+)극에는 수산화니켈(Ni(OH)3), 음(-)극에는 카드뮴(Cd), 전해질로 수산화칼륨(KOH)을 사용하여 양(+)극에서 발생되는 산소가스를 음(-)극에서 소비시키는 충전지이다. 갱내 안전등(坑內安全燈) ·열차점등용 ·통신전원 ·전기차 동력 ·디젤 기관의 시동, 기타 고율방전용 등에 이용된다.
전해액은 20~25% 수산화칼륨 수용액에 소량의 수산화리튬을 첨가한 것이 많이 사용된다. 음·양의 두 극판은 서로 엇갈리게 짜서 니켈을 도금한 강판제, 또는 스티롤 등의 합성수지로 된 전해조에 넣고, 두 극판은 염화비닐 등의 다공판인 세퍼레이터(separator)로 격리한다. 기전력은 1.33~1.35V이며, 보통 20~45℃에서 사용이 가능하다.
충전할 때는 전해액이 감소하므로 물을 보충한다. 전기적으로나 기계적으로 튼튼하여 수명이 길고, 안정하며 보전이 수월한 독립전원으로 그 용도가 넓다. 튜브식은 수명이 가장 길고, 완방전용에 적합하며, 포켓식은 두꺼운 형과 얇은 형이 있는데, 완방전용과 급방전용의 양쪽에 사용된다.
용도는 갱내 안전등·열차점등용·통신전원·전기차 동력·디젤 기관의 시동, 기타 고율방전용 등이다. 근래에는 종래의 것과는 구조가 다른 고성능의 소결식 니켈-카드뮴 전지가 실용되고 있다. 음·양의 두 극판 모두 니켈 분말을 소결해서 얻은 다공성 금속판에 극물질을 스며들게 한 구조이며, 내부저항도 적다. 이 밖에 완전밀폐형도 있으며, 플래시램프·사진 플래시·전기면도기·전기시계·전자기기·라디오·태양전지 조합전원·로켓·미사일 등에 사용된다.
역사[편집]
니켈 카드뮴 배터리(NiCd)는 1899년 스웨덴의 발데마르 융너(Waldemar Jungner)에 의해 발명되었다. 당시 유일한 경쟁자는 납산배터리였는데, 이는 물리적, 화학적 견고성이 낮았다. 첫 번째 프로토타입에 대한 약간의 개선으로 에너지 밀도는 빠르게 증가하여 기본 배터리의 약 절반으로 증가했으며 납산 배터리보다 훨씬 더 커졌다. 융너는 카드뮴을 철로 대체하는 실험을 다양한 양으로 했지만 철 제형(formulations )이 필요하는 것을 발견했다. 융너의 작업은 미국에서 거의 알려지지 않았다. 토머스 에디슨은 1902년 니켈 또는 코발트 카드뮴 배터리 특허를 냈고 융너가 니켈 철 배터리를 만든 지 2년 만에 미국에 선보이면서 배터리 디자인을 채택했다. 1906년 융너는 스웨덴 오스카르샴 근처에 공장을 설립하여 Ni-Cd 배터리를 생산하였다.
1932년에는 다공성 니켈 도금 전극 내부에 활성 물질을 증착하였고, 15년 후 충전 중에 발생하는 가스를 흡수하여 추가 개선이 이루어졌으며, 이로 인해 최신 밀폐형 NiCd 배터리가 탄생했다.
미국에서 첫 번째 생산은 1946년에 시작되었다. 이때까지만 해도 배터리는 니켈과 카드뮴 활성 물질이 함유된 니켈 도금 강철 포켓으로 구성된 '포켓형'이었다. 20세기 중반 무렵, 소결극판 Ni–Cd 배터리가 점점 더 인기를 끌었다. 니켈 분말을 용해 지점보다 훨씬 낮은 온도에서 고압을 사용하여 혼합하면 소결판이 생성된다. 따라서 형성된 판은 부피 기준으로 약 80%가 다공성이다. 양극판과 음극판은 니켈 및 카드뮴 활성 물질을 니켈판에 담아서 생산했다. 소결판은 보통 포켓형보다 훨씬 얇아 볼륨당 표면적이 더 크고 전류가 더 높다. 일반적으로 배터리에서 반응성 물질 표면적이 많을수록 내부 저항이 낮아진다.
수년 동안 Ni-Cd는 양방향 라디오, 응급 의료 장비, 전문 비디오 카메라 및 전동 공구에 선호되는 배터리였다. 1980 년대 후반, 초 고용량 Ni-Cd는 표준 Ni-Cd보다 최대 60% 더 높은 용량으로 세계를 뒤흔들었다. 더 많은 활성 물질을 셀에 패킹하여 이를 달성했지만, 더 높은 내부 저항과 감소된 사이클 수로 인해 이득이 줄어 들었다 .
2000년대 이후, 모든 소비자 Ni-Cd 배터리는 '스위스 롤' 또는 '젤리 롤' 구성을 사용했다. 이 디자인은 원통형 모양으로 롤링된 양극 및 음극 소재의 여러 층이 통합되어 있다. 이러한 설계는 각 셀의 활성 물질과 접촉하는 전극의 양이 많기 때문에 내부 저항을 감소시킨다.
특성[편집]
니켈 카드뮴 배터리의 최대 방전 속도는 크기에 따라 다르다. 일반적인 AA 크기 셀의 경우, 최대 방전 속도는 약 1.8A이고, D크기 배터리의 경우 방전 속도는 3.5암페어까지 높을 수 있다. 모델 항공기 또는 보트 제작자들은 종종 메인 모터 구동에 사용되는 특수 제작된 Ni-Cd 배터리로부터 최대 100A 정도의 훨씬 큰 전류를 소비한다. 매우 작은 배터리에서도 5~6분 정도의 모델 작동이 가능하기 때문에 내연 모터와 비교할 때 상당히 높은 전력 대 중량 수치를 달성할 수 있다. 그러나 현재는 리튬 폴리머 배터리(Lipo)와 리튬 인산철 배터리(LiFe)로 대체되어 에너지 밀도를 더 높였다.
전압[편집]
니켈 카드뮴 배터리의 공칭 전압은 1.2V이다. 이는 1.5V짜리 전지보다 낮다. 하지만 니켈 카드뮴 배터리는 전압이 떨어지지 않는 반면에 대부분의 1차전지는 수명이 다하면서 점점 전압이 약해진다. 많은 전자기기가 전기가 닳은 1차 전지로도 쓸 수 있도록 1.0V 정도의 낮은 전압에서도 동작하도록 되어 있기 때문에 니켈 카드뮴 배터리로도 전자기기를 쓸 수 있다. 낮은 전압에도 불구하고 저항이 작기 때문에 큰 전류를 필요로 하는 휴대용 기기에 적합하다.
9V 배터리를 교체하는 데 사용되는 Ni-Cd 배터리는 대개 6.2V의 단자 전압에 대해 6개의 셀만 가지고 있다. 대부분의 포켓 라디오는 이 전압에서 만족스럽게 작동하지만, Varta와 같은 일부 제조업체는 더 중요한 응용을 위해 7개의 셀로 8.4V 배터리를 만들었다.
충전[편집]
충전은 제조사의 권장사항을 따라야 하겠으나 일부 고성능의 예외적인 경우가 아니라면 다음과 같다.
전용 충전기를 사용하면 이러한 값들을 계산안해도 되나 RC용 충적기 등 다른 충전기를 사용하는 경우에는 기준 값을 참고해야 한다.
- 완속충전 : 14~16시간 동찬 배터리 용량의 1/10의 전류를 흘려 충전하는 방법이다. 예를 들어 2000mah용량이라면 200ma=0.2A로 충전을 한다.
- 고속충전 : 약 1시간 동안 충전하는 것으로 1C충전을 한다. 2000mah용량의 배터리라면 2000ma=2A 충전을 한다.
안전 온도 범위는 -20℃ ~ 45℃이다. 충전 중에는 일반적으로 배터리 온도가 주변 온도와 거의 동일하고 배터리가 완전 충전에 가까워질수록 온도가 45℃~50℃까지 상승한다. 일부 배터리 충전기는 이러한 온도 상승을 감지하여 충전을 차단하고 과충전을 방지한다.
부하가 부족하거나 충전상태가 아닌 경우 니켈 카드뮴 배터리는 20°C에서 약 10%의 자가방전이 일어나며, 높은 온도에서 월 최대 20%의 범위까지 자가 방전된다. 이 방전 속도를 상쇄할 수 있을 정도로 높은 전류 레벨에서 트리클 충전을 수행할 수 있으며, 배터리를 완전히 충전된 상태로 유지할 수 있다. 그러나 배터리를 장기간 사용하지 않고 보관하려면 최대 용량의 40%까지 방전시켜야 한다(일부 제조업체는 완전 방전 및 단락을 권장한다). 서늘하고 건조한 환경에서 보관해야 한다.
과충전[편집]
밀폐된 니켈 카드뮴 배터리는 물과 재결합할 수 있을 때까지 산소와 수소 가스를 포함하는 압력 용기로 구성된다. 이러한 생성은 일반적으로 급속 충전 및 방전 중 과충전 상태에서 발생한다. 압력이 안전밸브 제한치를 초과하면 가스 형태의 물이 손실된다. 용기는 정확한 양의 전해질을 포함하도록 설계되었기 때문에 이 손실은 전지의 용량과 전류를 받고 전달하는 능력에 빠르게 영향을 미친다.
장점[편집]
- 적절한 유지 보수로 견고하고 높은 사이클 수
- 스트레스가 거의 없이 초고속 충전이 가능한 배터리
- 우수한 부하 성능; 남용되는 경우 용서
- 긴 저장 수명; 방전 된 상태로 보관할 수 있으며 사용 전에 프라이밍이 필요하다.
- 간단한 보관 및 운송; 규제 통제 대상이 아님
- 우수한 저온 성능
- 경제적 가격; NiCd는 사이클 당 비용 측면에서 가장 낮다
- 다양한 크기와 성능 옵션으로 제공된다.
단점[편집]
- 새로운 시스템에 비해 상대적으로 낮은 비 에너지
- 메모리 효과: 주기적인 완전 방전이 필요하며 재생 될 수 있다
- 카드뮴은 독성 금속이므로 매립지에 폐기 할 수 없음
- 높은 자체 방전: 보관 후 재충전 필요
- 1.20V의 낮은 셀 전압은 고전압을 달성하기 위해 많은 셀이 필요하다.
전기화학 반응[편집]
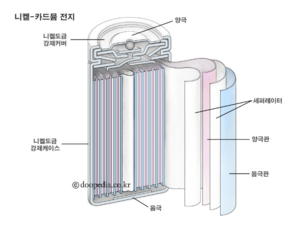
니켈 카드뮴 배터리는 수산화니켈로 된 양극, 수산화카드뮴으로 된 음극, 분리막, 알칼라인 전해질로 되어 있다.
니켈 카드뮴배터리에는 일반적으로 자체 밀봉 안전 밸브가 장착된 봉인 플레이트가 있는 금속 케이스가 있다. 양극 및 음극 전극 플레이트는 분리기에 의해 서로 분리되어 케이스 내부에 나선형으로 롤링된다. 이것은 젤리 롤 설계로 알려져 있으며, 니켈 카드뮴 배터리가 동일한 크기의 알칼리성 전지보다 훨씬 높은 최대 전류를 전달할 수 있게 해준다. 알칼리성 전지은 보빈 구조를 가지고 있으며, 셀 케이스가 전해질로 채워져 있고 양극 전극으로 작용하는 흑연 로드를 포함하고 있다. 전극의 비교적 작은 면적이 전해액과 접촉하므로(젤리 롤 설계와는 달리), 동일한 크기의 알칼리성 배터리에 대한 내부 저항이 높아져 전달할 수 있는 최대 전류를 제한한다.
니켈 카드뮴 전지에서 일어나는 화학 반응은 다음과 같다.
- 방전 중 카드뮴 전극의 화학반응 : Cd + 2OH⁻ → Cd(OH)₂+2e⁻
- 니켈 산화물 전극 반응 : 2NiO(OH)+2H₂O + 2e⁻ → 2Ni(OH)₂ + 2OH⁻
- 방전 시 순 반응 : 2NiO(OH) + Cd + 2H₂O ↔ 2Ni(OH)₂ + Cd(OH)₂'
전지가 방전될 때 왼쪽에서 오른쪽으로 가는 반응이 일어나고, 전지를 충전하면 오른쪽에서 왼쪽으로 가는 반응이 일어난다. 알칼라인 전해질(보통 수산화칼륨)은 이 반응에서 소비되지 않는다.
향후 전망[편집]
니켈 수소 배터리나 리튬이온 배터리이라는 새로운 2차전지의 등장으로 고용량의 측면에서는 니켈 카드뮴 전지의 성능은 저하되지만 전지에서 요구되는 성능은 고용량만이 아니다. 새로운 계통의 전지는 대전류 방전, 온도 특성, 긴 수명 등에서 니켈 카드뮴 배터리 정도의 특성을 얻을 수 없다. 현재 전지의 용도가 다양화되고 요구되는 특성도 다종다양하여 니켈 카드뮴 배터리가 아니면 사용할 수 없는 용도도 있다.
- 동력용도(요구특성: 고출력, 장 수명, 고신뢰성)
- 어시스트 자동차, 전동차 의자, 스쿠터, 카트, 소형 전동 리프트 등
- 스탠드바이 용도(요구 특성 : 연속충전, 고신뢰성)
- WILL(Wireless Local Loop: 전화 회선용 백업), UPS 시큐리티, POS 기기 등, SOHO 수요가 기대되는 가운데, 긴 수명, 고신뢰성이 보다 더 요구될 뿐 아니라 소형/경량화/긴수명/대전 방전특성/온도특성이라는 요구사항이 많아지고 있어 니켈카드뮴
전지의 사용 보편화 되고 있다.
- 태양전지와 변용 기기(요구특성: 과혹한 환경온도에 견딜 수 있는 온도 특성)
- 셔터, 방범등, 표시등, 태양전지와 조합은 한 여름 고온이나 한 겨울의 영하의 온도에 대해 니켈카드뮴 전지는 온도 내구성에 적합성이 있다.[1]
각주[편집]
- ↑ 〈니켈-카드뮴 전지(Ni-Cd, 니카드 전지)〉, 《자동차 산업 전문 포털》,
참고자료[편집]
- "Nickel–cadmium battery", Wikipedia
- 〈니켈-카드뮴 전지〉, 《위키백과》
- 〈니켈-카드뮴전지〉, 《네이버 지식백과》
- 〈니켈-카드뮴 전지〉, 《사이언스올》
- 〈니켈-카드뮴 전지(Ni-Cd, 니카드 전지)〉, 《자동차 산업 전문 포털》
같이 보기[편집]

 위키원
위키원