계면
계면(界面, interface)은 기체상, 액체상, 고체상 등의 3상 중 인접한 2개의 상(相)사이의 경계면이다. 흡착이나 분자의 배향 등, 특유한 현상이 나타난다.
물질은 기체상·액체상·고체상 등 3상이 있는데, 이들 중 2개의 상 사이에 생기는 경계면을 계면이라고 한다. 계면 중 한쪽 상이 기체상일 때는 액체의 표면 또는 고체의 표면과 같이 표면이라는 말을 사용하는 경우가 많다. 계면은 기하학적 표면이 아니라 서로 접하는 두 상의 성질이 이행하는 극히 얇은 물질의 엷은층에 해당한다. 이 부분에서는 흡착이나 분자의 배향 등 특유한 여러 현상과 물질 등 특유한 성상이 나타난다. 어떤 양의 물질이 다른 상과 접하는 계면의 크기는 그 물질이 세분화될수록 커진다. 또, 보통 크기의 물질의 경우, 그 계면의 자유에너지는 다른 에너지에 비하여 문제가 되지 않을 정도로 작으나, 크기가 100Å, 즉 콜로이드 차원의 크기가 되면, 계면의 자유에너지는 무시할 수 없을 정도로 커진다. 따라서 콜로이드의 계면은 큰 의의를 가진다.
개요[편집]
계면(界面)은 한 균일한 액체와 고체의 위상이 다른 균일한 상과 접하고 있는 경계이다.
계면은 서로 다른 물질 또는 서로 다른 물리적 상태의 물질이 차지하는 두 공간 영역 사이의 경계이다. 물질과 공기 또는 물질과 진공 사이의 경계면을 표면이라고 하며 표면 과학에서 연구한다. 열평형에서 접촉하는 영역을 상(phases)이라고 하고 경계면을 상경계(phase boundary)라고 한다. 평형을 벗어난 계면의 예는 다결정질 물질의 입자 경계이다.
계면의 중요성은 시스템 유형에 따라 다르다. 몫(quotient) 영역/부피가 클수록 계면의 효과가 커진다. 결과적으로 계면은 콜로이드와 같이 계면 면적 대 부피 비율이 큰 시스템에서 매우 중요하다.
계면은 평평하거나 곡선일 수 있다. 예를 들어 샐러드 드레싱의 기름 방울은 구형이지만 물 한 잔의 물과 공기 사이의 경계면은 대부분 평평한다.
표면 장력은 액체와 관련된 계면 프로세스를 지배하는 물리적 특성이다. 평평한 표면의 액체 필름의 경우 액체-증기 계면가 평면을 유지하여 계면 영역과 시스템 자유 에너지를 최소화한다. 거친 표면의 액체 필름의 경우, 표면 장력은 메니스커스를 평평하게 유지하는 경향이 있는 반면 분리 압력은 필름을 기판에 등각으로 만든다. 평형 메니스커스 모양은 모세관 압력과 분리 압력 사이의 경쟁 결과이다.
계면은 굴절과 같은 다양한 광학 현상을 일으킬 수 있다. 광학 렌즈는 유리와 공기 사이의 경계면을 실용적으로 적용한 예이다.
하나의 국소 계면 시스템은 에어로졸과 다른 대기 분자 사이의 기체-액체 계면이다.
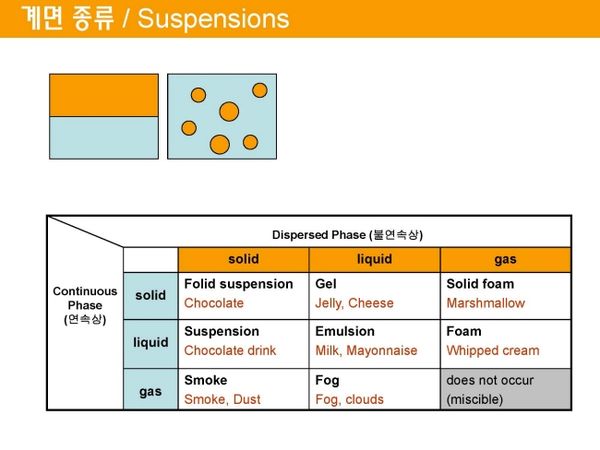
계면 종류[편집]
계면활성제[편집]
계면이란 기체와 액체, 액체와 액체, 액체와 고체가 서로 맞닿은 경계면이다. 계면활성제란 이런 계면의 경계를 완화시키는 역할을 한다. 이 때문에 계면이 가지고 있던 표면장력은 약해진다. 하나의 분자 내에 친수성과 친유성을 가진 화학적 구조를 지니고 있다.
계면활성제는 세제 용도에 많이 사용되는 것외에도 식품과, 화장품의 유화제, 보습제로도 많이 사용되고 있다. 계면활성제는 약간의 화학구조를 변형시킨 것만으로도 특성이 크게 달라져 종류도 다양하다. 대체로 계면활성제는 물에서 해리되었을 때 친수성 부분의 전하에 따라 음이온성, 양이온성, 양쪽성, 비이온성, 특수계면활성제로 분류할 수 있다.
전고체 배터리 전극-전해질 계면[편집]
전고체 배터리는 크게 두 가지 종류, 무기 고체 전해질 배터리(Inorganic solid electrolyte battery)와 유기 고체 전해질 배터리(Organic solid electrolyte battery)로 나뉜다. 여기서 무기 고체 전해질 배터리는 다시 황화물계(sulfide-base)와 산화물계(oxide-base)로 나뉜다.
먼저 무기 고체 전해질의 한 종류인 황화물계 전해질은 황(sulfur)을 포함하고 있다. 황화물계 전해질은 리튬 이온 전도도가 10-2~10-3S/cm로 높고, 물리적인 힘에 대한 유연성이 좋아 전극과 접촉 계면(interface)을 쉽게 형성한다. 접촉 계면은 극과 전해질이 만나는 경계면을 뜻한다. 이는 전기 화학적 반응이 일어나는 부분이기 때문에 전지 제조에 있어 중요하게 여겨진다. 황화물계 전해질의 경우, 접촉 계면 형성에 용이하기에 적은 힘으로도 쉽게 극과 전해질을 접촉시킬 수 있고, 따라서 공정이 간단해진다는 장점이 있다. 한편, 황은 공기 중의 수분과 쉽게 반응하여 유해 기체인 황화수소(Hydrogen sulfide)로 변화하여 공기 중 안전성이 낮다. 또한 양극과의 경계면에서 공간이 생겨 높은 저항을 가진다는 단점을 가지기도 한다.
다음으로 무기 고체 전해질의 두 번째 종류인 산화물계 전해질은 전해질의 성분에 산소(Oxygen)가 포함되어 있다. 따라서 산소가 포함된 대기 중 안정성이 높고, 리튬 이온 전도도가 10-3~10-4S/cm 수준으로 준수한 편이다. 하지만 양극과 전해질 사이의 저항(Interfacial resistance)이 크고, 접촉 계면 형성이 어려워 공정이 상대적으로 복잡하다는 단점이 있다.
마지막으로 유기 고체 전해질은 앞서 소개한 무기 고체 전해질과는 사뭇 다른 특성을 가진다. 계면에서 높은 저항을 가진 두 무기 고체 전해질과는 달리 유기 고체 전해질은 전극 계면과의 밀착성이 우수해 경계면에서의 저항이 상대적으로 낮다는 장점을 가진다. 하지만 무기 고체 전해질에 비해 리튬 이온 전도도가 낮고, 고온에서만 사용할 수 있어 사용 환경에 영향을 크게 받는다는 한계점이 존재한다. 이렇게 전고체 배터리는 비교적 높은 안정성과 공간 효율성을 지니고 있지만, 각 전해질의 종류에 따라 한계점 또한 존재하기 때문에, 조금 더 연구가 필요한 단계에 있다.[1]
동영상[편집]
각주[편집]
- ↑ 최건우, 〈2-전기차 배터리의 진화〉, 《포스테키안》, 2021-04-30
참고자료[편집]
- 〈계면〉, 《두산백과》
- 〈계면〉, 《위키백과》
- 〈계면활성제〉, 《위키백과》
- 〈계면이란? 계면의 종류〉, seehint.com
- 최건우, 〈2-전기차 배터리의 진화〉, 《포스테키안》, 2021-04-30
같이 보기[편집]

 위키원
위키원