알칼리전지
알칼리전지(alkaline battery)는 전해액으로 수산화칼륨을 사용하는 전지이다. 정식 명칭은 알칼리 망가니즈 전지(알칼리 망간 전지)이다. 알칼라인 전지 또는 알카라인 전지라고도 한다. 납축전지에 비해 진동에 강하고 자기방전이 적으며 열악한 주위 환경에서도 오래 사용할 수 있는 장점이 있다. 그러나 암페어 시효율(방전한 전기량과 충전한 전기량의 비율)이 낮고 가격이 비싼 것이 단점이다. 산화은전지와 비교하면 에너지밀도가 낮고 수명이 짧지만 저렴하다. 기본적으로 새 알칼리 전지는 1.5V 정도의 전압을 낸다. 여러개를 직렬연결해서 사용하면 더 큰 전압을 얻을 수 있다. 대부분의 알칼리 전지는 충전이 불가능하지만, 일부는 충전이 가능하도록 설계되었다. 만약 충전이 가능하지 않은 알칼리전지를 충전하려고 하면 전지가 파열돼서 독성물질이 흘러나올 가능성이 있다.
개요[편집]
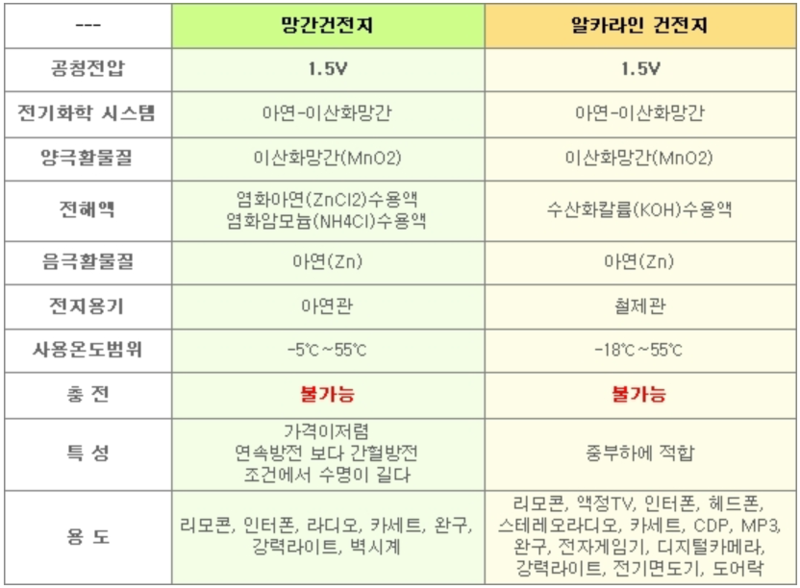
알칼리전지는 아연 망간 건전지와 비슷하지만 염화암모늄 대신 수산화칼륨을 전해질로 사용한다는 점이 크게 다르다. 알칼리전지의 전지식은 다음과 같다.
(-) Zn | KOH | MnO₂ , C(+)
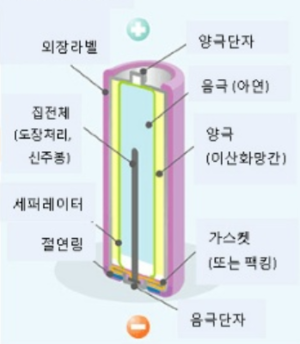
알칼리 전지는 (-)극인 아연이 분말 형태로 전지의 중심부에 있고 아연을 수산화칼륨의 전해액이 에워싸며 그 바깥쪽에 (+)극인 이산화망가니즈를 둔다. 아연을 분말 형태로 한 것은 전해액이 닿는 표면적을 최대한 크게 하기 위한 것이며, 이런 이유로 내부 저항이 낮아서 그만큼 큰 전류를 출력할 수 있는 용도에 적합하다.
내부 저항이 낮은 것 외에도 아연이 산성보다 염기성 용액에 덜 부식되기 때문에 아연-탄소건전지보다 수명이 더 길고, 저장 특성이 망간 전지에 비하여 뛰어나며, 전지가 소모되어도 기전력은 그다지 저하하지 않는 특성이 있다. 아울러 전지는 사용할 때 전압이 조금씩 변하는데, 알칼리 전지는 전압의 변화가 적다. 하지만 알칼리 전지는 1차 전지이므로 충전하면 매우 위험하다. 특히 전원을 연결하면 내부에 있는 고농도의 수산화칼륨 용액이 유출되어 피부에 화상을 줄 수 있을 뿐만 아니라 기기에 악영향을 끼칠 수 있다.
발명[편집]
1868년 프랑스의 조르주 르클랑셰(Georges Leclanché, 1839~1882)는 망간산화물과 아연을 각각 양극과 음극으로 사용하고 전해액을 채워 전지를 구성했다. 이것이 현재의 아연-망간산화물전지(망간건전지)의 초기 작품이다. 초기에는 전해액이 수용액 상태인 습전지였으나, 1877년에 전해액을 석고 등으로 굳혀 액이 새지 않도록 해 마른 전지, 건전지를 만들었다. 망간건전지는 제조가 쉽고 안정성이 높으며 가격도 싸다. 주 재료인 이사화망간도 구하기 쉽다. 이런 이유로 망간건전지는 100년 이상 범용 전지로 사용됐다. 그러나 수명이 월등하게 긴 알칼리전지가 나오면서 차츰 빛이 바랬다. 망간건전지를 밀어낸 주인공은 알칼리전지다. 흔히 알카라인건전지라 부르는 것으로, 기존의 망간건전지와 동일한 물질을 사용한다. 단지 전해액으로 강 알칼리성 용액인 수산화칼륨용액을 사용하는 점이 망간건전지와 다르다. 알칼리전지에 대한 최초의 언급은 1882년 독일의 로익스(G. Leuchs)가 특허를 획득하면서 부터이다. 최초의 알칼리전지는 1959년 미국 에버레디전지회사(에너자이저의 전신)의 루이스 어리(Lewis Frederick Urry, 1927~2004)가 발명했다. 알칼리전지의 수명이 망간건전지의 수명보다 3~8배 정도 길다. 알칼리전지의 형태는 다양한 전자제품에 알맞게 큰 원통형부터 손가락 크기의 작은 것까지 각양각색이다.
1942년에는 단추전지라 불리는 작고 납작한 모양의 수은전지가 개발됐다. 양극에 산화수은, 음극에 아연, 전해액으로 수산화칼륨의 수용액이 사용된다. 아연 음극을 사용하는 전지 가운데 가장 에너지밀도가 높고, 전지 용량이 커 상대적으로 오랜 시간 사용이 가능하다. 또 수은 때문에 사용 중 전압이 일정하게 유지되므로 손목시계, 전자계산기, 보청기 같은 소형 전자기기의 주요 전원으로 사용됐다. 최근에는 수은이 환경오염 물질로 인식돼 수은 대신 산화은을 사용한다. 명칭도 산화은전지로 바뀌었다.[1]
원리[편집]
알칼리 전지의 음극은 내부에 아연 분말 전극이 연결되어 있고, 양극은 이산화망가니즈 전극으로 이루어져 있다. 반쪽반응은 다음과 같다
Zn (s) + 2OH⁻ (aq) → ZnO (s) + H₂O (l) + 2e⁻
2MnO₂(s) + 2H₂O (l) + 2e⁻ → 2MnO(OH) (s) + 2OH⁻ (aq)
전지를 기기에 연결하면 전지 내부에서 산화‧환원 반응이 진행된다. 아연 전극은 산화아연 전극으로 변하는 산화반응이 일어나며, 이산화망가니즈 전극은 삼산화이망간 전극으로 변하는 환원반응이 일어난다.
종류[편집]
극판에 사용하는 금속의 종류에 따라 나뉜다
- 에디슨 전지 : 양극에 수산화니켈, 음극에 철 사용.
- 융그너 전지(니켈 카드뮴 배터리) : 양극에 니켈, 음극에 카드뮴 사용. 일반적으로 사용된다. 카드뮴 음극의 전위가 수소의 전위보다 낮아서 카드뮴 전극이 전해액에 대해 완전히 불활성으로 된다. 따라서 유동전류가 아주 낮고 순간적인 방전에 유리하며 안적적으로 최대방전상태를 유지한다.
각주[편집]
- ↑ jin2227kr , 〈전지가 너희를 자유롭게 하리라〉, 《네이버블로그》, 2010-08-04
참고자료[편집]
같이 보기[편집]

 위키원
위키원