용융염 배터리
용융염 배터리(Molten Salt Battery)는 용융염 즉 액체 염화나트륨(소금)을 전해질로 사용하는 배터리이다. 열전지나 액체 금속 배터리라고도 불린다. 본래 2차 세계대전 중 독일 과학자 게오르크 오토 에르프에 의해 발명되었는데, 당시에는 재충전이 불가능한 열전지로, 전지에 500도 이상의 열을 가하여 전해질 역할을 하는 소금과 애노드 역할을 하는 금속, 캐소드 역할을 하는 금속이 액화되면서 에너지를 방출하는 방식이었다. 이런 방식의 열전지는 주로 알루미늄 제련 공장에서 사용되는데, 이는 열전지가 막대한 에너지 밀도를 지닌데다 고압의 전력을 출력해낼 수 있어 알루미늄 전기분해 제련법에 사용되기에 적합하였기 때문이다. 이외에 유도미사일 탑재용 전지로 사용되기도 한다.
재충전이 가능한 용융염 배터리는 1960년대부터 연구되고 있었다. 배터리용 소금의 용융점은 98도로 사실 그리 높은 온도가 아니기에, 애노드와 캐소드 역할을 하는 금속만 잘 찾는다면 상대적으로 낮은 온도에서도 작동이 가능한 전지를 개발할 수 있다. 즉 충전 및 방전 과정에서 발생하는 열만으로도 소금의 액체상태를 유지할 수 있게 하면 되는 것이다. 특히 태양광 발전의 대중화로 고용량의 전력을 저장할 수 있는 배터리 기술의 필요성이 대두되는 상황에서 용융염 배터리는 이에 대한 해법이 될 수 있다. 실제로 MIT에서 상용화가 가능한 용융염 배터리의 개발에 성공하였다. 현재 기술로 컨테이너 박스 크기만한 공간에 2MWh의 전력(약 200가구가 사용가능한 전력)을 저장할 수 있다.
액체금속이라는 이름에서도 알 수 있다시피 애초에 휴대성이 아닌 경제성과 에너지 밀도에 초점을 맞춘 전지이다.
목차
개요[편집]
사이드와인더, 토우, 토마호크, 패트리어트, 현궁 등의 미사일에는 용융염 배터리를 사용한다. 용융염은 소금을 녹인 것을 의미한다. 용융염 배터리는 열전지 (Thermal battery)의 한 종류이다. 용융염 배터리는 용융염을 고열로 점화시키면 전기가 발생하는 배터리이다. 용융염 배터리는 50년 이상 보관이 가능하고 짧은 시간에 고전력 출력이 가능한다. 용융염 배터리는 2차 세계대전 동안 독일에서 연구되었고 전후 미국의 근접신관과 원자폭탄 등에 사용되었다.[1]
충전식 구성[편집]
1960년대 중반 이후 음극 전극에 나트륨(Na)을 사용하는 충전식 배터리에 대한 많은 개발 작업이 수행되었다. 나트륨은 -2.71V의 높은 환원 잠재력, 저 체중, 무독성, 상대적 풍부함, 가용성 및 낮은 비용 때문에 매력적이다. 실용적인 배터리를 만들기 위해서는 나트륨이 액체 형태여야 한다. 나트륨의 용해점은 98°C(208°F)이다. 즉, 나트륨 기반 배터리는 245~350°C(470~660°F)의 온도에서 작동한다. 연구에 따르면 200 °C(390 °F)의 작동 온도와 상온의 금속 조합을 조사했다
나트륨 황산염[편집]
나트륨 황 배터리(NaS 배터리)와 관련된 리튬 황 배터리는 저렴하고 풍부한 전극 물질을 사용한다. 그것은 최초의 알칼리 금속 상업용 배터리였다. 양극에 액체 유황을 사용했고 베타-알루미나 고체 전해질(BASE)의 세라믹 튜브를 사용했다. 절연체 부식은 점차 전도성을 띠면서 자가 방전 속도가 증가했기 때문에 문제가 되었다.
NaS 배터리는 높은 특정 전력 때문에 우주 응용 분야에 제안되었다. 우주용 NaS 배터리는 1997년 우주왕복선 임무 STS-87에서 성공적으로 테스트되었지만, 우주에서는 배터리를 사용하지 않았다. NaS 배터리는 금성의 고온 환경에서 사용하기 위해 제안되었다.
도쿄전력과 NGK에 의해 결성된 컨소시엄은 1983년 NaS 배터리 연구에 대한 관심을 선언하고 이후 이러한 유형의 개발의 주요 동인이 되었다. 도쿄전력은 모든 부품 요소(나트륨, 황, 세라믹)가 일본에 풍부하기 때문에 NaS 배터리를 선택했다. 1993년과 1996년 사이에 도쿄전력의 쓰나시마 변전소에서 3 × 2 MW, 6.6 kV 배터리 뱅크를 사용하여 최초의 대규모 현장 시험이 실시되었다. 이 실험의 결과를 바탕으로, 개선된 배터리 모듈이 개발되었고 2000년에 상업적으로 이용 가능하게 되었다. 상용 NaS 배터리 뱅크는 다음을 제공한다.
- 용량: 뱅크당 25~250kWh
- 효율성 87%
- 100% 방전 깊이(DOD)에서 2,500 사이클의 수명 또는 80% DOD에서 4,500 사이클의 수명
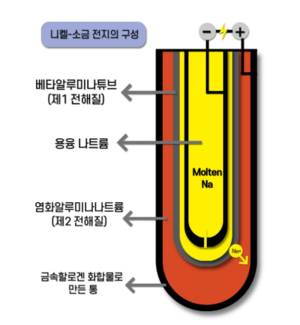
니켈 염화나트륨(소금) 배터리[편집]
용융염 배터리의 저온 변형은 1985년 ZEBRA(원래 Zeolite Battery Research Africa, 나중에 Zeolite Battery Research Africa) 배터리를 개발한 것이었으며, 원래 전기 자동차용으로 개발되었다. 배터리는 NaAlCl₄와 Na+-beta-alumina 세라믹 전해액을 사용한다.
니켈 염화나트륨 배터리는 245°C(473°F)에서 작동하며 녹는 지점이 157°C(315°F)인 녹은 사염화 나트륨(NaAlCl₄)을 전해액으로 사용한다. 음극 전극은 용해된 나트륨이다. 양극 전극은 방전된 상태의 니켈과 충전된 상태의 염화니켈이다. 니켈과 염화니켈은 중성 및 기본 용해에서 거의 불용성이기 때문에 접촉이 허용되어 전하 전달에 대한 저항이 거의 없다. NaAlCl₄와 Na는 모두 작동 온도에서 액체이므로, 나트륨 전도성 β-알루미나 세라믹은 녹은 NaAlCl₄에서 액체 나트륨을 분리하는 데 사용된다. 이러한 배터리 제조에 사용되는 주요 소재는 리튬보다 전 세계 매장량 및 연간 생산량이 훨씬 높다.
1985년 남아프리카 프리토리아의 과학산업연구위원회(CSIR)의 Zeolite 배터리 연구 아프리카 프로젝트(Zebra)에 의해 NaCl, Al, 니켈 및 철 분말을 사용하여 방전된 상태에서 조립할 수 있었다. 양극은 대부분 고체 상태의 물질로 구성돼 부식 가능성을 줄이고 안전성을 개선했다. 비에너지는 100Wh/kg이고, 비출력은 150W/kg이다. β-알루미나 고체 세라믹은 금속 나트륨과 염화 알루미늄에 반응하지 않는다. 2,000 사이클 이상의 수명 및 20년의 수명은 풀 사이즈 배터리로 입증되었으며, 4,500 사이클 이상, 10 및 20 셀 모듈에서는 15년 이상이다. 비교를 위해, LiFePO₄ 리튬 인산철 배터리는 90~110 Wh/kg을 저장하고, 더 일반적인 LiCoO₂ 리튬이온 배터리는 150~200Wh/kg을 저장합니다. 나노 리튬 티타늄 배터리는 72Wh/kg의 전력을 저장할 수 있으며, 760W/kg의 전력을 공급할 수 있다.
ZEBRA의 액체 전해액은 157 °C(315 °F)에서 동결되며, 정상 작동 온도 범위는 270–350 ° C (520–660 ° F)이다. 셀에 철을 추가하면 셀의 전력 반응이 증가한다. ZEBRA 배터리는 현재 FZSoNick에서 제조되며 통신 산업, 오일&가스 및 철도에서 전력 백업용으로 사용된다. 광업에 사용되는 특별한 전기 자동차에도 사용된다. 과거에는 Modec Electric Van, Iveco Daily 3.5톤 배송 차량, 프로토타입 Smart ED 및 Think City에 채택되었다.
2010년 제너럴 일렉트릭은 Na-NiCl₂을 발표했다. 20년 수명을 가진 나트륨-금속 할라이드 배터리라고 하는 배터리이다. 음극 구조는 전도성 니켈 네트워크, 용융염 전해질, 금속 전류 수집기, 탄소 펠트 전해질 저장소 및 활성 나트륨-금속 할라이드 염으로 구성된다. 2015년 글로벌 구조조정의 결과로 이 회사는 프로젝트를 포기했다. 2017년 중국 배터리 제조업체 차오웨이 그룹(Chilwee Group, 超威集团)이 제너럴일렉트릭(GE)과 함께 새로운 회사를 만들어 산업용 및 에너지 저장용 니켈 소금 배터리를 시장에 출시했다.
사용하지 않을 때는 니켈 염화나트륨 배터리는 일반적으로 녹아서 사용할 준비가 된 상태로 유지된다. 굳어지면 일반적으로 재가열하고 충전하는 데 12시간이 걸리기 때문이다. 이 재가열 시간은 배터리 팩의 온도와 전력에 따라 변한다. 완전히 충전된 배터리 팩은 5~7 일 내에 냉각 및 응고될 수 있어 충분한 에너지가 손실된다.
스미토모(Sumitomo)는 나트륨 기반 배터리보다 훨씬 낮은 61 °C(142 °F)에서 용해되고 90 °C(194 °F)에서 작동하는 소금을 사용하여 배터리를 연구했다. 최대 290 Wh/L 및 224Wh/kg의 에너지 밀도와 100 ~ 1000 충전 사이클의 수명을 가진 1C의 충전/방전 속도를 제공한다. 배터리는 비인화성 물질만 사용하며 공기와 접촉할 때 점화되거나 열 폭주 위험이 없다. 이를 통해 폐열 저장 또는 화재 및 폭발 방지 장비를 제거하고 셀 패킹을 보다 가깝게 할 수 있다. 동사는 이 배터리가 리튬이온 배터리의 절반과 나트륨 황산 배터리의 4분의 1을 필요로 한다고 주장했다.그 셀은 니켈 음극과 유리 탄소 양극을 사용했다.
2014년에 연구원들은 50 °C(122 °F)에서 작동하고 그램 당 420 밀리암페어의 시간을 내는 액체 나트륨-세슘 합금을 발견했다. 이 새로운 물질은 전해질을 완전히 코팅하거나 젖게 할 수 있었다. 100회의 충전/방전 사이클 후, 시험 배터리는 초기 저장 용량의 약 97%를 유지하였다. 낮은 작동 온도 덕분에 강철 대신 저렴한 폴리머 외장 케이스를 사용할 수 있게 되어 세슘 비용 증가를 상쇄할 수 있었다.
전기차 응용[편집]
- 이탈리아 최대 자동차그룹인 피아트의 판다(Panda) 전기자동차는 실질적으로는 현지 피암(Fiamm)이라는 업체가 배터리를 제작한 것으로 유명하다. 피암은 자동차 및 산업용 축전지를 전문 생산하는 업체로 저탄소 친환경의 방향으로 성장하는 시장의 신규수요에 대응, 혁신적인 전기자동차용 소금 배터리 개발해 화제가 되었다.
- 이른바 Zebra Sonik으로 명명된 혁신적 니켈 염화나트륨 배터리(소금 배터리)를 장착한 판다 전기자동차를 2010년 12월 볼로냐 모터쇼에서 선보였으며 이 소금 배터리는 대중교통, 물류서비스, 개인 이동차량 등 다양하게 활용 가능하다. 판다 전기 자동차 모델은 28㎾(38Cv)의 전기 엔진을 장착한 프로토타입으로 Fiamm사가 개발한 소금 배터리로 충전한다. 이 배터리는 Fiamm사가 Mes-Dea와 공동으로 설립한 JV인 FZ Sonick를 통해 스위스에서 생산했다. 이 소금 배터리는 기존 납 배터리의 3배나 되는 에너지 응집률을 보유하고 있으며 환경오염도가 극히 낮다는 측면에서 장점을 가지고 있다.
- 전기자동차용 소금배터리 시장은 막 발전하기 시작해 실제로 유럽 및 미국 대도시 전기 버스를 통해 이미 활용되고 있었으며 승용차를 위한 수요도 높아지고 있다. 실제로 이탈리아도 볼로냐, 피렌체, 로마 등 대도시에도 니켈 염화나트륨 배터리로 충전된 대중 버스가 운행 중이다.
- 프랑스 체신청은 우편서비스를 위해 전기자동차 250 Berlingo First Electrique 모델을 도입했으며 이에 Fiamm사의 소금 배터리 Zerbra sonick가 납품되었다.[2]
액체 금속 배터리[편집]
MIT의 도날드 샤도웨이(Donald Sadoway) 교수는 마그네슘-안티모니 및 최근 납-안티모니 모두 사용하여 액체 금속 재충전 가능 배터리에 대한 연구를 선도해 왔다. 전극과 전해질 층은 액체가 될 때까지 가열되고 밀도와 비혼화성으로 인해 자체 분리된다. 이러한 배터리는 충전 방전 주기 동안 전극이 생성 및 파괴 주기를 거치기 때문에 기존 배터리보다 수명이 길 수 있으며, 이는 기존 배터리 전극에 영향을 주는 성능 저하에 영향을 받지 않는다. 이 기술은 용융염으로 분리된 마그네슘과 안티모니를 기반으로 2009년에 제안되었다. 마그네슘이 용융염 전해질의 낮은 비용과 낮은 용해도로 음극으로 선택되었다. 안티모니은 비용이 저렴하고 예상되는 방전 전압이 높아 양극으로 선택되었다.
2011년에 연구원들은 더 높은 이온 전도도와 더 낮은 융점(350–430 ° C)을 가진 리튬 양극과 납-안티모니 음극을 가진 전지를 시연했다. 리튬 화학의 단점은 높은 비용이다. 450 ° C에서 작동하는 약 0.9V 개방 회로 전위를 가진 Li / LiF + LiCl + LiI / Pb-Sb 셀의 전기 활성 재료 비용은 US $ 100 / kWh 및 US $ 100 / kW이고 예상 수명은 25년이다. 1.1 A / cm 2 에서 방전 전력은 44 %에 불과하다 (0.14 A / cm 2 에서 88 % ).
실험 데이터는 우수한 저장 용량 (1000 mAh / cm 2 이상 ), 낮은 누설 (<1 mA / cm 2 ) 및 높은 최대 방전 용량 (200 mA / cm 2 이상)으로 69%의 저장 효율을 보여준다. 2014 년 10 월까지 MIT 팀은 높은 충전 / 방전 속도 (275mA / cm 2 ) 에서 약 70%의 운영 효율성을 달성했다. 이는 펌프 저장 수력 전기와 유사하고 더 낮은 전류에서 더 높은 효율성을 달성했다. 테스트에 따르면 10년 동안 정기적으로 사용하면 시스템이 초기 용량의 약 85%를 유지할 수 있다. 2014 년 9 월 한 연구에서는 양극에 납과 안티모니의 용융 합금을 사용하고 음극에 액체 리튬, 전해질로 리튬염의 용해된 혼합물을 사용한 배열을 설명하였다.
최근의 혁신은 낮은 용융점 리튬 기반 배터리를 가능하게 하는 PbBi 합금이다. LiCl-LiI 기반의 용융염 전해질을 사용하며 410 ° C에서 작동한다.
이온성 액체는 충전식 배터리에 사용할 수 있는 능력이 있는 것으로 나타났다. 전해질은 용매가 첨가되지 않은 순수한 용융염이며, 상온 액체 상태의 소금을 사용하여 이루어진다. 이로 인해 점성이 높은 용액이 생성되며 일반적으로 연마성 격자 구조를 가진 구조적으로 큰 염으로 만들어진다.
열전지[편집]
열전지(thermal battery)란 상온에서 이온전도도가 없는 고상 무기염 전해질(inorganic salt electrolyte)을 화학열원을 이용하여 즉각적으로 액체로 녹여 높은 이온전도성을 가지게 만듦과 동시에 전지가 작동되어 비교적 짧은 시간에 높은 출력을 제공하는 1차 비축전지(primary battery)를 말한다. 상온에서 열전지의 전해질이 이온전도성이 없는 고체로 존재하기 때문에 자가방전(self-discharge)이 없어 우수한 장기 보관 특성을 지기고 있으며, 구조가 간단하여 신뢰성이 탁월하고, 사용온도 범위가 넓다.
열전지 개발 초기에는 Ca/CaCrO₄ 또는 Mg/V₂O₅ 등의 전기화학적 시스템이 사용되어 왔으나, 전지 활성 상태에서 원치 않은 화학반응 발생, 환경오염 문제, 짧은 수명, 낮은 신뢰도 및 전류용량 등의 문제점으로 인하여 현재는 거의 사용되지 않고 있으며, 리튬(Li) 기반의 Li(M)/FeS₂ 전극 시스템이 가장 일반적으로 사용되었다. 비교적 짧은 시간에 높은 출력을 제공하는 열전지는 비출력(specific power)이 크고, 보수유지가 불필요하며(maintenance free), 긴 저장 수명(long shelf life), 넓은 작동 온도(wide operation temperature) 및 높은 신뢰도(high reliability) 등의 장점으로 추진체(projectiles), 로켓(rockets), 어뢰(torpedoes), 미사일(missiles)용 전원 및 항공기 (aircraft)의 비상 전원(emergency power sources) 등과 같은 다양한 특수 목적의 군사용 전원으로 널리 사용되고 있다.
최근에 들어서 새로운 양극 및 음극의 개발, 낮은 용융점을 가지는 전해질 개발, 고효율의 단열재 개발 등을 통해 수십분~2시간 정도까지 사용 가능한 열전지가 개발되고 있으며, 이러한 개발을 통해 기존에 군용으로 널리 사용되었던 비축전지인 Li/SOCl₂를 빠르게 대체하고 있다.
열전지는 신관, 미사일, 포탄 및 다양한 군 응용 분야에 비교적 짧은 시간 동안 고출력을 제공하기 위하여 우선적으로 사용되고 있다.
각주[편집]
- ↑ 공학, 〈미사일에 사용되는 배터리〉, 《티스토리》, 2019-11-10
- ↑ 코트라 밀라노 KBC, 〈Arcturus :: 전기자동차용, 니켈 염화나트륨 배터리(소금 배터리)의 장단점?〉, 《티스토리》, 2011-05-23
참고자료[편집]
- "Molten Salt Battery", Wikipedia
- 〈이차 전지〉, 《나무위키》
같이 보기[편집]

 위키원
위키원