황화물 전고체 배터리
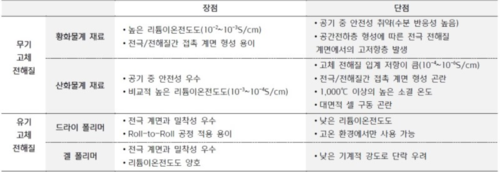
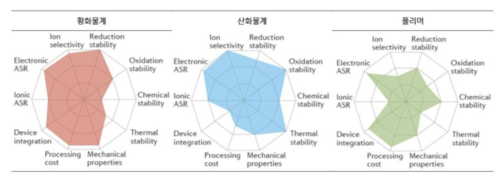
황화물 전고체 배터리는 무기 고체 전해질인 황화물을 사용한 전고체 배터리이다. 전고체 배터리 고체 전해질에는 또 다른 무기 고체 전해질인 산화물계와 유기 고체 전해질인 폴리머계가 있다. 고체 전해질은 액체 전해질에 비해 이온전도도가 낮다는 것이 단점이다. 때문에 전고체 배터리가 상용화 되려면 소재 연구가 가장 우선이다. 이 가운데 황화물계 전해질의 전도도와 셀 성능이 우수한 것으로 평가되고 있다. 전고체 전지의 전해물 종류는 산화물, 황화물, 폴리머, 하이브리드로 구분되는데, 종류별로 보면 폴리머 65, 황화물 37, 산화물 21, 하이브리드 10 순으로 비중을 차지한다. 토요타와 현대차, 폭스바겐, BMW 등 완성차 업체는 황화물계를 중심으로 연구하고 있다.[1] 특히 토요타는 황화물계 전고체 배터리 관련 특허 1,000개를 넘는다.
상세[편집]
- 산화물 이온에 비해 큰 황화물 이온은 이온 전도 경로가 되는 음이온 간의 틈새가 넓다. 게다가 황화물 이온의 분극률이 높기 때문에 리튬이온에 대한 속박력이 약해져, 리튬이온은 움직이기 쉬운 상태가 된다. 때문에 황화물계 고체 전해질의 이온 전도도는 1980년 초에 이미 10⁻³S㎝⁻¹이었다. 더욱이 황화물계 고체 전해질은 입계저항을 낮추기 위한 고온 소결 과정이 불필요한 점도, 산화물계와 크게 다른 이점이다.
- 즉, 황화물계 고체 전해질은 실온에서 가압 성형하여 입계 저항이 매우 낮은 성형체를 얻을 수 있다. 또 수화물계 고체 전해질로 소결 시의 다른 결정구조 생성의 문제가 적고, 간단한 공정으로 전지를 제작할 수 있다. 그러나 황화물계 고체 전해질은 대기 중의 습기와 쉽게 반응해 버리는 취급하기 어려운 재료이다.
- 앞에서 기술한 바와 같이 리튬이온만을 전도 종으로 하는 고체 전해질에 요구되는 10⁻³S㎝⁻¹의 이온 전도도는, 유기용매 전해질의 10⁻²S㎝⁻¹에 상당한다. 황화물계 고체 전해질에 있어서의 이온수송 특성은 유기용매 전해질을 능가하고 있다. 그러나 황화물계 고체 전해질의 이같은 높은 이온 전도도를 전지의 출력 성능에 연결하기 위해서는 아직 해결해야 할 문제가 남아 있다.
- 이온 전도체의 표면이나 이온 전도체가 다른 물질에 접촉한 계면은 가동 이온 농도가 변화한 공간 전하층이 형성된다. 이때 고체 전해질 내부와는 다른 이온 수송거동을 나타낸다. 이와 같은 특이한 이온전제현상은 공간 전하층의 두께가 10㎚ 전후로 나노이오닉스(nano-ionics)라부른다. 황화물계 고체 전해질을 사용한 전고체 전지 문제가 되는 것은, 정극 활물질과의 계면에 있다.
- 황화물 전해질은 음이온 격자와 리튬 이온에 대한 속박력이 약하기 때문에, 리튬 이온 농도가 크게 저하한다. 그 결과, 정극 활물질과의 계면에서 공간 전하층은 리튬이온이 부족하여, 황화물계 고체 전해질을 사용한 전고체 전지의 출력 성능을 저하시킨다. 즉 황화물 이온의 높은 분극률은, 고체 전해질 중의 이온 전도도는 우수하지만, 에너지 밀도를 높이기 위해서 정극과 조합했을 때에는 결점이 된다.
- 이 문제를 해결하는 방법은 고체 전해질이 정극 활물질의 높은 전위에 노출되지 않게 하는 것이다. 이를 위해서 정극 활물질 표면에 전자 절연성의 박층을 피복하는 방법이 제안되고 있다. 이 박층은 리튬이온 결핍층의 형성에 대한 완충작용을 발휘한다. 그 결과 완충층이 형성되어 전고체 전지의 출력 성능이 높아져서, 유기용매 전해질을 사용한 현행의 리튬이온 배터리와 동등한 수준의 성능을 나타낸다.
황화물계 전해질 특성[편집]
리튬이온 전도도가 10⁻²~10⁻³ S/cm 수준으로 높고, 전극과 전해질 간 접촉 계면을 형성하기가 용이하다. 기계적 강도와 기계적 유연성이 좋은 편이다.
수분 반응성이 높기 때문에 공기 중 안전성이 취약하다. 또한 대기 중에서 불안하면 생산이 어렵고, 셀 제조 공정에서 실내 습도 제어가 매우 중요해진다. 또한 공간 전하층(Space Charge Layer, 전자 또는 이온의 이동으로 전하가 박층상으로 분포하는 영역)이 형성되어 양극과 전해질의 계면에 높은 저항층이 발생한다. 쉽게 말해 기존 양극과 잘 맞지 않아 별도의 처리가 필요하다.
소재 개발[편집]
황화물계 소재는 결정형인 LGPS(Li₁₀GeP₂S₁₂), LSPSCl(Li₉.₅₄Si₁.₇₄P₁.₄₄S₁₁.₇Cl₀.₃), Argyrodite 등과 Glass ceramic 형인 LPS, LPS+LiCl 등이 주축이다. 산화물계 소재는 Perovskite(LLTO), NASICON, LISICON, Gamet(LLZO) 등이다. 폴리머 소재는 PEO 등을 중심으로 활발한 연구가 이루어지고 있다.
이 중에서 황화물계인 LGPS(LSPSCl), Glass Ceramic, 산화물계인 LLTO, LLZO 등의 상용화 가능성이 높은 것으로 거론되기도 한다.
고체 전해질 소재 기술은 일본이 많이 앞서 있다. 이에 따라 핵심 소재는 특허 이슈가 크다. 고체 전해질 중 황화물계 특허 비중이 45%로 가장 많은 비중을 차지한다. 개별 주체로는 토요타가 전고체 배터리 분야에서 가장 많은 특허를 출원하며 연구에서 앞서 있다. 후발 주자들은 특허를 피하기 위해 소재 성분을 달리 구성하는 연구에 집중하고 있다. Argyrodite가 상대적으로 특허 이슈에서 자유롭다고 알려졌다.
황화물계는 상온에서 가장 높은 이온전도도를 구현한 LGPS 계열(2011년)을 중심으로 한다.' 그 뒤로 LSPSCI 계열(2016년)이 LGPS보다 뛰어나다는 발표가 있었다. 토요타가 LGPS, LSPSCI 계열에 초점을 맞추고 있고, 두 소재를 원천 개발한 동경공업대와 공동 연구하고 있다.
LGPS 전해질은 게르마늄(Ge)이 고가이고, 저전위에서 안정성이 취약하다는 약점을 가진다. 이를 극복하기 위해 게르마늄을 대체해 원가를 낮추는 동시에 전도도를 높이고, 저전위에서 안정성을 확보하고자 하는 연구가 진행되고 있으며, LSPSCI 계열이 이를 충족시킨다.
황화물계는 수분 안전성을 향상시키는 기술이 필수적이다. 황(S)이 수분(H₂O)을 만나면 유해한 황화수소(H₂S)가 발생한다. 첨가제를 섞어 황화수소 발생을 줄이거나 황화수소 발생량과 속도를 억제하는 신규 조성소재를 연구 중이다.
각주[편집]
- 이동 ↑ 경계영 기자, 〈"전고체, 2030년 배터리 시장 4%대로 올라설 전망"〉, 《이데일리》, 2021-05-26
참고자료[편집]
- spainorange, 〈키움증권 차세대 배터리 - (3) Post Lib(전고체전지, 리튬황전지, 리튬공기전지 〉, 《네이버블로그》, 2019-08-06
- * 전고체 전지의 최신 기술기발(한국과학기술정보연구원) - file:///C:/Users/sms/Downloads/2._%EC%A0%84%EA%B3%A0%EC%B2%B4_%EB%A6%AC%ED%8A%AC%EC%9D%B4%EC%B0%A8%EC%A0%84%EC%A7%80_%EA%B0%9C%EB%B0%9C_%EB%8F%99%ED%96%A5_%EB%B0%8F_%EC%A0%84%EB%A7%9D.pdffile:///C:/Users/sms/Downloads/%EC%A0%84%EA%B3%A0%EC%B2%B4%20%EC%A0%84%EC%A7%80%EC%9D%98%20%EC%B5%9C%EC%8B%A0%20%EA%B8%B0%EC%88%A0%EA%B0%9C%EB%B0%9C.pdf
- 경계영 기자, 〈"전고체, 2030년 배터리 시장 4%대로 올라설 전망"〉, 《이데일리》, 2021-05-26
같이 보기[편집]

 위키원
위키원