황화물계 전해질
황화물계 전해질은 무기 고체 전해질의 일종이다. 무기 고체 전해질의 경우 일반적으로 산화물계와 황화물계로 분류한다.[1]
황화물계 고체전해질은 차세대 전고체 배터리 개발 분야의 유망 소재로 널리 연구되고 있다. 액체전해질처럼 이온전도도가 높고 낮은 기계적 변형성과 낮은 중량밀도가 장점이다. 그러나 배터리에 적용 시 여러 고질적 문제도 따르고 있다. 양극 계면에 필요한 반응을 넘어 절연체 성능 저하를 가져오는 열화 반응, 충·방전 과정에서 발생하는 부피 변화로 고체전해질의 기계적 접촉 손실 등이다. 따라서 황화물계 전고체 전지 전극과 전해질 계면의 화학·물리적 상태를 온전히 유지하는 것이 수명 연장을 위한 핵심 과제다. [2]
한국에서는 삼성SDI와 LG에너지솔루션이 황화물계를 연구개발하고 있고 삼성은 파일럿 장비를 들여와 27년 양산준비를 하고 있고 LG에너지솔루션은 26년에는 고분자계로 시작해 30년에는 황화물계 전해질의 상용화를 준비하고 있다. 그리고 전고체전지 특허가 가장 많다는 토요타와 현재 가장 높은 점유율을 가지고 있는 CATL도 황화물계를 준비하고 있다.[3]
목차
[숨기기]개요[편집]
황화물계 고체전해질은 높은 이온전도도(10⁻²~10⁻³ S/cm)와 전기화학적 안정성(LGPS의 경우 약 5V까지 vs. Li/Li+ )을 바탕으로 전 세계적으로 가장 큰 관심을 끌고 있다.
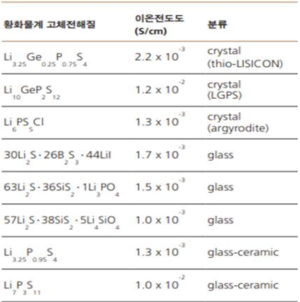
황화물계 고체전해질은 결정구조의 유무에 따라 결정계(crystal)와 비정질계(non-crystalline)로 나뉠 수 있다. 결정계에서 thio-Lisicon, LGPS, Argyrodite구조가 대표적이고 비정질계에서는 열처리 온도 차이에 의해 glass 그리고 glass-ceramic 전해질로 나뉠 수 있다. Glass형태 고체전해질은 일본 하야시 교수 연구 그룹에 의해 활발히 진행되었는데 Li₂S₅와 P₂S₅를 7:3정도의 비율로 혼합하여 고에너지 볼밀링을 통해 비정질화를 진행시켜 glass형태의 고체전해질을 형성하고 이후 낮은 온도에서 열처리를 통해 glass- ceramic 전해질을 합성하여 높은 이온전도도가 나타냄을 보고하였다(10⁻³ S/cm). 황화물계 전해질 중 하나인 LGPS(Li₁₀GeP₂S₁₂)는 오른쪽 표를 보면 알 수 있듯이 상온에서 1.2×10⁻² S/cm의 높은 이온전도도를 갖는다. LGPS가 보고된 이후 Ge과 같은 족의 원소로 치환하는 연구가 폭발적으로 진행되었는데(예를 들어 Ge<표. 황화물계 고체전해질 이온전도도a>를 Si, Sn, Al로, S를 Se로 치환) 모두가 LGPS 보다 높은 이온전도도를 나타내진 않았지만, 경제적인 측면에서의 장점을 가질 수 있었다(P가 포함되지 않은 Li₄SnS₄의 경우 이온전도도는 7.1×10⁻⁵ S/cm이나 As 치환을 통해 1.39×10⁻³ S/cm으로 크게 향상). 또한 2016년에 보고된 LPSCl계 Li₉.₅₄Si₁.₇₄P₁.₄₄S₁₁.₇Cl₀.₃이 2.5×10⁻² S/cm으로 리튬이온전지 전해액 수준의 이온전도도를 기록한 데 힘입어, 황화물계 고체전해질 연구가 전고체 전지 실용화에 큰 가능성을 보이고 있다.
이처럼 다양한 연구를 통해 황화물계 고체전해질은 이온전도도 개선 측면에서 진전을 보였고 열적 안전성이 높아 열 폭주에 의한 화재 발생 염려도 없다. 그럼에도 불구하고 황화물계 고체전해질은 대기 노출시 수분 반응성이 높아 H₂S를 형성시켜 공기 중 안정성이 취약한 상태이다. 그리고 양극재와 황화물 고체전해질 간 접촉에 있어 불안정한 계면을 띄게 되므로 낮은 효율의 수명 특성을 가지고 있으며, 전해질이 고체이기 때문에 전극과 전해질의 계면 저항을 피할 수 없다. 이런 이유로 이온전도도의 개선 뿐만아니라 수분 반응성 및 계면 안정성을 개선하고 상용화하기 위한 다양한 연구들도 함께 수반되고 있다.[4]
황화물계 고체 전해질 특징[편집]
- 장점
황화물계 고체 전해질의 특징으로는 고체전해질 중에서는 가장 높은 이온전도도를 가지고 있고 액체전해액과도 비슷한 수준이다. 그리고 비교적 연질의 기계적 특성때문에 전극과의 접촉성이 우수해 계면저항이 낮고 다루기 쉬워 생산성이 좋다.[3]
- 단점
황화물계 전해질은 수분과 반응해 황화수소가스가 발생하는 큰 단점이 있다. 그래서 기존 음극재,양극재 및 전극재료들을 슬러리화시켜 전극을 건조하는 방법은 용매를 사용하기도 하고 용매를 건조시켜도 약간의 수분기가 남아있기 때문에 황화물계 고체 전해질과 사용하기에는 안정성이 떨어진다. 그래서 용매가 들어가지 않는 건식 공정으로 전극을 생산하는 방법 또는 수분성을 제어하는 소재개발이 필요하다.(요즘에는 양극 음극에도 약간의 고체전해질이 들어간다. 양극과 음극에 고체전해질 없으면 양극 음극과 고체전해질 사이에 계면저항이 높아 이온전도도가 낮아집니다. 그래서 건식코팅기술이 중요하다.[3]
그리고 황화물 고체 전해질의 주요 재료인 황화리튬이 높은 가격대를 형성하고 있는 것도 상용화에 문제가 된다.
황화물계 고체 전해질 종류[편집]
- 2011년 발표된 Li₁₀GeP₂S₁₂(LGPS)
- 2014년 발표된 Li₇P₃S₁₁(LPS)
- 2016년 발표된 Li₉.₅₄Si₁.₇4P₁.₄₄S₁₁.₇Cl₀.₃(LPSCl)[3]
주로 LPSCl계의 황화물계 고체 전해질을 사용하고 기업마다 약간씩 비율이 다르게 하고 추가적인 재료를 첨가한다.
황화물계 고체 전해질 기업[편집]
황화물계 고체전해질 공장을 착공한 포스코JK리드솔루션이 한국에서는 현재 황화물계 고체 전해질 양산에 가장 가까운 기업아다.[3]
포스코JK리드 솔루션(정관)[편집]
포스코JK리드 솔루션은 황화물계 전해질 기술을 가지고 있는 정관과 포스코홀딩스의 합작회사이다. 2013년부터 고체전해질을 연구한 정관의 기술력이 포스코에 인정받아 투자를 받은 것으로 보인다. 정관의 황화물계 고체전해질에 제조방법에 대해서 간단히 알아보겠다.
- 제조방법
- ①Li₂S(황화리튬) 40%, P₂S₅(황화인) 40%, LiCl 20% 비율의 분말을 분쇄 혼합한다.
- ②그리고 Li₂S를 약간 추가 투입하여 480~530℃에서 10~15시간 열처리를 한다.
(Li₂S를 약간 첨가하는 이유는 고체전해질의 열처리(결정화)과정에서 황이 빠지는걸 방지하고 이온전도도를 향상시키는 효과가 있다.[3]
삼성SDI[편집]
삼성SDI는 직접 연구개발한 LPSCl계 Li₆PS₅Cl 고체전해질을 연구개발했다. 하지만 Li₆PS₅Cl 고체 전해질은 수분과의 반응성이 높아 제조 및 저장과정에서 황화수소와 같은 유독가스가 발생하기 쉽고 양극 또는 음극 활물질과 접촉성이 떨어져 이온전도도가 저하된다. 그래서 Zn(아연)과 기존의 할로겐원소인 Cl 자리에 산소와 2종의 할로겐 원소를 도입해 Li₇-₂a-b-cZnaPS6-a-b-cOaClbBrc 의 고체전해질을 개발했다. 그러면서 이온전도도, 수분안정성, 유연성이 성질이 향상되었다. 여러 조성을 실험했을 때 Li₅.₃Zn₀.₀₅PS₄.₃₅O₀.₀₅Cl₁.₄Br₀.₂가 이온전도성, 수분안정성, 공기 안정성, 충방전에서 우수한 성능을 나타냈다고 특허에 나와있다.
- 제조방법
Ar가스 안에서 Li₂S, P₂S₅, ZnO, LiCl 및 LiBr을 분쇄 및 혼합한다. 그리고 열처리를 한 후 냉각하여 고체전해질을 제조한다.[3]
토요타[편집]
토요타의 황화물계 고체전해질도 LPSCl계를 사용한다. 제조방법도 사실 위에서 본 삼성SDI와 포스코JK리드솔루션과 크게 차이가 있지 않다.[3]
고체 전해질의 특성 비교[편집]
각 고체 전해질의 특성과 장단점 비교 종류 이온전도도 (S/cm)
전위창 (V vs Li/Li+)
장점 단점 고분자 10⁻⁸~10⁻⁴ 0~5 •얇은 필름으로 성형 가능 •유연성이 있어 셀 제조 용이
•전극과의 점착성 우수
•가격이 저렴
•상온에서 이온 전도도 낮음 •고온에서 기계적 물성 떨어짐
•이온 전도도의 온도 의존성 큼
산화물 페롭스카이트 (Peroskite)
10⁻⁶~10⁻³ 1.5~5.5 •단결정 상태에서 이온전도성 우수 •다결정 상태에서 입계저항 증가 •음의 전위창이 나쁨
가넷 (Garnet)
10⁻⁶~10⁻³ 0~5.5 •전위창, 이온전도도 우수 •대기중 취급용의, 기계적, 화학적 안정성 우수
•대기 및 수분 중 장기 방치시 표면 반응 및 셀 열화 영향 나시콘 (NASICON)
10⁻⁶~10⁻³ 2.5~5.5 •단결정 상태에서 이온전도성 우수 •다결정 상태에서 입계저항 증가 •음의 전위창이 나쁨
황화물 10⁻⁴~10⁻² 0~5.5 •이온전도도, 전위창 매우 우수 •양극/음극 소재와 반응성 •고분자와 반응성
•흡습성 (H₂S 생성)
•대기중 반응성, 고순도 황화물 요구
각주[편집]
- 이동 ↑ 〈전고체 전해질의 종류 및 분류〉, 《티스토리》, 2022-11-18
- 이동 ↑ 이건한 기자, 〈UNIST 연구팀 '황화물계 전고체 배터리' 단점 보완 소재 개발〉, 《디지털데일리》, 2023-04-11
- ↑ 이동: 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 준, 〈전고체 전지3 - 산화물계 전해질〉, 《네이버 블로그》, 2022-07-11
- 이동 ↑ 〈황화물계 전고체전지〉, 《화학공학소재연구정보센터》, 2022-04
참고자료[편집]
- 준, 〈전고체전지5 - 황화물계 전해질〉, 《네이버 블로그》, 2022-07-22
- 이건한 기자, 〈UNIST 연구팀 '황화물계 전고체 배터리' 단점 보완 소재 개발〉, 《디지털데일리》, 2023-04-11
- 〈전고체 전해질의 종류 및 분류〉, 《티스토리》, 2022-11-18
같이 보기[편집]

 위키원
위키원