"흑연"의 두 판 사이의 차이
잔글 (→참고자료) |
잔글 |
||
| 1번째 줄: | 1번째 줄: | ||
[[파일:흑연.jpg|썸네일|300픽셀|오른쪽|흑연]] | [[파일:흑연.jpg|썸네일|300픽셀|오른쪽|흑연]] | ||
| − | '''흑연'''(黑鉛, graphite)은 탄소의 동소체 중 하나이다. | + | '''흑연'''(黑鉛, graphite)은 탄소의 [[동소체]] 중 하나이다. 다른 명칭으로 '''석묵'''(石墨)이라고도 한다. 천연에서 산출되기도 하고, 인공적으로 제조되기도 한다. 흑연의 영어 이름인 "graphite"는 "(글 따위를) 쓰다"라는 뜻을 가진 그리스어 "graphein"에서 유래되었다. |
| − | + | 다이아몬드나 숯처럼 주 구성 성분은 탄소지만 분자구조가 판 형식으로 되어 있어 잘 부스러지는 암석. 그래서 연필의 주요 재료로 사용된다. 연필의 연(鉛)은 납 연자인데, 흑연 연필 이전에 사용하던 납 펜과 비슷하게 쓸 수 있다 하여 검은 색을 내는 납(鉛) 즉 "Black lead"라고 한 것이다. 탄소 원자 하나당 3개의 탄소 원자와 공유 결합하는데, 이 때 남은 전자 하나는 자유전자가 된다. 흑연이 도체인 이유도 이 때문. 층과 층 사이에는 판데르발스 힘이 작용한다. | |
흑연은 오래 전부터 지금까지 꾸준하게 [[리튬]] [[2차전지]]의 음극활물질로 사용되고 있다. 흑연은 아주 규칙적인 형태로 탄소Carbon가 결합된 하나의 층이 여러 겹 쌓인 층상구조이다. 리튬이온이 양극에서 음극으로 이동하는 충전 과정에서 음극에 도달한 리튬이온은 흑연층 사이에 저장된다. 그런데 이때 [[리튬이온]]이 들어간 흑연은 팽창되어 미세하게 부피가 늘어나게 된다. 이것이 반복되면 점차 구조 변화를 일으켜 배터리 수명도 감소하게 된다. 배터리 수명에 있어서도 음극재가 중요한 요인 중 하나이다. 최근 배터리 업계는 [[고용량]] 배터리를 향한 시대적 요구에 맞춰 차세대 음극활 소재 개발이 진행되고 있다. | 흑연은 오래 전부터 지금까지 꾸준하게 [[리튬]] [[2차전지]]의 음극활물질로 사용되고 있다. 흑연은 아주 규칙적인 형태로 탄소Carbon가 결합된 하나의 층이 여러 겹 쌓인 층상구조이다. 리튬이온이 양극에서 음극으로 이동하는 충전 과정에서 음극에 도달한 리튬이온은 흑연층 사이에 저장된다. 그런데 이때 [[리튬이온]]이 들어간 흑연은 팽창되어 미세하게 부피가 늘어나게 된다. 이것이 반복되면 점차 구조 변화를 일으켜 배터리 수명도 감소하게 된다. 배터리 수명에 있어서도 음극재가 중요한 요인 중 하나이다. 최근 배터리 업계는 [[고용량]] 배터리를 향한 시대적 요구에 맞춰 차세대 음극활 소재 개발이 진행되고 있다. | ||
| 12번째 줄: | 12번째 줄: | ||
오늘날 세계적인 흑연수출국은 말라가시·노르웨이·스리랑카·중국·한국 등이며, 우리 나라는 토상흑연의 수출량이 많다. 흑연은 열과 전기의 좋은 전도체이며, 보통 3,500℃ 정도에서 용융(고체가 열에 녹아 액체로 되는 일)된다.또한 완전한 저면벽개(底面劈開)로 인하여 매우 낮은 마찰계수를 가진다. 이러한 성질 때문에 전극·탄소봉·내화재료·주형(鑄型) 재료·감마재(減磨材) 및 연필 등으로 이용된다. 이 밖에도 특수강인 탄소강원료, 원자로에서 중성자의 감속재, 방청용(防錆用)의 특수포장, 금속표면의 코팅, 고무공업원료 등에 많이 쓰인다. | 오늘날 세계적인 흑연수출국은 말라가시·노르웨이·스리랑카·중국·한국 등이며, 우리 나라는 토상흑연의 수출량이 많다. 흑연은 열과 전기의 좋은 전도체이며, 보통 3,500℃ 정도에서 용융(고체가 열에 녹아 액체로 되는 일)된다.또한 완전한 저면벽개(底面劈開)로 인하여 매우 낮은 마찰계수를 가진다. 이러한 성질 때문에 전극·탄소봉·내화재료·주형(鑄型) 재료·감마재(減磨材) 및 연필 등으로 이용된다. 이 밖에도 특수강인 탄소강원료, 원자로에서 중성자의 감속재, 방청용(防錆用)의 특수포장, 금속표면의 코팅, 고무공업원료 등에 많이 쓰인다. | ||
| + | |||
| + | == 천연에서의 존재 == | ||
| + | 소량의 [[무기물]]과 [[유기물]]이 포함되어 있으면서 산화적 환경에 노출되지 않고 접촉 변성 작용 또는 광역 변성 작용을 받아 생성된 사암, 셰일, 석탄, 석회암 등의 암석과 함께 천연에서 산출될 수 있고, 환원성 환경에서 생성된 사문암, 석회암과 함께 발견되기도 한다. 주로 편마암, 편암 등과 함께 발견된다. 스리랑카, 마다가스카르, 조선민주주의인민공화국, 멕시코의 소노라주, 캐나다의 온타리오주, 서시베리아, 미국의 뉴욕주에 상당량이 매장되어 있다. 흑연은 간혹 운석에서도 발견되는 경우가 있다. | ||
| + | |||
| + | == 성질 == | ||
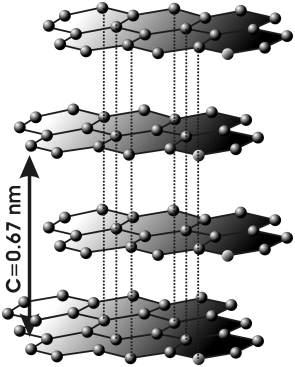
| + | [[파일:흑연의 결정 구조.png|썸네일|300픽셀|오른쪽|흑연의 결정 구조]] | ||
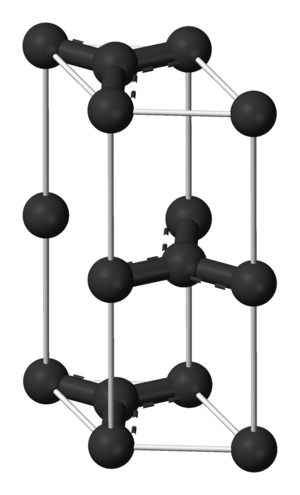
| + | [[파일:흑연의 단위격자.png|썸네일|300픽셀|오른쪽|흑연의 단위격자]] | ||
| + | 흑연은 굳기가 약 1.5로 매우 부드러운 편이다. 비중은 2.23이지만, 구멍이나 불순물에 의해서 더 낮아질 수 있다. 색은 흑색에서 철회색을 띠며 금속광택을 가진다. 녹는점, 끓는점 등은 명확하지 않다. 전기 전도체로 작용하며, 전기저항은 방향에 따라 큰 차이를 보인다. 천연일 경우 결정의 형태는 육각 판 모양의 편평한 모양이며, 인공일 경우 결정은 비늘상이나 덩어리상이다. 내열성, 내열충격성, 내식성이 강하고 전기 및 열 전도성이 좋은 편이다. | ||
| + | |||
| + | 흑연의 구조는 탄소 여섯 개로 이루어진 고리가 연결되어 층을 이룬 모양으로 c값(층간 간격의 2배)은 6.696Å, 탄소간 결합 길이는 1.42Å이다. 흑연의 단위격자는 탄소 원자 4개를 포함한다. 격자상수는 2.456Å이다. | ||
| + | |||
| + | 화학적으로는 상당히 안정한 물질로 공기 중에서의 발화점은 500~600°C 또는 그 이상이다. 산소 중에서 가열하면 600~700°C에서 이산화 탄소가 된다. 분말을 진한 황산과 진한 질산의 혼합물로 처리하면 녹갈색의 산화흑연을 얻을 수 있다. 또한 진한 황산과 산화제와 함께 가열하면 광택이 있고 청자색의 물질인 황산수소흑연이 된다. 질산으로 산화시키면 멜리트산을 얻을 수 있다. | ||
| + | |||
| + | == 인조흑연 == | ||
| + | 인공적으로 합성된 흑연은 성질의 편차가 심하기 때문에 공업용으로는 잘 사용되지 않는다. 제유 과정에서 생산되는 코크스를 탄소 공급원으로 하여 만들어지는 경우가 많다. | ||
| + | |||
| + | 인조흑연은 미국의 에드워드 굿리치 애치슨에 의해서 처음으로 합성되었다. 그는 탄화 규소로 실험을 하다가 4150°C에서 탄화 규소의 규소성분이 증발해 버리고 남은 탄소가 흑연의 형태로 남아 있는 것을 발견하였다. 1896년 애치슨은 흑연 생산에 대한 특허를 냈으며 상업적인 인조 흑연 생산은 1897년부터 이루어졌다. | ||
| + | |||
| + | 인조흑연은 무정형 탄소를 고온으로 가열하여 만들어지는데, 일반적으로는 2500~3000°C로 가열하지만 천연 흑연의 구조와 가깝게 만들기 위해서는 더 높은 온도가 필요하다. 또한 원료 탄소 화합물의 구조에 따라서는 인조 흑연으로 만들기가 어려운 경우도 있다. | ||
| + | |||
| + | == 용도 == | ||
| + | 흑연은 주로 다음과 같은 용도로 사용된다. | ||
| + | * 대표적으로 연필 혹은 샤프의 심으로 재료가 사용된다. 이때 흑연을 점토와 섞어 굳기를 조절한다. | ||
| + | * 로켓의 케이스나 화학 공정에서의 내열성 장비의 재료로 사용된다. 이 경우 약 3000°C 이상의 온도까지 견딜 수 있다. | ||
| + | * 화학 공정에서의 내식성 기구의 재료로 사용된다. | ||
| + | * 전기 용광로의 전극이나 전기 분해를 위한 기구의 재료로 사용된다. | ||
| + | * 원자로에서 중성자 감속재 및 반사재로 사용된다. | ||
| + | * 많은 물건의 주형으로 사용된다. | ||
| + | * 층상을 이루고 있어 미끄럽기 때문에 윤활제, 감마제로도 사용된다. | ||
| + | |||
| + | 최초로 '''[[그래핀]]'''을 분리해낸 물질이기도 하다. 2004년, 영국 맨체스터 대학의 안드레 가임(Andre Geim) 연구팀과 러시아 Chernogolovka 마이크로일렉트로닉스 연구팀이 스카치 테이프에 흑연을 붙인 후 테이프를 사용해서 분리해냈다. 그 그룹에서는 가끔씩 진행하는 연구와는 무관하게 호기심을 충족하기 위해 간단한 실험이나 연구를 하곤 했다고 한다. 실제로 가임은 이런 엉뚱한 실험 중 하나인 '자기장으로 개구리를 공중부양시키기'를 연구해서 2000년 이그노벨상 물리학상을 수상하기도 했다. 어느 날 "세상에서 가장 얇은 물질을 만들어 볼까?" 하면서 착안한 것이 스카치 테이프와 흑연. 그리고 곧바로 스카치 테이프에 흑연을 붙인 후 테이프를 붙였다 떼었다 하니까 기하급수적으로 얇아지면서 최종적으로 단일 원자 두께의 그래핀을 분리해 냈다고 한다. 정확한 원리는, 흑연에 스카치 테이프를 붙이면, 그래핀 표면과 스카치 테이프의 접착력으로 인한 결합이 그래핀 사이의 결합보다 더 강해지게 되고, 이 상태에서 스카치 테이프를 떼내면 그래핀이 스카치 테이프에 붙은 채 떨어지게 되었다. 안드레 가임은 이 연구로 2010년 노벨물리학상을 수상했다. | ||
| + | |||
| + | == 흑연 층간 물질 == | ||
| + | [[파일:칼륨 흑연. 흑연층 사이에 칼륨을 끼워 넣은 구조(옆모습).png|썸네일|300픽셀|오른쪽|칼륨 흑연. 흑연층 사이에 칼륨을 끼워 넣은 구조(옆모습)]] | ||
| + | 흑연 층간 물질(Graphite intercalation compound)은 흑연 사이에 다른 물질을 끼워넣은 화합물이다. 흑연의 각 층은 서로 상호 작용을 하는 상태로 유지하고 있으며, 그 사이에 분자나 원자가 끼워 들어간 형태이다. 보통 금속 원자를 끼워 넣은 물질이 많이 존재하며, 금속과 흑연이 결합을 할 때, 금속의 자유 전자가 흑연 층으로 이동하여 보통 평면상의 전기 전도도가 증가한다. 만약 플루오르화물이나 산화물이 끼워 들어가서 흑연과 공유 결합을 하게 되면 전기 전도도는 감소하게 된다. 최근 [[칼슘]](Ca)이 들어간 흑연 층간 물질에서 고온 초전도성이 나타나 주목받고 있으며, 전자-포논 상호작용(electron-phonon interaction)이 그 주된 원인이 될 것이라고 예상하고 있다. | ||
== 참고자료 == | == 참고자료 == | ||
| 17번째 줄: | 52번째 줄: | ||
* 〈[https://namu.wiki/w/%ED%9D%91%EC%97%B0l 흑연]〉, 《나무위키》 | * 〈[https://namu.wiki/w/%ED%9D%91%EC%97%B0l 흑연]〉, 《나무위키》 | ||
* 〈[http://encykorea.aks.ac.kr/Contents/Item/E0065903 흑연(黑鉛)]〉, 《한국민족문화대백과사전》 | * 〈[http://encykorea.aks.ac.kr/Contents/Item/E0065903 흑연(黑鉛)]〉, 《한국민족문화대백과사전》 | ||
| + | * 〈[https://ko.wikipedia.org/wiki/%ED%9D%91%EC%97%B0_%EC%B8%B5%EA%B0%84_%EB%AC%BC%EC%A7%88 흑연 층간 물질]〉, 《위키백과》 | ||
== 같이 보기 == | == 같이 보기 == | ||
| 24번째 줄: | 60번째 줄: | ||
* [[실리콘]] | * [[실리콘]] | ||
| − | {{배터리| | + | {{배터리|검토 필요}} |
2021년 6월 28일 (월) 14:02 판
흑연(黑鉛, graphite)은 탄소의 동소체 중 하나이다. 다른 명칭으로 석묵(石墨)이라고도 한다. 천연에서 산출되기도 하고, 인공적으로 제조되기도 한다. 흑연의 영어 이름인 "graphite"는 "(글 따위를) 쓰다"라는 뜻을 가진 그리스어 "graphein"에서 유래되었다.
다이아몬드나 숯처럼 주 구성 성분은 탄소지만 분자구조가 판 형식으로 되어 있어 잘 부스러지는 암석. 그래서 연필의 주요 재료로 사용된다. 연필의 연(鉛)은 납 연자인데, 흑연 연필 이전에 사용하던 납 펜과 비슷하게 쓸 수 있다 하여 검은 색을 내는 납(鉛) 즉 "Black lead"라고 한 것이다. 탄소 원자 하나당 3개의 탄소 원자와 공유 결합하는데, 이 때 남은 전자 하나는 자유전자가 된다. 흑연이 도체인 이유도 이 때문. 층과 층 사이에는 판데르발스 힘이 작용한다.
흑연은 오래 전부터 지금까지 꾸준하게 리튬 2차전지의 음극활물질로 사용되고 있다. 흑연은 아주 규칙적인 형태로 탄소Carbon가 결합된 하나의 층이 여러 겹 쌓인 층상구조이다. 리튬이온이 양극에서 음극으로 이동하는 충전 과정에서 음극에 도달한 리튬이온은 흑연층 사이에 저장된다. 그런데 이때 리튬이온이 들어간 흑연은 팽창되어 미세하게 부피가 늘어나게 된다. 이것이 반복되면 점차 구조 변화를 일으켜 배터리 수명도 감소하게 된다. 배터리 수명에 있어서도 음극재가 중요한 요인 중 하나이다. 최근 배터리 업계는 고용량 배터리를 향한 시대적 요구에 맞춰 차세대 음극활 소재 개발이 진행되고 있다.
개요
흑연은 다이아몬드와 화학성분이 같고, 결정구조가 달라 동질이상(同質異像) 관계에 있다. 육각의 판상결정체로 산출되는데, 결정의 크기에 따라 인상흑연(鱗狀黑鉛)과 토상흑연(土狀黑鉛)으로 구분된다. 전자는 육안으로 식별될 정도의 크기이고, 후자는 미세한 것으로 육안 또는 현미경으로도 결정의 식별이 어렵다. 흑색으로 금속광택을 내며 표면은 부드러운 지방감(脂肪感)을 준다.모스 경도(Moh’s hardness) 1 정도로 매우 연하고 비중은 2.09∼2.23이다. 화성암·퇴적암·변성암내에서 광범하게 나타나나 경제적인 가치를 가지는 흑연광상은 대부분 변성작용을 받은 암석에서 나타난다.
국내에서 경제적인 가치가 있는 흑연광상의 일반적인 산상은 편마암·결정편암과 같은 변성퇴적암류 중에 인상흑연이 산재하는 경우와 석탄층이 강한 동력변성작용, 또는 화성암관입시의 열변성작용에 의하여 토상흑연이 산출되는 경우이다. 전자의 예로는 경기도 청평·가평·시흥 지역과 충청남도 공주지역, 경상남도 곡성지역이 있고, 후자의 예로는 경상북도 문경지역의 석탄이 흑연으로 변성된 것이 대표적이다. 이 밖에도 대리암(大理岩) 중에 인상흑연이 산재하거나, 부분적으로 농집되거나 화성암에 수반하여 광염상·맥상으로 산출되기도 하나 경제적 가치는 적다. 한국은 1905년경 경상북도 상주 및 함경남도 영흥에서 토상흑연이 처음으로 채광되고, 1907년경에 평안북도 용암포 부근에서 인상흑연이 처음으로 채광된 이래 오늘날까지 세계에서 중요한 흑연 생산국의 하나가 되었다. 흑연은 한국의 특수광물이며, 한국에서의 흑연광업은 비교적 역사가 오래되었다. 1914년에 이미 부유선광(浮游選鑛)을 사용한 곳도 있었으며, 1917년에는 흑연광업이 급격히 발전하여 가행된 광구수가 130여 개, 생산량이 1만 6000t에 이르렀다. 1933년에는 토상흑연 2만 740t, 인상흑연 1,937t을 산출하여 세계 제1위의 산출국이었다.1970년대 전 세계 흑연생산량은 연간 50만∼60만t이며, 우리 나라는 5만∼6만t을 생산하여 세계 생산량의 10%를 차지하였다. 특히 북한의 생산량이 남한보다 약간 많은 것으로 추정되기 때문에 남북한 총생산량을 합치면 소련(연 12만t)·중국(연 10만t)보다 많은 세계 제일의 흑연생산국이 될 수 있다.
오늘날 세계적인 흑연수출국은 말라가시·노르웨이·스리랑카·중국·한국 등이며, 우리 나라는 토상흑연의 수출량이 많다. 흑연은 열과 전기의 좋은 전도체이며, 보통 3,500℃ 정도에서 용융(고체가 열에 녹아 액체로 되는 일)된다.또한 완전한 저면벽개(底面劈開)로 인하여 매우 낮은 마찰계수를 가진다. 이러한 성질 때문에 전극·탄소봉·내화재료·주형(鑄型) 재료·감마재(減磨材) 및 연필 등으로 이용된다. 이 밖에도 특수강인 탄소강원료, 원자로에서 중성자의 감속재, 방청용(防錆用)의 특수포장, 금속표면의 코팅, 고무공업원료 등에 많이 쓰인다.
천연에서의 존재
소량의 무기물과 유기물이 포함되어 있으면서 산화적 환경에 노출되지 않고 접촉 변성 작용 또는 광역 변성 작용을 받아 생성된 사암, 셰일, 석탄, 석회암 등의 암석과 함께 천연에서 산출될 수 있고, 환원성 환경에서 생성된 사문암, 석회암과 함께 발견되기도 한다. 주로 편마암, 편암 등과 함께 발견된다. 스리랑카, 마다가스카르, 조선민주주의인민공화국, 멕시코의 소노라주, 캐나다의 온타리오주, 서시베리아, 미국의 뉴욕주에 상당량이 매장되어 있다. 흑연은 간혹 운석에서도 발견되는 경우가 있다.
성질
흑연은 굳기가 약 1.5로 매우 부드러운 편이다. 비중은 2.23이지만, 구멍이나 불순물에 의해서 더 낮아질 수 있다. 색은 흑색에서 철회색을 띠며 금속광택을 가진다. 녹는점, 끓는점 등은 명확하지 않다. 전기 전도체로 작용하며, 전기저항은 방향에 따라 큰 차이를 보인다. 천연일 경우 결정의 형태는 육각 판 모양의 편평한 모양이며, 인공일 경우 결정은 비늘상이나 덩어리상이다. 내열성, 내열충격성, 내식성이 강하고 전기 및 열 전도성이 좋은 편이다.
흑연의 구조는 탄소 여섯 개로 이루어진 고리가 연결되어 층을 이룬 모양으로 c값(층간 간격의 2배)은 6.696Å, 탄소간 결합 길이는 1.42Å이다. 흑연의 단위격자는 탄소 원자 4개를 포함한다. 격자상수는 2.456Å이다.
화학적으로는 상당히 안정한 물질로 공기 중에서의 발화점은 500~600°C 또는 그 이상이다. 산소 중에서 가열하면 600~700°C에서 이산화 탄소가 된다. 분말을 진한 황산과 진한 질산의 혼합물로 처리하면 녹갈색의 산화흑연을 얻을 수 있다. 또한 진한 황산과 산화제와 함께 가열하면 광택이 있고 청자색의 물질인 황산수소흑연이 된다. 질산으로 산화시키면 멜리트산을 얻을 수 있다.
인조흑연
인공적으로 합성된 흑연은 성질의 편차가 심하기 때문에 공업용으로는 잘 사용되지 않는다. 제유 과정에서 생산되는 코크스를 탄소 공급원으로 하여 만들어지는 경우가 많다.
인조흑연은 미국의 에드워드 굿리치 애치슨에 의해서 처음으로 합성되었다. 그는 탄화 규소로 실험을 하다가 4150°C에서 탄화 규소의 규소성분이 증발해 버리고 남은 탄소가 흑연의 형태로 남아 있는 것을 발견하였다. 1896년 애치슨은 흑연 생산에 대한 특허를 냈으며 상업적인 인조 흑연 생산은 1897년부터 이루어졌다.
인조흑연은 무정형 탄소를 고온으로 가열하여 만들어지는데, 일반적으로는 2500~3000°C로 가열하지만 천연 흑연의 구조와 가깝게 만들기 위해서는 더 높은 온도가 필요하다. 또한 원료 탄소 화합물의 구조에 따라서는 인조 흑연으로 만들기가 어려운 경우도 있다.
용도
흑연은 주로 다음과 같은 용도로 사용된다.
- 대표적으로 연필 혹은 샤프의 심으로 재료가 사용된다. 이때 흑연을 점토와 섞어 굳기를 조절한다.
- 로켓의 케이스나 화학 공정에서의 내열성 장비의 재료로 사용된다. 이 경우 약 3000°C 이상의 온도까지 견딜 수 있다.
- 화학 공정에서의 내식성 기구의 재료로 사용된다.
- 전기 용광로의 전극이나 전기 분해를 위한 기구의 재료로 사용된다.
- 원자로에서 중성자 감속재 및 반사재로 사용된다.
- 많은 물건의 주형으로 사용된다.
- 층상을 이루고 있어 미끄럽기 때문에 윤활제, 감마제로도 사용된다.
최초로 그래핀을 분리해낸 물질이기도 하다. 2004년, 영국 맨체스터 대학의 안드레 가임(Andre Geim) 연구팀과 러시아 Chernogolovka 마이크로일렉트로닉스 연구팀이 스카치 테이프에 흑연을 붙인 후 테이프를 사용해서 분리해냈다. 그 그룹에서는 가끔씩 진행하는 연구와는 무관하게 호기심을 충족하기 위해 간단한 실험이나 연구를 하곤 했다고 한다. 실제로 가임은 이런 엉뚱한 실험 중 하나인 '자기장으로 개구리를 공중부양시키기'를 연구해서 2000년 이그노벨상 물리학상을 수상하기도 했다. 어느 날 "세상에서 가장 얇은 물질을 만들어 볼까?" 하면서 착안한 것이 스카치 테이프와 흑연. 그리고 곧바로 스카치 테이프에 흑연을 붙인 후 테이프를 붙였다 떼었다 하니까 기하급수적으로 얇아지면서 최종적으로 단일 원자 두께의 그래핀을 분리해 냈다고 한다. 정확한 원리는, 흑연에 스카치 테이프를 붙이면, 그래핀 표면과 스카치 테이프의 접착력으로 인한 결합이 그래핀 사이의 결합보다 더 강해지게 되고, 이 상태에서 스카치 테이프를 떼내면 그래핀이 스카치 테이프에 붙은 채 떨어지게 되었다. 안드레 가임은 이 연구로 2010년 노벨물리학상을 수상했다.
흑연 층간 물질
흑연 층간 물질(Graphite intercalation compound)은 흑연 사이에 다른 물질을 끼워넣은 화합물이다. 흑연의 각 층은 서로 상호 작용을 하는 상태로 유지하고 있으며, 그 사이에 분자나 원자가 끼워 들어간 형태이다. 보통 금속 원자를 끼워 넣은 물질이 많이 존재하며, 금속과 흑연이 결합을 할 때, 금속의 자유 전자가 흑연 층으로 이동하여 보통 평면상의 전기 전도도가 증가한다. 만약 플루오르화물이나 산화물이 끼워 들어가서 흑연과 공유 결합을 하게 되면 전기 전도도는 감소하게 된다. 최근 칼슘(Ca)이 들어간 흑연 층간 물질에서 고온 초전도성이 나타나 주목받고 있으며, 전자-포논 상호작용(electron-phonon interaction)이 그 주된 원인이 될 것이라고 예상하고 있다.
참고자료
같이 보기

 위키원
위키원