"건전지"의 두 판 사이의 차이
잔글 |
(→참고자료) |
||
| (사용자 2명의 중간 판 5개는 보이지 않습니다) | |||
| 1번째 줄: | 1번째 줄: | ||
| + | [[파일:다양한 건전지.jpg|썸네일|300픽셀|오른쪽|다양한 건전지]] | ||
| − | '''건전지'''(乾電池, dry cell)는 "마른 전지"라는 뜻으로, 전해질을 수분이 거의 없는 상태로 둔 [[1차전지]](전기 화학 전지)이다. 이와는 반대로 | + | '''건전지'''(乾電池, dry cell)는 전기 배터리의 일종으로 "마른 전지"라는 뜻으로, 전해질을 수분이 거의 없는 상태로 둔 [[1차전지]](전기 화학 전지)이다. 대체로 휴대용 전자 기기에 사용된다. 이와는 반대로 습식전지(wet cell)는 거의 대부분 차량용 전지로 많이 쓰이는 연축전지와 같이 액체 상태의 전해질이 들어 있는 전지를 말한다. 건전지는 실제로 습기에서 완전히 해방된 것이 아니며 동작을 위해 약간의 수분은 함유하고 있어야 한다. 습식 전지와 달리 건전지는 자유 상태의 액체를 포함하지 않아 누출 없이 모든 방향으로 작동할 수 있어 휴대용 장비에 적합하다. |
| − | 일반적인 건전지는 망간전지 | + | 일반적인 건전지는 망간건전지(망간전지, 아연-탄소 전지)로, Leclanché cell이라 부르기도 한다. 정격 전압은 같은 아연-이산화망가니즈를 사용하기 때문에 알카라인 전지와 같은 1.5 V이다. 표준 건전지는 일반적으로 원통형의 아연 산화전극(anode)과 중심에 환원전극(cathode)인 탄소 막대가 박혀 있다. 전해질은 페이스트와 같은 형태인 염화암모늄으로 아연 산화전극 부근에 있다. 전해질과 탄소 환원전극 사이의 공간은 [[염화암모늄]]과 [[이산화망가니즈]]로 구성된 2차 페이스트로 채워져 있으며 이 물질은 감극제(depolarizer)로서 작용한다. '하이파워' 배터리로 판매되는 배터리는 염화암모늄 대신 염화아연을 사용한 것이다. |
| + | {{:자동차 배너|배터리}} | ||
== 개요 == | == 개요 == | ||
| 9번째 줄: | 11번째 줄: | ||
보통 전지는 전해액이 있어 이온화 과정의 전자를 이용하는 것을 전지라 부른다. 하지만 이 방식은 혹여 격벽에 흠이 생기면 전해액이 누수가 되고, 전지의 질량이 증가되는 문제점이 있었다. 이 문제점을 해결하기 위해 전해액을 섬유질이나 종이에 흡수시켜 액을 흐르지 않게 한 전지를 건(乾: 마른)전지라 부른다. | 보통 전지는 전해액이 있어 이온화 과정의 전자를 이용하는 것을 전지라 부른다. 하지만 이 방식은 혹여 격벽에 흠이 생기면 전해액이 누수가 되고, 전지의 질량이 증가되는 문제점이 있었다. 이 문제점을 해결하기 위해 전해액을 섬유질이나 종이에 흡수시켜 액을 흐르지 않게 한 전지를 건(乾: 마른)전지라 부른다. | ||
| − | 양극에는 통상 탄소봉이 사용되지만 반응에 관여하는 게 아니고 양극 재료인 망간에서 발생한 전류를 모으는 도체 역할만 하므로 정확히는 망간-아연 전지. 실제 양극 재료는 가루 형태의 | + | 양극에는 통상 탄소봉이 사용되지만 반응에 관여하는 게 아니고 양극 재료인 망간에서 발생한 전류를 모으는 도체 역할만 하므로 정확히는 망간-아연 전지. 실제 양극 재료는 가루 형태의 이산화망가니즈. 이산화망가니즈를 쓰는 이유는 전지 방전 시 양극에서 수소가 발생하는 분극현상이 일어나 반응을 방해하는데 [[이산화망가니즈]]가 [[수소]]를 [[산화]]시켜 [[물]]로 만들어 제거하는 소극제(감극제) 역할을 한다. |
| − | 알카리 전지는 전해질을 염화암모늄 염 대신 강알칼리인 수산화 칼륨을 쓰는 것만 다르고 양극 음극 재료는 | + | 알카리 전지는 전해질을 염화암모늄 염 대신 강알칼리인 수산화 칼륨을 쓰는 것만 다르고 양극 음극 재료는 이산화망가니즈-아연을 쓰는 건 같으므로 알칼리 전지도 엄밀히는 망간-아연전지의 일종이다. |
| − | 과거에는 바깥에 음극 재료인 아연 원통이 있고 양극 재료인 | + | 과거에는 바깥에 음극 재료인 아연 원통이 있고 양극 재료인 이산화망가니즈 분말을 전해액과 혼합해 풀처럼 끈끈하게 해서 원통 안에 채우고 중심에 전도체인 탄소봉을 꽂아 쓰는 식이었다. 하지만 이런 방식은 전지가 소모되면 아연 원통이 부식해서 터져 전해액이 새기도 하고 비싼 재료인 아연이 낭비되어 비경제적이다. 그래서 현대의 건전지는 과거와는 반대로 음극 재료인 아연 분말을 중심에 두고 아래쪽에서 탄소봉을 꽂아 음극에 연결하고 양극재인 이산화망가니즈를 바깥쪽에 원통형으로 배치하고 별도의 철제 금속통으로 감싸 양극 전도체 및 양극 단자 역할을 겸하는 구조로 만든다. 이건 전지를 다 써도 잘 새지 않는다. |
== 역사 == | == 역사 == | ||
| − | 우리가 사용하는 건전지는 1870년 프랑스 화학자 | + | 우리가 사용하는 건전지는 1870년 프랑스 화학자 [[르클랑셰]]가 만든 기전력 1.5V을 내는 [[르클랑셰 전지]]가 그 원형이다. 1886년 독일인 [[카를 가스너]](Carl Gassner)가 기존의 전해질 용액을 사용하는 전지가 아닌 오늘날과 같이 이산화망가니즈를 양극으로 삼고 아연을 음극으로 삼고 전해액으로 염화암모늄을 석고와 섞어 풀을 만들어 아연 원통에 채우는 방식으로 개량한 전지의 특허를 독일과 미국에서 냈으며, 1896년 대량 생산에 들어갔다. 생산을 용이하게 하기 위해 석고 대신 염화암모늄을 먹인 종이를 넣어 다시 한 번 개량이 이루어졌으며, 같은 해에 손전등이 발명되었다. 이 당시에는 6인치 또는 No.6이라 불렸으며, 이름 그대로 6인치 길이에 2.5인치 지름의 원통형 셀이었다. |
1899년, 스웨덴의 과학자인 융너(Waldemar Jungner)는 니켈-철 전지와 니켈-카드뮴 전지를 최초로 발명했고, 토머스 에디슨도 별도로 니켈-철 전지를 발명해 전기자동차의 동력원으로 쓰기도 했다. | 1899년, 스웨덴의 과학자인 융너(Waldemar Jungner)는 니켈-철 전지와 니켈-카드뮴 전지를 최초로 발명했고, 토머스 에디슨도 별도로 니켈-철 전지를 발명해 전기자동차의 동력원으로 쓰기도 했다. | ||
1912년 미국에서 건전지 규격의 통일을 논의하기 시작하였고, 1917년 제1차 세계 대전 발발과 함께 규격화 생산을 위해 구체적인 논의 및 실험에 들어가 1919년 현대의 건전지 규격이 발표되었다. 다만 그 당시에는 건전지 기술이 급격히 발달하던 시기여서 기술 발전을 포함한 최종 수정안은 1924년 확정되었다. 이 때 A, B, C 등의 규격을 정하게 되었으며, 이후로도 수차례 개정을 거쳤지만 큰 변화가 없이 1959년 최종 규격을 현재까지 사용 중이다. 1967 년에 새로 개발된 알칼라인 건전지 규격을 추가했지만 크기나 형태는 기존 규격을 따른다. 건전지 규격인 알파벳의 의미는 같은 알파벳이면 동일 전압, 그 뒤에 붙는 숫자 및 추가 알파벳에 따라 추가 셀의 직렬/병렬 연결, 산업별 용도 등으로 세분화된다. 하지만 전자 산업이 발전한 현대에서는 특수 산업 기기용 배터리가 아닌 이상 AA 같은 가장 많이 쓰이는 건전지에 맞춰서 회로를 제작하기 때문에, 4F2d 같은 전지는 더 이상 찾아볼 수 없다. 최근(1999년)에도 업데이트 되고 있지만 리튬이온 등 2차 전지 위주로 갱신되고 있기 때문에 건전지에서는 완전히 새로운 규격을 보긴 쉽지 않을 것이다. | 1912년 미국에서 건전지 규격의 통일을 논의하기 시작하였고, 1917년 제1차 세계 대전 발발과 함께 규격화 생산을 위해 구체적인 논의 및 실험에 들어가 1919년 현대의 건전지 규격이 발표되었다. 다만 그 당시에는 건전지 기술이 급격히 발달하던 시기여서 기술 발전을 포함한 최종 수정안은 1924년 확정되었다. 이 때 A, B, C 등의 규격을 정하게 되었으며, 이후로도 수차례 개정을 거쳤지만 큰 변화가 없이 1959년 최종 규격을 현재까지 사용 중이다. 1967 년에 새로 개발된 알칼라인 건전지 규격을 추가했지만 크기나 형태는 기존 규격을 따른다. 건전지 규격인 알파벳의 의미는 같은 알파벳이면 동일 전압, 그 뒤에 붙는 숫자 및 추가 알파벳에 따라 추가 셀의 직렬/병렬 연결, 산업별 용도 등으로 세분화된다. 하지만 전자 산업이 발전한 현대에서는 특수 산업 기기용 배터리가 아닌 이상 AA 같은 가장 많이 쓰이는 건전지에 맞춰서 회로를 제작하기 때문에, 4F2d 같은 전지는 더 이상 찾아볼 수 없다. 최근(1999년)에도 업데이트 되고 있지만 리튬이온 등 2차 전지 위주로 갱신되고 있기 때문에 건전지에서는 완전히 새로운 규격을 보긴 쉽지 않을 것이다. | ||
| + | |||
| + | == 구조 == | ||
| + | [[파일:건전지의 구조(한국물리학회).png|썸네일|300픽셀|오른쪽|설명]] | ||
| + | 구조는 원통 모양 또는 사각기둥 모양이며, 바깥쪽은 음극 아연제의 원통으로 용기를 겸하고 있다. 중앙에 탄소 양극이 있으며, 그 주위에는 이산화망가니즈와 흑연을 섞어 반죽한 것을 고압에서 압착시켰다. 그 바깥쪽은 전해액(염화암모늄)을 충분히 흡수시킨 펄프·면지(綿紙)이다. 또 풀로 격벽(隔壁)을 삼고, 이것으로 전해질의 저장고를 겸하는 것도 있다. 위쪽에 공기실이 있으며, 그 위를 피치 등으로 채웠다. 건전지는 매년 그 생산이 확대되어 통신용 전원, 벨, 라디오, 플래시램프, 전지시계 등 대단히 넓은 범위에 이용된다. | ||
| + | |||
| + | 특수한 건전지로는 보통의 건전지들을 직렬로 여러 개 연결한 적층건전지 등 여러 가지가 있다. 소형 휴대용 라디오·보청기의 전원으로, 또는 패크전지로서 포토플래시의 전원으로도 사용된다. 이 밖에 내한건전지(耐寒乾電池)가 있는데, 보통 건전지는 영하 20℃ 정도에서 전해액이 동결해 버리기 때문에, 모노메틸아민의 염산염전지(영하 45℃에서 동결) 등이 개발되어 있다. | ||
| + | |||
| + | == 원리 == | ||
| + | 건전지는 [[아연]]과 [[이산화망가니즈]] 사이의 전기 화학 반응으로 정격 정압이 1.5 V인 1차 전지이며, 한번 방전이 되면 다시 충전이 되지 않는 일회용 전지이다. | ||
| + | |||
| + | '''(-)극(산화반응) : Zn → Zn²⁺ + 2e⁻[E° = -0.7626V]''' | ||
| + | |||
| + | 건전지 외부에 있는 아연은 산화되면서 아연(Zn)은 아연 이온(Zn²⁺)이 되어 전해질 속에 녹게 되고 외부에 있는 아연에는 전자를 남겨 (-)극을 띠게 된다. 이 때 전해질 속에 녹아 있는 염화암모늄은 전리해서 암모늄 이온(NH⁴⁺)과 염화 이온(Cl⁻)이 된다. | ||
| + | |||
| + | '''NH₄Cl → NH₄⁺ + Cl⁻''' | ||
| + | |||
| + | 전해질 속의 암모늄 이온은 아연 이온(Zn²⁺)에 의해 탄소 막대 쪽으로 모이게 되고 탄소 막대에서 전자를 얻어 암모니아(NH₃)와 수소(H₂)로 분해된다. | ||
| + | |||
| + | '''2NH₄⁺ + 2e⁻ → 2NH₃+ H₂↑''' | ||
| + | |||
| + | 탄소 막대는 전자가 부족하므로 (+)극이 된다. 탄소 환원전극 근처의 이산화망가니즈(MnO₂)은 (+)극에서 발생한 수소 가스(H₂)와 반응한다. | ||
| + | |||
| + | '''2MnO₂ + H₂→ MnO₃+ H₂O''' | ||
| + | |||
| + | 이 때 발생하는 암모니아 기체는 아연-암모니아 착물 이온을 형성해 암모니아 기체의 생성을 막아준다. | ||
| + | |||
| + | '''4NH₃⁺ + Zn²⁺ → Zn(NH₃)₄²⁺''' | ||
| + | |||
| + | 즉, (+)극에서 일어나는 반응은 다음과 같다. | ||
| + | |||
| + | '''(+)극(환원반응) : 2MnO₂+ 2NH₄+ 2e⁻ → Mn₂O₃+ 2NH₃+ H₂O[E°≈ +0.5V]''' | ||
| + | |||
| + | (-)극과 (+)극에서 일어나는 반응식을 결합하면 | ||
| + | |||
| + | '''Zn + 2MnO₂ + 2NH₄→ Mn₂O₃+ H₂O + Zn₂ + 2NH₃''' | ||
| + | |||
| + | 이러한 반응으로 인해 화학에너지가 전기 에너지로 변환된다. 그리고 에너지는 외부 회로를 통해 배터리에서 연결된 장치로 흐른다. | ||
| + | |||
| + | == 분류 == | ||
| + | === 형태에 따른 분류 === | ||
| + | * 1.5V | ||
| + | :* AAAA(LR8D425)/UM-6(単6式)(日 JIS 규격): 서피스 펜과 같은 스타일러스 제품에 주로 들어간다. | ||
| + | :* AAA(R03/망간, LR03/알카라인)/UM-4(単4式)(日) | ||
| + | :* AA(R06/망간, LR06/알카라인)/UM-3(単3式)(日)/Mignon(유럽) | ||
| + | :* CM(R14/망간, LR14/알카라인)/UM-2(単2式)(日) | ||
| + | :* DM(R20/망간, LR20/알카라인)/UM-1(単1式)(日) | ||
| + | :* E90/N(R1/망간, LR1/알카라인)/UM-5(単5式)(日) | ||
| + | |||
| + | * 6F22 | ||
| + | :*9V 망간 배터리. | ||
| + | |||
| + | *6LR61 : 9V 배터리. 외양과 크기는 6F22 배터리와 완전히 동일하고 전압도 같지만, 이쪽은 망간이 아닌 알카라인으로 내부에 AAAA 사이즈 셀을 6개 뭉쳐 놓았다. 다만 에너자이저나 맥스웰 등의 업체에선 6F22 모양의 제품까지도 죄다 6LR61으로 표기해 두기 때문에, 분해를 위해 살 경우에는 낚이지 않도록 주의해야 한다. 우리나라에서 AAAA를 구하기 어렵기 때문에 델 베뉴(태블릿 컴퓨터) 스타일러스 펜 등 AAAA를 쓰는 제품 사용자들이 많이 찾는데, 같은 규격의 6F22를 샀다가 낚이는 경우가 많다. 주로 미국산 듀라셀 이나 다이소 NEO 9V가 이 형태이다. 우리나라에 들어오는 9V 듀라셀은 대부분 말레이시아산이 6F22, 미국산이 6LR61이다. | ||
| + | |||
| + | * 4FM (4R25) : 6V 배터리. 주로 랜턴, 즉 큰 손전등에 사용된다. 전지 상단 끝에 스프링으로 된 전극 2개가 있다. D보다 약간 큰 F 사이즈의 R25 1.5V 전지 4개가 들었다. | ||
| + | * A23 : 반토막 건전지라고 부르는 것으로 무려 12V이다. 까 보면 단추형 전지가 8개 들었다. 진짜 AA를 반토막낸 사이즈의 건전지인 ER14250도 있는데, 이건 3.6V짜리 리튬 전지이다. | ||
| + | |||
| + | * 4LR44 : 버튼 전지 LR44 4개를 일렬로 묶어놓은 것. | ||
| + | |||
| + | * 4LR61 : J라고도 불린다. 위에 6LR61에 들어가는 AAAA 셀이 4개 들어간 것으로 한 쪽 모서리가 잘린 두꺼운 카드 형태로 옛날에는 카메라에 사용했고 요즘은 혈당계 등 의료기기에 사용한다. | ||
| + | |||
| + | 여담으로 원래 아래 AAAA~DM까지는 모두 뒤에 'M'자를 붙여서 나타내든가, 아니면 위 이미지처럼 M자를 빼고 표현하는데 C, D는 글자수가 작아 아래처럼 CM, DM처럼 부르지만 AA, AAA 등은 A자 반복이라 아래처럼 M을 빼고 부르는 게 일반적이다. 과거에는 이들도 AAM, AAAM같이 꼭 M자를 붙여서 표현했다. 군대에서는 통상명칭보다 lr6, lr3으로 많이 호칭한다. | ||
| + | |||
| + | AA와 CM, DM은 있는데 왜 AM과 BM은 없는지 궁금해할 사람도 있는데, 원래는 AM과 BM 사이즈도 존재하였다. AM은 17mm 지름, 50mm 길이였으며, BM은 21.5mm 지름, 60mm 길이였다. AM은 현재 볼 수 없으며, BM은 유럽에서 자주 쓰이는 4.5볼트 배터리인 3R12를 뜯으면 3개가 나온다. | ||
| + | |||
| + | 이들과 비슷한 규격을 쓰는 것으로 니켈카드뮴 전지와 니켈수소 전지가 있는데, 규격 자체는 비슷해도 이 둘은 충전이 가능한 충전지, 축전지라고 한다. | ||
| + | |||
| + | ==== 단추형 건전지 ==== | ||
| + | 국제표기 규격인 LR(알카라인)과 SR(산화은), CR(리튬-이산화망가니즈)를 베이스로 하고 한국 쇼핑몰에서도 잘 사용하는 홍콩 규격인 AG(알카라인), SG(산화은) 규격을 병기한다. 이외에도 어느 나라에서 생산되고 유통되냐에 따라서 명칭이 다 다르다. 오랫동안 생산되어 와서 그런지 정작 규격은 똑같은데 나라별 규격 명칭이 난립하는 상황. 리튬은 CR(리튬-이산화망가니즈), FR(리튬-황철석), BR(리튬-플루오린화탄소)로 나뉜다. 흔한건 CR과 FR이다. | ||
| + | |||
| + | 손목시계나 초소형 손전등, 공학용 계산기 등에 들어가는 단추형 건전지(버튼형 건전지라고도 한다)는 흔히 수은전지라는 이름으로 부르고 있지만, 정작 진짜 수은전지는 이미 1995년경에 생산 중지되었다. 요즘에 흔히 수은전지라고 부르는 것들은 단추형 알칼라인/산화은/리튬전지. 다만 과거에는 단추형 전지의 대부분이 수은전지였다 보니 지금까지도 그 명칭이 관례적으로 굳힌 것으로 보인다. | ||
| + | |||
| + | 수요가 줄기 시작하면서 재고로 남아있는 물건들의 연식이 오래되어 상태가 불량한 경우가 많아(이를테면 필름 카메라에 쓰이는 LR44) 잘 포장된 새 제품이라도 구입 시에 주의가 필요하다. 특히 문방구 등에서 살 때는 더욱 더. 그냥 다이소가서 사자. 다이소에 명품시계전용 동전전지 빼고 밑에있는 LR, CR규격 다 있다. 열쇠고리 라이트에서 주로쓰는 건 LR44또는 CR2032가 대부분이다. 그래도 반다이 장난감 또는 포켓몬고 플러스는 단추형을 사용해서 찾는 사람이 있다. | ||
| + | |||
| + | * LR60, SR60 (AG1, SG1) | ||
| + | * LR66, SR66 (AG4, SG4) | ||
| + | * LR41, SR41 (AG3, SG3) | ||
| + | * LR45, SR45 (AG9, SG9) | ||
| + | * LR57, SR57 (AG7, SG7) | ||
| + | * LR44, SR44, SR44SW (AG13, SG13, AG14) | ||
| + | * 리튬 배터리인 CR 규격은 배터리의 크기이다. ex) CR2032 = 지름 20mm / 두께 3.2mm | ||
| + | |||
| + | == 동영상 == | ||
| + | <youtube>UjgDGdqk2ic</youtube> | ||
== 참고자료 == | == 참고자료 == | ||
| 26번째 줄: | 111번째 줄: | ||
* 〈[https://ko.wikipedia.org/wiki/%EA%B1%B4%EC%A0%84%EC%A7%80 건전지]〉, 《위키백과》 | * 〈[https://ko.wikipedia.org/wiki/%EA%B1%B4%EC%A0%84%EC%A7%80 건전지]〉, 《위키백과》 | ||
* 〈[https://terms.naver.com/entry.naver?docId=1058656&cid=40942&categoryId=32374 건전지]〉, 《두산백과》 | * 〈[https://terms.naver.com/entry.naver?docId=1058656&cid=40942&categoryId=32374 건전지]〉, 《두산백과》 | ||
| + | * 〈[https://terms.naver.com/entry.naver?docId=5741250&cid=60217&categoryId=60217 건전지]〉, 《물리학백과》 | ||
== 같이 보기 == | == 같이 보기 == | ||
| − | * [[ | + | * [[단추형]] |
| − | {{배터리| | + | {{배터리|검토 필요}} |
2023년 4월 10일 (월) 00:05 기준 최신판
건전지(乾電池, dry cell)는 전기 배터리의 일종으로 "마른 전지"라는 뜻으로, 전해질을 수분이 거의 없는 상태로 둔 1차전지(전기 화학 전지)이다. 대체로 휴대용 전자 기기에 사용된다. 이와는 반대로 습식전지(wet cell)는 거의 대부분 차량용 전지로 많이 쓰이는 연축전지와 같이 액체 상태의 전해질이 들어 있는 전지를 말한다. 건전지는 실제로 습기에서 완전히 해방된 것이 아니며 동작을 위해 약간의 수분은 함유하고 있어야 한다. 습식 전지와 달리 건전지는 자유 상태의 액체를 포함하지 않아 누출 없이 모든 방향으로 작동할 수 있어 휴대용 장비에 적합하다.
일반적인 건전지는 망간건전지(망간전지, 아연-탄소 전지)로, Leclanché cell이라 부르기도 한다. 정격 전압은 같은 아연-이산화망가니즈를 사용하기 때문에 알카라인 전지와 같은 1.5 V이다. 표준 건전지는 일반적으로 원통형의 아연 산화전극(anode)과 중심에 환원전극(cathode)인 탄소 막대가 박혀 있다. 전해질은 페이스트와 같은 형태인 염화암모늄으로 아연 산화전극 부근에 있다. 전해질과 탄소 환원전극 사이의 공간은 염화암모늄과 이산화망가니즈로 구성된 2차 페이스트로 채워져 있으며 이 물질은 감극제(depolarizer)로서 작용한다. '하이파워' 배터리로 판매되는 배터리는 염화암모늄 대신 염화아연을 사용한 것이다.
| [타고] 1개월 단위로 전기차가 필요할 때! 타고 월렌트 서비스 |
개요[편집]
통상 공칭 기전력 전압은 1.5V이다. 한자로 乾(마를 건) 자를 써서 乾電池(건전지)라고 부르는 이유는 그 이전의 액체 전해질을 사용하는 습식전지와 구별해서 부르는 통칭으로, 전해액에 따라 망간 전지와 알칼리 전지를 통틀어 건전지라고 부른다. 1차 전지로서 일단 방전된 것은 다시 충전할 수가 없다.
보통 전지는 전해액이 있어 이온화 과정의 전자를 이용하는 것을 전지라 부른다. 하지만 이 방식은 혹여 격벽에 흠이 생기면 전해액이 누수가 되고, 전지의 질량이 증가되는 문제점이 있었다. 이 문제점을 해결하기 위해 전해액을 섬유질이나 종이에 흡수시켜 액을 흐르지 않게 한 전지를 건(乾: 마른)전지라 부른다.
양극에는 통상 탄소봉이 사용되지만 반응에 관여하는 게 아니고 양극 재료인 망간에서 발생한 전류를 모으는 도체 역할만 하므로 정확히는 망간-아연 전지. 실제 양극 재료는 가루 형태의 이산화망가니즈. 이산화망가니즈를 쓰는 이유는 전지 방전 시 양극에서 수소가 발생하는 분극현상이 일어나 반응을 방해하는데 이산화망가니즈가 수소를 산화시켜 물로 만들어 제거하는 소극제(감극제) 역할을 한다.
알카리 전지는 전해질을 염화암모늄 염 대신 강알칼리인 수산화 칼륨을 쓰는 것만 다르고 양극 음극 재료는 이산화망가니즈-아연을 쓰는 건 같으므로 알칼리 전지도 엄밀히는 망간-아연전지의 일종이다.
과거에는 바깥에 음극 재료인 아연 원통이 있고 양극 재료인 이산화망가니즈 분말을 전해액과 혼합해 풀처럼 끈끈하게 해서 원통 안에 채우고 중심에 전도체인 탄소봉을 꽂아 쓰는 식이었다. 하지만 이런 방식은 전지가 소모되면 아연 원통이 부식해서 터져 전해액이 새기도 하고 비싼 재료인 아연이 낭비되어 비경제적이다. 그래서 현대의 건전지는 과거와는 반대로 음극 재료인 아연 분말을 중심에 두고 아래쪽에서 탄소봉을 꽂아 음극에 연결하고 양극재인 이산화망가니즈를 바깥쪽에 원통형으로 배치하고 별도의 철제 금속통으로 감싸 양극 전도체 및 양극 단자 역할을 겸하는 구조로 만든다. 이건 전지를 다 써도 잘 새지 않는다.
역사[편집]
우리가 사용하는 건전지는 1870년 프랑스 화학자 르클랑셰가 만든 기전력 1.5V을 내는 르클랑셰 전지가 그 원형이다. 1886년 독일인 카를 가스너(Carl Gassner)가 기존의 전해질 용액을 사용하는 전지가 아닌 오늘날과 같이 이산화망가니즈를 양극으로 삼고 아연을 음극으로 삼고 전해액으로 염화암모늄을 석고와 섞어 풀을 만들어 아연 원통에 채우는 방식으로 개량한 전지의 특허를 독일과 미국에서 냈으며, 1896년 대량 생산에 들어갔다. 생산을 용이하게 하기 위해 석고 대신 염화암모늄을 먹인 종이를 넣어 다시 한 번 개량이 이루어졌으며, 같은 해에 손전등이 발명되었다. 이 당시에는 6인치 또는 No.6이라 불렸으며, 이름 그대로 6인치 길이에 2.5인치 지름의 원통형 셀이었다.
1899년, 스웨덴의 과학자인 융너(Waldemar Jungner)는 니켈-철 전지와 니켈-카드뮴 전지를 최초로 발명했고, 토머스 에디슨도 별도로 니켈-철 전지를 발명해 전기자동차의 동력원으로 쓰기도 했다.
1912년 미국에서 건전지 규격의 통일을 논의하기 시작하였고, 1917년 제1차 세계 대전 발발과 함께 규격화 생산을 위해 구체적인 논의 및 실험에 들어가 1919년 현대의 건전지 규격이 발표되었다. 다만 그 당시에는 건전지 기술이 급격히 발달하던 시기여서 기술 발전을 포함한 최종 수정안은 1924년 확정되었다. 이 때 A, B, C 등의 규격을 정하게 되었으며, 이후로도 수차례 개정을 거쳤지만 큰 변화가 없이 1959년 최종 규격을 현재까지 사용 중이다. 1967 년에 새로 개발된 알칼라인 건전지 규격을 추가했지만 크기나 형태는 기존 규격을 따른다. 건전지 규격인 알파벳의 의미는 같은 알파벳이면 동일 전압, 그 뒤에 붙는 숫자 및 추가 알파벳에 따라 추가 셀의 직렬/병렬 연결, 산업별 용도 등으로 세분화된다. 하지만 전자 산업이 발전한 현대에서는 특수 산업 기기용 배터리가 아닌 이상 AA 같은 가장 많이 쓰이는 건전지에 맞춰서 회로를 제작하기 때문에, 4F2d 같은 전지는 더 이상 찾아볼 수 없다. 최근(1999년)에도 업데이트 되고 있지만 리튬이온 등 2차 전지 위주로 갱신되고 있기 때문에 건전지에서는 완전히 새로운 규격을 보긴 쉽지 않을 것이다.
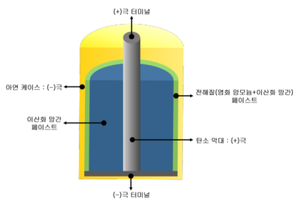
구조[편집]
구조는 원통 모양 또는 사각기둥 모양이며, 바깥쪽은 음극 아연제의 원통으로 용기를 겸하고 있다. 중앙에 탄소 양극이 있으며, 그 주위에는 이산화망가니즈와 흑연을 섞어 반죽한 것을 고압에서 압착시켰다. 그 바깥쪽은 전해액(염화암모늄)을 충분히 흡수시킨 펄프·면지(綿紙)이다. 또 풀로 격벽(隔壁)을 삼고, 이것으로 전해질의 저장고를 겸하는 것도 있다. 위쪽에 공기실이 있으며, 그 위를 피치 등으로 채웠다. 건전지는 매년 그 생산이 확대되어 통신용 전원, 벨, 라디오, 플래시램프, 전지시계 등 대단히 넓은 범위에 이용된다.
특수한 건전지로는 보통의 건전지들을 직렬로 여러 개 연결한 적층건전지 등 여러 가지가 있다. 소형 휴대용 라디오·보청기의 전원으로, 또는 패크전지로서 포토플래시의 전원으로도 사용된다. 이 밖에 내한건전지(耐寒乾電池)가 있는데, 보통 건전지는 영하 20℃ 정도에서 전해액이 동결해 버리기 때문에, 모노메틸아민의 염산염전지(영하 45℃에서 동결) 등이 개발되어 있다.
원리[편집]
건전지는 아연과 이산화망가니즈 사이의 전기 화학 반응으로 정격 정압이 1.5 V인 1차 전지이며, 한번 방전이 되면 다시 충전이 되지 않는 일회용 전지이다.
(-)극(산화반응) : Zn → Zn²⁺ + 2e⁻[E° = -0.7626V]
건전지 외부에 있는 아연은 산화되면서 아연(Zn)은 아연 이온(Zn²⁺)이 되어 전해질 속에 녹게 되고 외부에 있는 아연에는 전자를 남겨 (-)극을 띠게 된다. 이 때 전해질 속에 녹아 있는 염화암모늄은 전리해서 암모늄 이온(NH⁴⁺)과 염화 이온(Cl⁻)이 된다.
NH₄Cl → NH₄⁺ + Cl⁻
전해질 속의 암모늄 이온은 아연 이온(Zn²⁺)에 의해 탄소 막대 쪽으로 모이게 되고 탄소 막대에서 전자를 얻어 암모니아(NH₃)와 수소(H₂)로 분해된다.
2NH₄⁺ + 2e⁻ → 2NH₃+ H₂↑
탄소 막대는 전자가 부족하므로 (+)극이 된다. 탄소 환원전극 근처의 이산화망가니즈(MnO₂)은 (+)극에서 발생한 수소 가스(H₂)와 반응한다.
2MnO₂ + H₂→ MnO₃+ H₂O
이 때 발생하는 암모니아 기체는 아연-암모니아 착물 이온을 형성해 암모니아 기체의 생성을 막아준다.
4NH₃⁺ + Zn²⁺ → Zn(NH₃)₄²⁺
즉, (+)극에서 일어나는 반응은 다음과 같다.
(+)극(환원반응) : 2MnO₂+ 2NH₄+ 2e⁻ → Mn₂O₃+ 2NH₃+ H₂O[E°≈ +0.5V]
(-)극과 (+)극에서 일어나는 반응식을 결합하면
Zn + 2MnO₂ + 2NH₄→ Mn₂O₃+ H₂O + Zn₂ + 2NH₃
이러한 반응으로 인해 화학에너지가 전기 에너지로 변환된다. 그리고 에너지는 외부 회로를 통해 배터리에서 연결된 장치로 흐른다.
분류[편집]
형태에 따른 분류[편집]
- 1.5V
- AAAA(LR8D425)/UM-6(単6式)(日 JIS 규격): 서피스 펜과 같은 스타일러스 제품에 주로 들어간다.
- AAA(R03/망간, LR03/알카라인)/UM-4(単4式)(日)
- AA(R06/망간, LR06/알카라인)/UM-3(単3式)(日)/Mignon(유럽)
- CM(R14/망간, LR14/알카라인)/UM-2(単2式)(日)
- DM(R20/망간, LR20/알카라인)/UM-1(単1式)(日)
- E90/N(R1/망간, LR1/알카라인)/UM-5(単5式)(日)
- 6F22
- 9V 망간 배터리.
- 6LR61 : 9V 배터리. 외양과 크기는 6F22 배터리와 완전히 동일하고 전압도 같지만, 이쪽은 망간이 아닌 알카라인으로 내부에 AAAA 사이즈 셀을 6개 뭉쳐 놓았다. 다만 에너자이저나 맥스웰 등의 업체에선 6F22 모양의 제품까지도 죄다 6LR61으로 표기해 두기 때문에, 분해를 위해 살 경우에는 낚이지 않도록 주의해야 한다. 우리나라에서 AAAA를 구하기 어렵기 때문에 델 베뉴(태블릿 컴퓨터) 스타일러스 펜 등 AAAA를 쓰는 제품 사용자들이 많이 찾는데, 같은 규격의 6F22를 샀다가 낚이는 경우가 많다. 주로 미국산 듀라셀 이나 다이소 NEO 9V가 이 형태이다. 우리나라에 들어오는 9V 듀라셀은 대부분 말레이시아산이 6F22, 미국산이 6LR61이다.
- 4FM (4R25) : 6V 배터리. 주로 랜턴, 즉 큰 손전등에 사용된다. 전지 상단 끝에 스프링으로 된 전극 2개가 있다. D보다 약간 큰 F 사이즈의 R25 1.5V 전지 4개가 들었다.
- A23 : 반토막 건전지라고 부르는 것으로 무려 12V이다. 까 보면 단추형 전지가 8개 들었다. 진짜 AA를 반토막낸 사이즈의 건전지인 ER14250도 있는데, 이건 3.6V짜리 리튬 전지이다.
- 4LR44 : 버튼 전지 LR44 4개를 일렬로 묶어놓은 것.
- 4LR61 : J라고도 불린다. 위에 6LR61에 들어가는 AAAA 셀이 4개 들어간 것으로 한 쪽 모서리가 잘린 두꺼운 카드 형태로 옛날에는 카메라에 사용했고 요즘은 혈당계 등 의료기기에 사용한다.
여담으로 원래 아래 AAAA~DM까지는 모두 뒤에 'M'자를 붙여서 나타내든가, 아니면 위 이미지처럼 M자를 빼고 표현하는데 C, D는 글자수가 작아 아래처럼 CM, DM처럼 부르지만 AA, AAA 등은 A자 반복이라 아래처럼 M을 빼고 부르는 게 일반적이다. 과거에는 이들도 AAM, AAAM같이 꼭 M자를 붙여서 표현했다. 군대에서는 통상명칭보다 lr6, lr3으로 많이 호칭한다.
AA와 CM, DM은 있는데 왜 AM과 BM은 없는지 궁금해할 사람도 있는데, 원래는 AM과 BM 사이즈도 존재하였다. AM은 17mm 지름, 50mm 길이였으며, BM은 21.5mm 지름, 60mm 길이였다. AM은 현재 볼 수 없으며, BM은 유럽에서 자주 쓰이는 4.5볼트 배터리인 3R12를 뜯으면 3개가 나온다.
이들과 비슷한 규격을 쓰는 것으로 니켈카드뮴 전지와 니켈수소 전지가 있는데, 규격 자체는 비슷해도 이 둘은 충전이 가능한 충전지, 축전지라고 한다.
단추형 건전지[편집]
국제표기 규격인 LR(알카라인)과 SR(산화은), CR(리튬-이산화망가니즈)를 베이스로 하고 한국 쇼핑몰에서도 잘 사용하는 홍콩 규격인 AG(알카라인), SG(산화은) 규격을 병기한다. 이외에도 어느 나라에서 생산되고 유통되냐에 따라서 명칭이 다 다르다. 오랫동안 생산되어 와서 그런지 정작 규격은 똑같은데 나라별 규격 명칭이 난립하는 상황. 리튬은 CR(리튬-이산화망가니즈), FR(리튬-황철석), BR(리튬-플루오린화탄소)로 나뉜다. 흔한건 CR과 FR이다.
손목시계나 초소형 손전등, 공학용 계산기 등에 들어가는 단추형 건전지(버튼형 건전지라고도 한다)는 흔히 수은전지라는 이름으로 부르고 있지만, 정작 진짜 수은전지는 이미 1995년경에 생산 중지되었다. 요즘에 흔히 수은전지라고 부르는 것들은 단추형 알칼라인/산화은/리튬전지. 다만 과거에는 단추형 전지의 대부분이 수은전지였다 보니 지금까지도 그 명칭이 관례적으로 굳힌 것으로 보인다.
수요가 줄기 시작하면서 재고로 남아있는 물건들의 연식이 오래되어 상태가 불량한 경우가 많아(이를테면 필름 카메라에 쓰이는 LR44) 잘 포장된 새 제품이라도 구입 시에 주의가 필요하다. 특히 문방구 등에서 살 때는 더욱 더. 그냥 다이소가서 사자. 다이소에 명품시계전용 동전전지 빼고 밑에있는 LR, CR규격 다 있다. 열쇠고리 라이트에서 주로쓰는 건 LR44또는 CR2032가 대부분이다. 그래도 반다이 장난감 또는 포켓몬고 플러스는 단추형을 사용해서 찾는 사람이 있다.
- LR60, SR60 (AG1, SG1)
- LR66, SR66 (AG4, SG4)
- LR41, SR41 (AG3, SG3)
- LR45, SR45 (AG9, SG9)
- LR57, SR57 (AG7, SG7)
- LR44, SR44, SR44SW (AG13, SG13, AG14)
- 리튬 배터리인 CR 규격은 배터리의 크기이다. ex) CR2032 = 지름 20mm / 두께 3.2mm
동영상[편집]
참고자료[편집]
같이 보기[편집]

 위키원
위키원