"리튬 황 배터리"의 두 판 사이의 차이
잔글 |
잔글 |
||
| 10번째 줄: | 10번째 줄: | ||
리튬-황 배터리의 원리를 이해하려면 '셔틀' 메커니즘을 알아야 한다. | 리튬-황 배터리의 원리를 이해하려면 '셔틀' 메커니즘을 알아야 한다. | ||
| − | 방전 시 반응의 시작 물질은 고리 구조인 | + | 방전 시 반응의 시작 물질은 고리 구조인 S₈이다. 방전을 진행하면서 연속적인 환원 반응의 선형 구조인 리튬폴리설파이드(Li₂S₈ → Li₂Sₙ → Li₂S₂)의 단계를 거치게 되고, 전해질에 용해된 상태로 양극에서 음극으로 이동하며 더 낮은 단량체의 폴리설파이드로 순차적으로 환원된다. 최종적으로 불용해성 물질인 Li₂S를 생성한다. 충전 시에는 역순으로 산화 반응을 거쳐 S₈로 돌아오면서 '셔틀' 메커니즘이 발생한다. 각 리튬폴리설파이드로 환원되는 과정에 의해 리튬-황 배터리의 방전 거동은 리튬이온전지와 달리 단계적으로 |
방전 전압을 나타내는 것이 특징이다 | 방전 전압을 나타내는 것이 특징이다 | ||
| 36번째 줄: | 36번째 줄: | ||
'''충·방전 시 배터리 부피 팽창과 수축이 심하다.''' 황의 단계적 환원(방전)에 의해 생성되는 폴리설파이드는 부피 팽창률이 80%에 육박하며, 산화 반응(충전)에는 다시 수축이 일어난다. 이때 양극 전극은 스트레스를 받게 되고, 황과 전도성 물질의 접촉이 끊어져 배터리 열화를 가속화하는 원인이 된다. | '''충·방전 시 배터리 부피 팽창과 수축이 심하다.''' 황의 단계적 환원(방전)에 의해 생성되는 폴리설파이드는 부피 팽창률이 80%에 육박하며, 산화 반응(충전)에는 다시 수축이 일어난다. 이때 양극 전극은 스트레스를 받게 되고, 황과 전도성 물질의 접촉이 끊어져 배터리 열화를 가속화하는 원인이 된다. | ||
| − | '''폴리설파이드가 전해질에 용해돼 음극과 직접 반응해 새로운 표면층을 생성한다.''' 양극에서 환원돼야 할 폴리설파이드 | + | '''폴리설파이드가 전해질에 용해돼 음극과 직접 반응해 새로운 표면층을 생성한다.''' 양극에서 환원돼야 할 폴리설파이드 Li2₂S₈과 Li₂Sₙ 이 음극과 직접 반응하면 Li₂S₂ 와 Li₂S 를 생성하게 되고, 이 물질은 음극에 계속 남아 리튬이온의 이동을 가로막는다. 배터리 내부 저항을 증가시키고, 계속적으로 축적되면 분리막을 손상시켜 내부 쇼트를 초래할 수 있다. |
이 외에도 양극 집전체인 알루미늄이 고온에서 황과 급격한 반응을 야기할 수 있고, 액체 전해질 환경에서 는 폴리설파이드가 유기 용매나 리튬염과 화학적 반응을 일으켜 셀 열화, 가스 발생과 같은 문제를 낳기도 한다.<ref name="블로그"></ref> | 이 외에도 양극 집전체인 알루미늄이 고온에서 황과 급격한 반응을 야기할 수 있고, 액체 전해질 환경에서 는 폴리설파이드가 유기 용매나 리튬염과 화학적 반응을 일으켜 셀 열화, 가스 발생과 같은 문제를 낳기도 한다.<ref name="블로그"></ref> | ||
2021년 4월 29일 (목) 15:53 판
리튬-황 배터리(Lithium–sulfur battery)는 차세대 2차전지로 황 나노물질을 이용해 용량이 크고 안전성이 확보된 전지를 개발하는 기술이다. 2030년 이후 상용화 될 것으로 보고 있다. 리튬-황 배터리는 현재 전기차 배터리에 주력으로 사용되는 리튬이온 배터리를 대체할 차세대 배터리군 중 하나다. 양극재에 황탄소 복합체, 음극재에 리튬메탈 등 경량 재료를 사용했다. 특징은 무게당 에너지 밀도가 리튬이온 배터리 대비 1.5배 이상 높은 배터리다. 기존 리튬이온 배터리보다 가볍고 희귀 금속을 사용하지 않아 가격경쟁력도 높다는 평이다. 이론적인 최대 에너지밀도가 2500Wh/kg에 달해 에너지밀도가 최대 500Wh/kg인 리튬이온에 비해 최대 5배에 달한다.
국내에서 LG화학이 리튬-황 배터리 개발을 진행 중에 있으며 2025년 이후 양산할 계획이다. 지스트(광주과학기술원) 지구․환경공학부 이재영 교수 연구팀은 차세대 에너지 저장기술로 주목받고 있는 리튬황 배터리의 성능과 내구성을 개선했다. 연구팀은 리튬황 배터리 양극 계면에 코발트 옥살레이트를 처음으로 전기화학 촉매로 도입했고, 충방전 과정에서의 전기화학 촉매 반응 규명과 이를 바탕으로 지속적인 성능 내구성을 확보하는데 성공했다. 미국 스탠퍼드 선형 가속기 센터(SLAC) 연구진은 리튬 코발트 옥사이드를 대체할 수 있는 리튬-황 배터리를 만드는 데 성공했고, 미국 표준 기술 연구소도 값싸고 고성능의 리튬-황 배터리를 개발했다.[1][2]
구조와 원리
리튬황 배터리는 양(+)극에 아무것도 없는 리튬이온 배터리와 달리 황(S)을 양극 재료로 사용한다. 음(-)극에는 리튬이온 배터리처럼 리튬(Li) 금속이 들어간다.
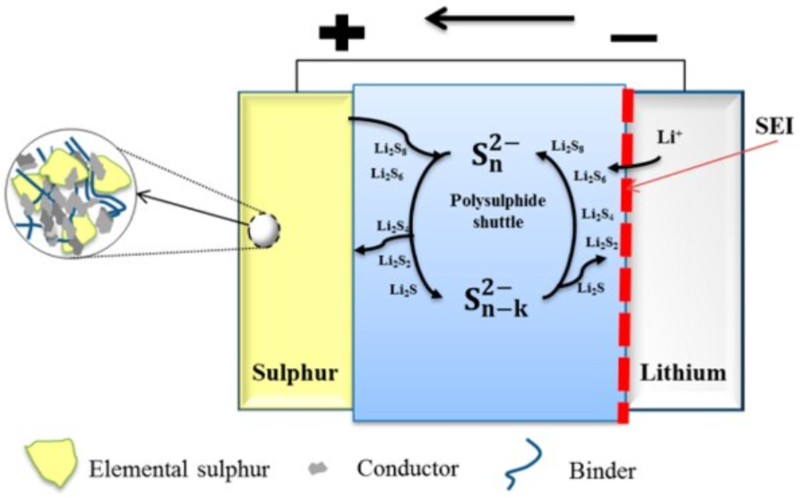
리튬-황 배터리의 원리를 이해하려면 '셔틀' 메커니즘을 알아야 한다.
방전 시 반응의 시작 물질은 고리 구조인 S₈이다. 방전을 진행하면서 연속적인 환원 반응의 선형 구조인 리튬폴리설파이드(Li₂S₈ → Li₂Sₙ → Li₂S₂)의 단계를 거치게 되고, 전해질에 용해된 상태로 양극에서 음극으로 이동하며 더 낮은 단량체의 폴리설파이드로 순차적으로 환원된다. 최종적으로 불용해성 물질인 Li₂S를 생성한다. 충전 시에는 역순으로 산화 반응을 거쳐 S₈로 돌아오면서 '셔틀' 메커니즘이 발생한다. 각 리튬폴리설파이드로 환원되는 과정에 의해 리튬-황 배터리의 방전 거동은 리튬이온전지와 달리 단계적으로 방전 전압을 나타내는 것이 특징이다
즉 리튬황 배터리는 리튬과 황이 만나 황화리튬(리튬폴리설파이드)이 되는 과정에서 발생하는 에너지를 저장하는 장치다. 구체적으로는 리튬이 전자를 빼앗겨 양이온이 되고 황은 그 전자를 가져오는 산화환원반응이 일어나면서 리튬 양이온과 황 음이온이 전기적으로 결합해 황화리튬이 된다. 그 과정에서 이동하는 전자로 인해 전기가 발생한다.[3][4]
상용화 및 연구
리튬황 배터리의 상용화는 느린 편이다. 리튬이온 배터리는 1970년대 학계에 작동원리가 제안돼 20여년만인 1991년 일본 소니가 상용화했다. 반면 리튬황 배터리는 1962년 미국 과학자 헐버트 대뉴타(Herbert Danuta)와 울람 줄리어스(Ulam Juliusz)가 관련 특허를 취득했지만 지금까지도 상용화되지 못했다.
리튬과 황 반응 생성물인 황화리튬이 리튬황 배터리의 상용화를 막는 주요 걸림돌이다. 황화리튬은 전해액에 잘 녹는 성질을 가졌다. 전기를 띠는 이온과 전자는 전해액에 녹아든 후 두 전극 사이를 원활하게 이동한다. 그래야 배터리에 전기가 흐른다. 전해액의 용해도는 한계가 있기 때문에 황화리튬이 녹아들수록 이온과 전자가 덜 녹아들게 된다. 이들이 두 전극을 오갈 다리가 막히는 셈이다.
또 황 자체가 비금속이기 때문에 전극 재료임에도 전기전도도가 낮다는 한계가 있다. 탄소 등의 물질을 첨가해 전기전도도를 보완할 수 있지만 전기 발생 반응에 직접 참여하지 않는 불순물이 섞이다보니 에너지밀도가 낮아진다. 이 때문에 실제 구현된 리튬황 배터리의 에너지밀도는 이론값보다 훨씬 낮은 1kg당 수백 와트시 수준에 불과하다.
그나마 리튬이온 배터리보다 좋은 성능을 내기 위해서는 불필요한 황화리튬 용해까지 감당할 정도로 많은 양의 전해액을 배터리에 주입해야 한다. 하지만 전해액 자체도 무게가 나간다는 점 때문에 이 방법도 한계가 있다. 현재 리튬황 배터리의 전해액은 배터리 전체 무게의 40%를 차지하고 있다.
국내외에서 이 한계를 극복하기 위한 연구가 한창 진행되고 있다. 이탈리아 로마 사피엔자대 연구진은 아예 전해액을 고체로 바꾼 '전고체 리튬황 배터리'의 가능성에 대해 연구한 결과를 2010년 3월 화학 분야 국제 학술지 '앙게반테 케미(Angewandte chemie·독일화학회지)'에 게재했다. 다만 이 배터리는 고온에서만 작동하기 때문에 실제 쓰임에는 한계가 있다.
2020년 2월에는 호주 모니쉬대 연구진이 리튬황 배터리의 구조 개선을 통해 성능을 높였다고 외신 클린테크니카를 통해 밝혔다. 연구진은 "전기차에 상용화되면 한번에 1000km를 달릴 수 있을 것"이라고 설명했다. 현재 리튬이온 배터리를 탑재하고 있는 테슬라 전기차의 주행거리가 600km 정도로 알려졌다.
국내에서도 최근 성과가 나왔다. 2020년 6월 25일 김희탁 한국과학기술원(KAIST) 생명화학공학과 교수 연구팀은 리튬황 배터리에 들어가는 전해액의 양을 4분의 1로 낮추는 데 성공했다고 밝혔다. 연구팀은 '리튬 나이레이트 염'이라는 물질을 전해액에 첨가하면 이 물질이 전해액의 용해도를 4배 이상 높인다는 것을 발견했다. 전해액의 양을 4분의 1로 줄여도 기존의 성능을 유지할 수 있게 됐다.[3]
리튬-황 배터리 기술적 과제
양극재인 황은 비전도성 물질이다. 이를 극복하기 위해 전도성 물질에 접촉돼야 한다. 전도성 물질은 탄소나 금속을 사용하는데, 전도성 물질을 늘리면 황의 양이 줄어들어 에너지 밀도가 축소된다. 결국 전도성 소재와 황의 혼합 비율이 관건이며, 리튬황전지의 장점을 살리려면 황의 비율이 70% 이상이 돼야 한다.
충·방전 시 배터리 부피 팽창과 수축이 심하다. 황의 단계적 환원(방전)에 의해 생성되는 폴리설파이드는 부피 팽창률이 80%에 육박하며, 산화 반응(충전)에는 다시 수축이 일어난다. 이때 양극 전극은 스트레스를 받게 되고, 황과 전도성 물질의 접촉이 끊어져 배터리 열화를 가속화하는 원인이 된다.
폴리설파이드가 전해질에 용해돼 음극과 직접 반응해 새로운 표면층을 생성한다. 양극에서 환원돼야 할 폴리설파이드 Li2₂S₈과 Li₂Sₙ 이 음극과 직접 반응하면 Li₂S₂ 와 Li₂S 를 생성하게 되고, 이 물질은 음극에 계속 남아 리튬이온의 이동을 가로막는다. 배터리 내부 저항을 증가시키고, 계속적으로 축적되면 분리막을 손상시켜 내부 쇼트를 초래할 수 있다.
이 외에도 양극 집전체인 알루미늄이 고온에서 황과 급격한 반응을 야기할 수 있고, 액체 전해질 환경에서 는 폴리설파이드가 유기 용매나 리튬염과 화학적 반응을 일으켜 셀 열화, 가스 발생과 같은 문제를 낳기도 한다.[4]
리튬-황 배터리 연구 동향
이러한 문제를 해결하고 리튬황전지의 상용화를 앞당기려는 연구들이 진행되고 있다.
- 양극재
양극재는 1) 최대한 많은 양의 황을 함유해야 하고, 2) 우수한 전도성 물질과 혼합을 통해 전기전도도를 높여야 하며, 3) 충·방전 시 부피 팽창에 내성을 가지는 구조여야 하고, 4) 황의 환원 반응으로 생성되는 폴리설파이드의 음극으로의 이동을 제한할 수 있어야 한다. 이를 위해 우수한 전기전도도, 넓은 비표면적, 기계적 강성 등을 가진 다공성 탄소 탄소나노튜브, 그래핀 등을 황과 합성해 복합소재를 제조하는 연구가 활발하게 진행되고 있다.
- 음극재
음극재는 높은 에너지 밀도와 셀 전압을 보유한 리튬메탈이 최적이다. 하지만 리튬메탈이 폴리설파이드와 반응하고, 리튬덴드라이트가 표면에 형성되기도 한다. 문제점을 해결하기 위해 리튬메탈 표면에 보호층을 입히는 방법, 실리콘 나노와이어를 이용한 음극 합성 방법 등이 연구되고 있다.
- 전해질
전해질은 결국 고체 전해질이 요구된다. 리튬=황 배터리에서 액체 전해질을 사용할 경우 폴리설파이드의 용해로 인한 셔틀 메커니즘을 피할 수 없다. 리튬-황 배터리의 고체 전해질은 높은 이온전도도, 리튬메탈과 반응에 있어 화학적 안정성, 전극과 전해질의 넓은 접촉 계면 등이 요구된다. 겔 전해질은 고체 전해질에 비해 상대적으로 높은 이온전도도, 화학적 전기적 안전성 등이 장점이지만, 폴리설파이드의 용해를 원천적으로 막을 수 없다. 고체 전해질이 구현되기 전까지는 분리막을 통해 폴리설파이드를 물리적으로 차단하는 기술이 병행될 것이다.[4]
각주
- ↑ 이재은 기자, 〈LG화학, 국내 최초 '리튬황 배터리'로 최고도 비행 성공〉, 《조선비즈》, 2020-09-10
- ↑ 방제일 기자, 〈지스트, 가볍고 오래가는 리튬황 배터리 개발〉, 《테크월드뉴스》, 2021-01-28
- ↑ 3.0 3.1 김윤수 기자, 〈과학TALK 정의선·구광모 주목한 포스트 전기차 배터리 '리튬황'〉, 《조선비즈》, 2020-06-27
- ↑ 4.0 4.1 4.2 spainorange, 〈키움증권 차세대 배터리 - (3) Post LiB (전고체전지, 리튬황전지, 리튬공기전지)〉, 《네이버 블로그》, 2019-08-06
참고자료
- 김윤수 기자, 〈과학TALK 정의선·구광모 주목한 포스트 전기차 배터리 '리튬황'〉, 《조선비즈》, 2020-06-27
- 이재은 기자, 〈LG화학, 국내 최초 '리튬황 배터리'로 최고도 비행 성공〉, 《조선비즈》, 2020-09-10
- 방제일 기자, 〈지스트, 가볍고 오래가는 리튬황 배터리 개발〉, 《테크월드뉴스》, 2021-01-28
같이 보기

 위키원
위키원