"전고체 배터리"의 두 판 사이의 차이
잔글 (→황화물계 고체 전해질) |
잔글 (→리튬이온 배터리와 전고체 배터리) |
||
| 39번째 줄: | 39번째 줄: | ||
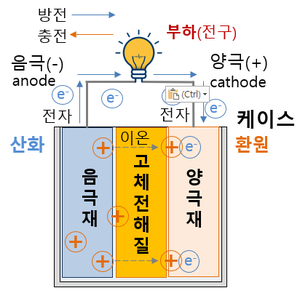
* 전고체 전지와 기존 리튬 2차전지의 작동원리는 동일하나, 전지의 구성요소 중 가연성 액체로 되어 있는 전해질을 고체 전해질로 바꾸어 온도 변화와 외부 충격에 따른 화재·폭발 위험이 현저히 감소된다. 리튬이온 배터리의 액체 또는 겔(Gel) 상태의 전해질은 온도에 따라 동파·기화·팽창하거나, 외부 충격으로 전해질이 누출될 시 화재·폭발이 발생한다. | * 전고체 전지와 기존 리튬 2차전지의 작동원리는 동일하나, 전지의 구성요소 중 가연성 액체로 되어 있는 전해질을 고체 전해질로 바꾸어 온도 변화와 외부 충격에 따른 화재·폭발 위험이 현저히 감소된다. 리튬이온 배터리의 액체 또는 겔(Gel) 상태의 전해질은 온도에 따라 동파·기화·팽창하거나, 외부 충격으로 전해질이 누출될 시 화재·폭발이 발생한다. | ||
* 온도 변화와 외부 충격 등에 대비한 안전장치 및 분리막이 필요 없으므로 동일한 크기로 원가절감과 고용량 구현이 가능하다. | * 온도 변화와 외부 충격 등에 대비한 안전장치 및 분리막이 필요 없으므로 동일한 크기로 원가절감과 고용량 구현이 가능하다. | ||
| − | - 화재위험이 없으므로 배터리팩 공간의 30% 이상을 차지하는 냉각장치가 제거된 공간에 추가적으로 배터리셀을 채워 넣어 에너지밀도를 증대시킬 수 있다. | + | :- 화재위험이 없으므로 배터리팩 공간의 30% 이상을 차지하는 냉각장치가 제거된 공간에 추가적으로 배터리셀을 채워 넣어 에너지밀도를 증대시킬 수 있다. |
| − | - 액체 전해질에서 양극과 음극을 물리적으로 차단해 전기적 단락을 방지하는 역할을 했던 분리막이 필요 없어 부피 감소 및 원가 절감이 가능하다. | + | :- 액체 전해질에서 양극과 음극을 물리적으로 차단해 전기적 단락을 방지하는 역할을 했던 분리막이 필요 없어 부피 감소 및 원가 절감이 가능하다. |
| − | - 기존 리튬이온 배터리는 모노폴라(Mono Polar) 구조로서 용량 확장을 위해 여러 개의 셀을 연결해야 되는 반면, 전고체 전지는 멀티폴라(MOl3R-Polar) 구조가 가능해 부피를 감소할 수 있다. | + | :- 기존 리튬이온 배터리는 모노폴라(Mono Polar) 구조로서 용량 확장을 위해 여러 개의 셀을 연결해야 되는 반면, 전고체 전지는 멀티폴라(MOl3R-Polar) 구조가 가능해 부피를 감소할 수 있다. |
* 용량이 흑연의 10배에 달하는 등 월등한 성능에도 불구하고 극간 화재·폭발 위험때문에 사용하지 못했던 리튬금속을 음극활물질로 사용할 수 있어 동일한 크기로 고용량을 구현할 수 있다. | * 용량이 흑연의 10배에 달하는 등 월등한 성능에도 불구하고 극간 화재·폭발 위험때문에 사용하지 못했던 리튬금속을 음극활물질로 사용할 수 있어 동일한 크기로 고용량을 구현할 수 있다. | ||
| − | [[파일:리튬이온 배터리와 전고체 배터리.png|썸네일|1000픽셀|가운데|리튬이온 배터리와 전고체 배터리]] | + | [[파일:리튬이온 배터리와 전고체 배터리.png|썸네일|1000픽셀|가운데|리튬이온 배터리와 전고체 배터리]] |
== 종류 == | == 종류 == | ||
2021년 5월 6일 (목) 11:31 판
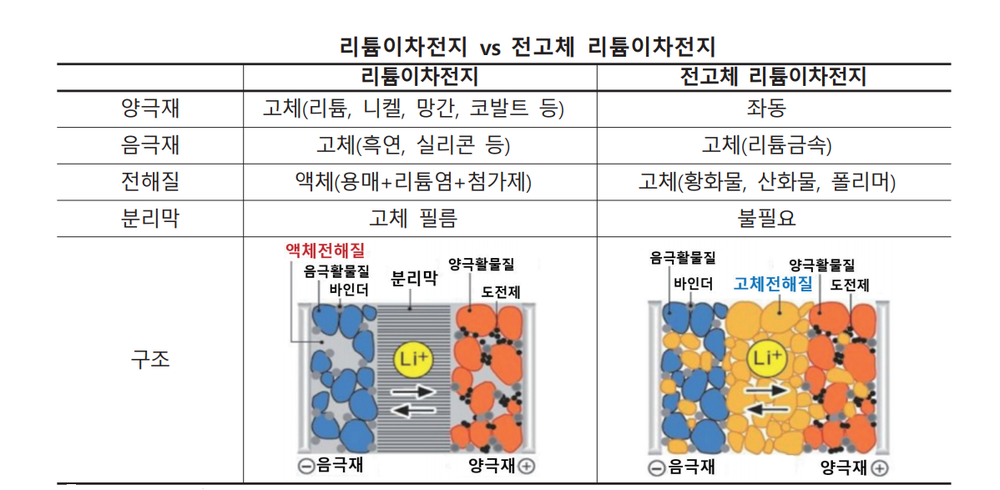
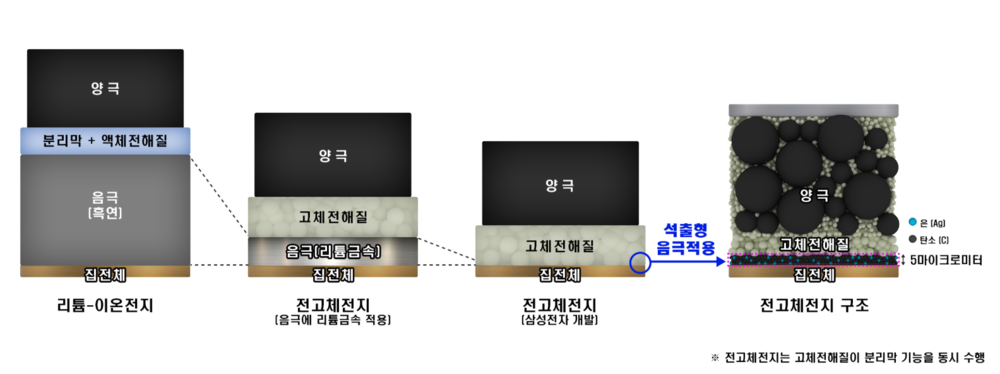
전고체 배터리(全固體, solid-state battery)는 액체 전해질 대신 고체를 사용한 배터리이다. 전고체 배터리는 에너지 밀도가 높고, 충전 시간이 빠르며, 안전성이 높고, 가격이 저렴하여 차세대 꿈의 배터리로 불린다. 즉 리튬이온 배터리에 필요한 전해액과 분리막을 없애고, 비는 공간에 에너지밀도가 더 높은 물질을 집어넣을 수 있다.
액체로 만들어진 기존 배터리는 양극과 음극이 만날 경우 화재가 발생할 위험이 있으나, 전고체 배터리는 리튬이온이 이동하는 전해질을 고체로 만들기에 항상 고정돼 있어 구멍이 뚫려도 폭발하지 않고 정상 작동한다. 액체 전해질보다 내열성과 내구성이 뛰어나기 때문에 폭발이나 화재 가능성이 낮고 크기도 줄일수 있다. 전고체 배터리는 안전성뿐만 아니라 용량과 두께 측면에서 "플렉서블(휘는·flexible) 배터리"를 구현하는 최적의 조건을 갖춘 것으로 평가 받는다. 전해질에 액체가 없어 초박막을 만들 수 있고, 양·음극을 여러 겹 쌓아 고전압·고밀도 배터리 구현이 가능하기 때문이다. 리튬이온 배터리보다 에너지 밀도가 높아 전기차의 주행 거리 향상과 충전 시간을 절약할 수 있다. 부품이 덜 들어가는 만큼 무게도 가벼워진다. 기존 리튬이온 전지의 에너지 밀도는 255Wh/㎏ 수준이다. 반면 전고체 전지는 이론적으로 495Wh/㎏까지 에너지 밀도가 올라간다.
그러나 전고체 전지는 고체 형태이다 보니 액체 전해질에 비해 이온 전도도가 낮아 출력이 낮고 수명이 짧다는 단점이 있다. 이에 따라 세계 산업계는 최대한 이온 전도도를 높일 수 있는 전고체 재료 찾기에 나섰다. 유력한 재료로 꼽히는 것이 폴리머, 옥사이드, 인산염, 황화물 등 네 가지다. 다만 각각 그 특성에 따른 장단점이 명확하다.
폴리머는 이온전도율이나 온도 변화에 대한 안정성이 떨어지지만 생산 용이성이 높다. 보쉬에서 선제적으로 폴리머 전고체 전지 개발에 나선 상태다. 한편 옥사이드와 인산염은 이온전도율이나 안정성은 괜찮은 편이나 생산 용이성이 낮다.
산업계의 주목을 받는 물질은 황화물이다. 이온전도율, 생산 용이성, 온도 변화에 대한 방어력 등이 두루 높다. 토요타, 삼성SDI 등 세계 제조기업에서 이를 기반으로 한 전고체 전지 개발에 열을 올리고 있는 것도 이 때문이다.
전고체 전지의 실용화 시점은 2025년 안팎으로 예상된다. BMW가 전고체 전지 양산 시점을 2026년이라고 못 박기도 했다.
LG에너지솔루션과 삼성SDI, 중국 CATL, 일본 파나소닉 등이 전고체 배터리를 개발 중이다.
주요 완성차 업체들도 전고체 배터리 개발에 뛰어들었다. 일본 토요타는 2008년 차세대 배터리 연구소를 세우면서 정부, 학계와 함께 전고체 배터리를 개발한다고 발표했다. 독일 BMW는 미국의 연료전지기업 솔리드파워와 손잡고 전고체 배터리를 장착한 전기차를 2025∼2026년께 출시할 계획이다.
역사
전고체 배터리 개념은 1980년대 처음 제시됐으나 한동안 빛을 보지 못했다. 그러다 일본 토요타가 2010년 황화물 전해질을 사용한 배터리 시제품을 공개한 뒤로 연구가 눈에 띄게 늘었다. 현재는 소재 후보군으로 황화물과 산화물, 고분자 3종이 발굴됐다. 이 가운데 황화물 소재는 가장 앞서 나간다. 일본은 전고체 배터리 연구에서 가장 앞서나가는 국가로 손꼽힌다. 일본에선 주로 황화물 연구가 주를 이룬다.
1991년 일본 소니가 첫 개발해 상용화한 리튬이온 배터리를 대체할 차세대 2차전지로는 리튬에어 전지, 리튬메탈 전지, 리튬황 전지, 전고체 전지가 있다. 그 중에서 전고체 전지를 탑재한 전기차를 2022년 도요타가 출시할 계획이다. 한국은 2025년 전고체 배터리를 상용화할 계획이다.
전세계 전기차용 전고체 배터리 시장이 2030년 최대 100조원 규모로 급성장할 것으로 관측되고 있다.
토요타는 전고체 배터리를 사용하면 출력과 전기저장량이 액체 전지보다 2배 이상 늘어날 것으로 보고 있다.
토요타, 다이슨, 포르셰 등 글로벌 2차전지 수요기업이 전고체 전지 사용화 계획을 연이어 발표하고 있다.
충전하는데 몇 시간씩 걸리는 리튬 이온 전지에 비해 전고체 전지는 불과 5분이면 80% 충전이 가능하다. 주행거리도 리튬이온전지의 2배 이상에 달한다. 기존의 가솔린, 경유 차량의 주유소 급유시간이 5분이다.
2012년~2014년 토요타가 출원한 차세대 전지 관련 특허의 68%는 전고체 전지 분야다. 200명의 개발인력을 전고체 전지 개발에 투입하고 있다.
리튬 이온 배터리에 비해 가격이 1/3이다.
SNE리서치에 따르면 전고체 배터리를 탑재한 전기차 비율은 2024년 2%에서 2030년 10%로 증가할 전망이다. 글로벌 조사 업체 Allied market research는 2017년 633억원이었던 글로벌 전고체 배터리 시장이 2025년 1조6820억원으로 확대한다고 예측했다. 일본 시장조사업체 후지경제는 2035년 전고체 배터리 시장규모가 32조6000억원에 이를 것으로 내다 봤다.
리튬이온 배터리와 전고체 배터리
- 전고체 전지와 기존 리튬 2차전지의 작동원리는 동일하나, 전지의 구성요소 중 가연성 액체로 되어 있는 전해질을 고체 전해질로 바꾸어 온도 변화와 외부 충격에 따른 화재·폭발 위험이 현저히 감소된다. 리튬이온 배터리의 액체 또는 겔(Gel) 상태의 전해질은 온도에 따라 동파·기화·팽창하거나, 외부 충격으로 전해질이 누출될 시 화재·폭발이 발생한다.
- 온도 변화와 외부 충격 등에 대비한 안전장치 및 분리막이 필요 없으므로 동일한 크기로 원가절감과 고용량 구현이 가능하다.
- - 화재위험이 없으므로 배터리팩 공간의 30% 이상을 차지하는 냉각장치가 제거된 공간에 추가적으로 배터리셀을 채워 넣어 에너지밀도를 증대시킬 수 있다.
- - 액체 전해질에서 양극과 음극을 물리적으로 차단해 전기적 단락을 방지하는 역할을 했던 분리막이 필요 없어 부피 감소 및 원가 절감이 가능하다.
- - 기존 리튬이온 배터리는 모노폴라(Mono Polar) 구조로서 용량 확장을 위해 여러 개의 셀을 연결해야 되는 반면, 전고체 전지는 멀티폴라(MOl3R-Polar) 구조가 가능해 부피를 감소할 수 있다.
- 용량이 흑연의 10배에 달하는 등 월등한 성능에도 불구하고 극간 화재·폭발 위험때문에 사용하지 못했던 리튬금속을 음극활물질로 사용할 수 있어 동일한 크기로 고용량을 구현할 수 있다.
종류
산화물계 고체 전해질
- 전고체 배터리의 고체 전해질은 액체 전해질과 동등한 이온 전도도를 가져야 한다. 현행의 리튬 이온전지에 사용되고 있는 용매 전해질의 전기 전도도는 10⁻²S㎝⁻¹ 대이다. 이 값의 대부분은 전지의 동작과 관계되지 않는 음이온이 하전담체로 작용한 것이어서, 리튬이온 전도의 기여는 반 이하에 머무른다. 따라서 리튬이온 배터리를 전고체화 할 수 있는 고체 전해질의 이온 전도도는 10⁻³S㎝⁻¹ 정도이다.
- 리튬이온을 전도 종으로 10⁻³S㎝⁻¹ 이상의 이온 전도도를 나타내는 고체 전해질은 질화리튬이다. 그러나 이 물질은 안정인 전위 범위가 0.45V에 지나지 않고, 고전압의 전지를 구성하는데 장해가 된다. 그 후, 산화물계 재료에서도 1990년대에 나시콘형 결정 구조를 가지는 LiTi₂(P0₄)₃나 페로브스카이트형 구조의 Li₃xLa⅔-xTi0₃로 10⁻³S㎝⁻¹의 이온 전도도가 달성되었다.
- 이러한 재료 중에서 티탄의 원자가수는 +4 상태이지만 천이금속은 원자가수가 변화하기 쉬운 원소이다. LiTi₂(P0₄)₃에는 리튬 전극 기준으로 2.5V, Li₃xLa⅔-xTi0₃에서도 1.5V로 전자가 주입되어 d¹상태로 된다. 전지를 고전압화 해, 에너지 밀도를 높이기 위해서는, 음극에 낮은 전위를 나타내는 재료를 사용해야 하지만, 이러한 고체 전해질이 그러한 음극과 접촉하면 음극으로부터 주입된 d전자가 전자 전도를 가져오게 되어 전해질로는 작용하지 않는다.
- – 상기 물질은 내환원성이 낮기 때문에, 가닛(garnet)형 산화물계 고체 전해질을 고려할 수 있다. 즉 Li₇ La₃Zr₂0₁₂계의 이온 전도도는 거의 10⁻³S㎝⁻¹에 달했다. 그러나 높은 이온 전도도와 내환원성을 겸비하는 가닛형의 고체 전해질에도, 산화물계 재료에 공통의 해결해야 할 과제가 남아 있다.
- – 산화물계 고체 전해질의 경우, 결정격자 중의 리튬 확산은 매우 빠르다. 그러나 다결정의 세라믹은 입자 끼리나 계면(입계) 저항이 매우 높아진다. 또 리튬이온 이외의 원소도 확산을 시작해 활물질과 고체 전해질 중의 원소가 서로 만나서 계면에 반응상이 형성된다.
- – 그러나 붕산리튬(Li₃B0₃)을 사용하면 반응상의 형성을 억제할 수 있다. 이 물질의 이온 전도도는 10⁻⁶S㎝⁻¹에 지나지 않지만, 융점은 700℃로 매우 낮고, 저온에서 활물질과 접합하는 것이 가능하다. 즉 분리층과 작용하는 부분의 고체 전해질에는 고온 소결한 가닛형 산화물을 사용해, 그 위에 활물질과 붕산리튬의 혼합물을 저온으로 소결한 전극층을 형성한 것이 보고되고 있다.
황화물계 고체 전해질
- 산화물 이온에 비해 큰 황화물 이온은 이온 전도 경로가 되는 음이온 간의 틈새가 넓다. 게다가 황화물 이온의 분극률이 높기 때문에 리튬이온에 대한 속박력이 약해져, 리튬이온은 움직이기 쉬운 상태가 된다. 때문에 황화물계 고체 전해질의 이온| 전도도는 1980년 초에 이미 10⁻³S㎝⁻¹이었다. 더욱이 황화물계 고체 전해질은 입계저항을 낮추기 위한 고온 소결 과정이 불필요한 점도, 산화물계와 크게 다른 이점이다.
- – 즉, 황화물계 고체 전해질은 실온에서 가압 성형하여 입계 저항이 매우 낮은 성형체를 얻을 수 있다. 또 수화물계 고체 전해질로 소결 시의 다른 결정구조 생성의 문제가 적고, 간단한 공정으로 전지를 제작할 수 있다. 그러나 황화물계 고체 전해질은 대기 중의 습기와 쉽게 반응해 버리는 취급하기 어려운 재료이다.
- 앞에서 기술한 바와 같이 리튬이온만을 전도 종으로 하는 고체 전해질에 요구되는 10⁻³S㎝⁻¹의 이온 전도도는, 유기용매 전해질의 10⁻²S㎝⁻¹에 상당한다. 황화물계 고체 전해질에 있어서의 이온수송 특성은 유기용매 전해질을 능가하고 있다. 그러나 황화물계 고체 전해질의 이같은 높은 이온 전도도를 전지의 출력 성능에 연결하기 위해서는 아직 해결해야 할 문제가 남아 있다.
- 이온 전도체의 표면이나 이온 전도체가 다른 물질에 접촉한 계면은 가동 이온 농도가 변화한 공간 전하층이 형성된다. 이때 고체 전해질 내부와는 다른 이온 수송거동을 나타낸다. 이와 같은 특이한 이온전제현상은 공간 전하층의 두께가 10㎚ 전후로 나노이오닉스(nano-ionics)라부른다. 황화물계 고체 전해질을 사용한 전고체 전지 문제가 되는 것은, 정극 활물질과의 계면에 있다.
- – 황화물 전해질은 음이온 격자와 리튬 이온에 대한 속박력이 약하기 때문에, 리튬 이온 농도가 크게 저하한다. 그 결과, 정극 활물질과의 계면에서 공간 전하층은 리튬이온이 부족하여, 황화물계 고체 전해질을 사용한 전고체 전지의 출력 성능을 저하시킨다. 즉 황화물 이온의 높은 분극률은, 고체 전해질 중의 이온 전도도는 우수하지만, 에너지 밀도를 높이기 위해서 정극과 조합했을 때에는 결점이 된다.
- – 이 문제를 해결하는 방법은 고체 전해질이 정극 활물질의 높은 전위에 노출되지 않게 하는 것이다. 이를 위해서 정극 활물질 표면에 전자 절연성의 박층을 피복하는 방법이 제안되고 있다. 이 박층은 리튬이온 결핍층의 형성에 대한 완충작용을 발휘한다. 그 결과 완충층이 형성되어 전고체 전지의 출력 성능이 높아져서, 유기용매 전해질을 사용한 현행의 리튬이온 배터리와 동등한 수준의 성능을 나타낸다.
개발 현황
참고자료
- 〈전고체 전지〉, 《한경 경제용어사전》
- 구본혁 기자, 〈폭발위험 없는 꿈의 배터리 ‘전고체전지’ 대량생산길 열렸다!〉, 《헤럴드경제》, 2021-02-22
같이 보기

 위키원
위키원