"고체전해질"의 두 판 사이의 차이
잔글 (→고체 전해질의 개발 역사) |
잔글 (→고체 전해질의 개발 역사) |
||
| 28번째 줄: | 28번째 줄: | ||
=== 유기 고체 전해질 (Organic solid-state electrolyte) === | === 유기 고체 전해질 (Organic solid-state electrolyte) === | ||
1973년 이온전도성이 있는 고분자인 PEO가 발견되면서 고체 전해질의 연구가 본격적으로 시작되었다. 그러나 PEO계 고분자 고체 전해질은 상온에서 이온전도도가 낮고 (10⁻⁶~10⁻⁸S/cm) 전기화학적 안정성이 열악하여 현재는 PCL, PEC, PPC, PEEC 등의 다른 고분자 재료들도 연구하고 있다. 그러나 고분자의 특성상 상온에서의 이온전도도 향상이 용이하지 못하여 전해질 구조 내 리튬염의 함량을 증가시키거나 고분자 매트릭스 내에 저분자량 액체 가소제를 투입하는 등의 여러 가지 방법으로 이온전도도 향상을 진행하고 있고 이로 인해 발생하는 낮은 기계적 강도와 안정성은 고분자 고체 전해질과 나노 크기 고전도성 무기 입자 충진재를 혼합한 Hybrid 고체 전해질 형태로 개선하려는 노력이 진행되고 있다.<ref name="티스토리"></ref> | 1973년 이온전도성이 있는 고분자인 PEO가 발견되면서 고체 전해질의 연구가 본격적으로 시작되었다. 그러나 PEO계 고분자 고체 전해질은 상온에서 이온전도도가 낮고 (10⁻⁶~10⁻⁸S/cm) 전기화학적 안정성이 열악하여 현재는 PCL, PEC, PPC, PEEC 등의 다른 고분자 재료들도 연구하고 있다. 그러나 고분자의 특성상 상온에서의 이온전도도 향상이 용이하지 못하여 전해질 구조 내 리튬염의 함량을 증가시키거나 고분자 매트릭스 내에 저분자량 액체 가소제를 투입하는 등의 여러 가지 방법으로 이온전도도 향상을 진행하고 있고 이로 인해 발생하는 낮은 기계적 강도와 안정성은 고분자 고체 전해질과 나노 크기 고전도성 무기 입자 충진재를 혼합한 Hybrid 고체 전해질 형태로 개선하려는 노력이 진행되고 있다.<ref name="티스토리"></ref> | ||
| − | === 무기 고체 전해질 (Inorganice solid-state electrolyte) | + | === 무기 고체 전해질 (Inorganice solid-state electrolyte) === |
==== 산화물계 고체전해질 (Oxide) ==== | ==== 산화물계 고체전해질 (Oxide) ==== | ||
무기 고체 전해질의 본격적인 전개는 1992년 LixPOyNz (lithium phosphorus oxynitride; LiPON)의 개발에서 비롯되었는데, LiPON은 리튬금속과의 안정적 접촉이 가능하고 넓은 전기화학적 창 (0-5.5V vs. Li/Li+)을 가질뿐만 아니라 무시할 정도로 낮은 전기전도도를 보인다는 장점이 있다. 그래서 LiPON은 박막형 전고체 리튬전지의 연구개발 시 기준 전해질로 널리 사용되었다. 그러나 낮은 이온전도도 (25℃에서 ~10⁻⁶S/cm)로인해 박막 전해질의 형태로만 사용할 수 있었고 깨지기 쉬워서 실제 전지로의 응용이 제한되었다. | 무기 고체 전해질의 본격적인 전개는 1992년 LixPOyNz (lithium phosphorus oxynitride; LiPON)의 개발에서 비롯되었는데, LiPON은 리튬금속과의 안정적 접촉이 가능하고 넓은 전기화학적 창 (0-5.5V vs. Li/Li+)을 가질뿐만 아니라 무시할 정도로 낮은 전기전도도를 보인다는 장점이 있다. 그래서 LiPON은 박막형 전고체 리튬전지의 연구개발 시 기준 전해질로 널리 사용되었다. 그러나 낮은 이온전도도 (25℃에서 ~10⁻⁶S/cm)로인해 박막 전해질의 형태로만 사용할 수 있었고 깨지기 쉬워서 실제 전지로의 응용이 제한되었다. | ||
2023년 5월 30일 (화) 18:39 기준 최신판
고체전해질은 전고체 배터리의 양극과 음극 사이에서 이온을 전달하는 고체 상태의 전해질을 말한다. 고체전해질은 폭발의 위험에서도 자유롭고, 또 0℃ 이하의 저온이나 60~100℃ 고온에서 액체전해질보다 전도 성능이 향상된다는 장점이 있다.
고체 전해질은 분리막이 없는 배터리를 만들 수 있게 해준다. 유기물 형태로 구성된 액체 전해질과 달리, 고체전해질은 그 자체로 분리막 역할을 하며 온도 변화로 인한 부반응이나 외부 충격에 따른 누액 위험이 없다. 또한 전해액과 분리막이 없어서, 에너지 밀도를 높이는 물질도 첨가할 수 있어 고밀도 배터리 구현도 가능하다.[1]
목차
기능[편집]
고체 전해질의 본질적인 기능은 '리튬 이온의 통로'이다. 안정성도 중요하지만, 무엇보다 리튬 이온 전도도가 높아야 하는데 고체 전해질은 이온이 흐르는 것이 아닌, 고체 격자 사이에서 이동하기 때문에 전해질과 양 극판의 접촉을 최대화 하고, 접촉면에서의 저항을 최소화해야 높은 이온 전도도를 갖출 수 있다.[1]
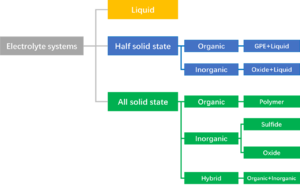
전해질의 종류 및 분류[편집]
1991년 SONY가 리튬이온 전지를 상용화한 이래 Carbonate계열의 유기용매(EC, PC, EMC, DEC, DMC...)와 리튬염을 사용하는 액체 전해액 시스템은 30년이 지난 현재까지 리튬이온 전지의 전해액으로 사용되고 있다.
그러나 액체 전해액은 가연성, 부식성, 열적 불안정성, 고전압에 취약한 문제를 가지고 있기 때문에 이것의 해결책으로 전고체 전해질의 연구와 상용화가 활발하게 진행되고 있다.
전해액 시스템을 분류하면 아래와 같이 크게 액체 (Liquid), 반고체(Half solid state), 전고체(All solid state)로 나눌 수 있다.
반고체 시스템은 전고체 기술의 실현이 쉽지 않아 액체 전해질과 전고체 전해질의 절충안으로 오랫동안 연구되어 왔다. 최근 중국에서는 전고체 전지를 개발하는 회사들과 기존 배터리 회사들이 전고체 전지의 상용화전 기술로 반고체 타입의 전지를 양산하는 것을 고려하고 있다.
고체 전해질을 사용하는 전고체 리튬이차전지는 유기 용매를 사용하는 액체 전해액이 가진 안전성에 대한 우려를 해소할 수 있으며, 전기화학적 안정성도 5V(리튬 전극 대비)까지 확장할 수 있어서 고전압용 양전극 소재의 활용이 가능해 에너지 밀도 향상이 가능하다. 또한 이 기술은 차세대 전지로 연구가 되고 있는 리튬-유황(Li-S) 전지, 리튬-공기(Li-O2) 전지 등의 차세대 리튬 이차전지 시스템으로도 확장이 가능하다.[2]
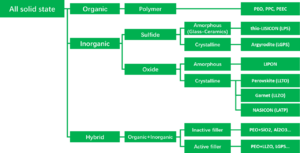
고체 전해질 분류[편집]
고체전해질은 사용되는 소재에 따라 아래와 같이 유기, 무기, 유기와 무기를 혼합한 하이브리드의 세 가지로 크게 분류할 수 있다.
무기 고체 전해질의 경우 일반적으로 산화물계와 황화물계로 분류하였는데 산화물계를 좀 더 정확하게 분류하면 Perovskite와 Garnet은 산화물(Oxide)계, Nasicon은 인산염 (Phospate)계, LIPON은 산화질화물 (Oxinitride)계의 4가지로 구분할 수 있다.[2]
고체 전해질의 개발 역사[편집]
유기 고체 전해질 (Organic solid-state electrolyte)[편집]
1973년 이온전도성이 있는 고분자인 PEO가 발견되면서 고체 전해질의 연구가 본격적으로 시작되었다. 그러나 PEO계 고분자 고체 전해질은 상온에서 이온전도도가 낮고 (10⁻⁶~10⁻⁸S/cm) 전기화학적 안정성이 열악하여 현재는 PCL, PEC, PPC, PEEC 등의 다른 고분자 재료들도 연구하고 있다. 그러나 고분자의 특성상 상온에서의 이온전도도 향상이 용이하지 못하여 전해질 구조 내 리튬염의 함량을 증가시키거나 고분자 매트릭스 내에 저분자량 액체 가소제를 투입하는 등의 여러 가지 방법으로 이온전도도 향상을 진행하고 있고 이로 인해 발생하는 낮은 기계적 강도와 안정성은 고분자 고체 전해질과 나노 크기 고전도성 무기 입자 충진재를 혼합한 Hybrid 고체 전해질 형태로 개선하려는 노력이 진행되고 있다.[2]
무기 고체 전해질 (Inorganice solid-state electrolyte)[편집]
산화물계 고체전해질 (Oxide)[편집]
무기 고체 전해질의 본격적인 전개는 1992년 LixPOyNz (lithium phosphorus oxynitride; LiPON)의 개발에서 비롯되었는데, LiPON은 리튬금속과의 안정적 접촉이 가능하고 넓은 전기화학적 창 (0-5.5V vs. Li/Li+)을 가질뿐만 아니라 무시할 정도로 낮은 전기전도도를 보인다는 장점이 있다. 그래서 LiPON은 박막형 전고체 리튬전지의 연구개발 시 기준 전해질로 널리 사용되었다. 그러나 낮은 이온전도도 (25℃에서 ~10⁻⁶S/cm)로인해 박막 전해질의 형태로만 사용할 수 있었고 깨지기 쉬워서 실제 전지로의 응용이 제한되었다.
1993년에는 Perovskite형 LLTO (Li₀.₅La₀.₅TiO₃)가 개발되어 2×10⁻⁵S/cm 이상의 이온전도도를 보였으며, 1997년에는 LAGP (Li₁+xAlxGe₂-x(PO₄)₃)와 LATP (Li1+xAlxTi₂-x(PO₄)₃)를 포함한 NASICON형 무기 고체 전해질이 처음 개발되어 각각 10⁻⁴S/cm와 1.3×10⁻³S/cm의 높은 이온전도도를 보였다. 2007년에는 garnet형 이온 전도체 LLZO (Li₇La₃Zr₂O1₂)가 처음 보고되었는데, 상온에서 3×10⁻⁴S/cm의 탁월한 이온전도도와 우수한 열적 및 화학적 안정성을 보여 전고체 리튬전지에 적용 가능성을 보였다.[2]
황화물계 고체 전해질 (Sulfide)[편집]
2011년에는 도쿄 공업대학의 Kanno 교수에 의해 "리튬 초이온전도체" (LISICON: Lithium Super Ion CONductor) LGPS (Li₁₀GeP₂S₁₂)가 상온에서 전해액 수준의 높은 이온전도도 1.2×10⁻²S/cm를 보이는 것이 보고되었다. 이 연구는 무기 고체 전해질 개발 역사상 획기적인 일로서, 전기자동차에 실제 적용을 위한 고출력, 고에너지밀도 에너지 저장 시스템의 가능성을 열었다.
그 이후 2014년에 다른 황화물 고체 전해질인 LPS (Li₇P₃S₁₁)가 1.7×10⁻²S/cm의 높은 이온전도도를 나타내는 것으로 보고되었다.
2016년에는 다시 Kanno 그룹에서 초이온전도체 Li₉.₅₄Si₁.₇₄P₁.₄₄ S₁₁.₇Cl₀.₃을 보고하였는데 이는 현재까지 최고의 상온 이온전도도인 2.5×10⁻²S/cm를 기록하였다.[2]
복합 고체 전해질 (Hybrid)[편집]
2000년대에 들어 무기와 유기 고체 전해질의 장점을 조합하고 단점은 제거하는 형태의 Hybrid 고체 전해질 연구들이 진행되고 있다. Hybrid 즉 복합 고체 전해질은 이온전도도를 비롯한 전기화학적 특성을 향상하기 위해 고분자 매트릭스에 무기 세라믹 고체 전해질을 충진재로 첨가하는데 이로부터 고분자 결정화도 (polymer crystallinity)가 감소되고, 전극-전해질 계면 친화성이 향상되며 양이온 수송수가 증가하는 효과를 얻을 수 있다.
일반적으로 무기 충진재는 리튬이온 전도성 유무에 따라 비활성(Inactive filler)과 활성(Active filler)으로 나누어지는데, 불활성 충진재는 주로 silica (SiO₂), alumina (Al₂O₃), titania (TiO₂) 등의 산화물 세라믹 입자 분말로서 리튬이온의 수송에는 관여하지 않는다. 반면에 활성 충진재로 산화물 (LLZO, LLTO 등), 인화물 (LAGP, LATP 등), 황화물 (LGPS, LSPS 등)을 사용하는 무기 고체 전해질 충진재는 리튬이온 수송에 관여하여 비교적 높은 이온전도도를 나타낸다.[2]
각 고체 전해질의 특성과 장단점 비교 종류 이온전도도 (S/cm)
전위창 (V vs Li/Li+)
장점 단점 고분자 10⁻⁸~10⁻⁴ 0~5 •얇은 필름으로 성형 가능 •유연성이 있어 셀 제조 용이
•전극과의 점착성 우수
•가격이 저렴
•상온에서 이온 전도도 낮음 •고온에서 기계적 물성 떨어짐
•이온 전도도의 온도 의존성 큼
산화물 페롭스카이트 (Peroskite)
10⁻⁶~10⁻³ 1.5~5.5 •단결정 상태에서 이온전도성 우수 •다결정 상태에서 입계저항 증가 •음의 전위창이 나쁨
가넷 (Garnet)
10⁻⁶~10⁻³ 0~5.5 •전위창, 이온전도도 우수 •대기중 취급용의, 기계적, 화학적 안정성 우수
•대기 및 수분 중 장기 방치시 표면 반응 및 셀 열화 영향 나시콘 (NASICON)
10⁻⁶~10⁻³ 2.5~5.5 •단결정 상태에서 이온전도성 우수 •다결정 상태에서 입계저항 증가 •음의 전위창이 나쁨
황화물 10⁻⁴~10⁻² 0~5.5 •이온전도도, 전위창 매우 우수 •양극/음극 소재와 반응성 •고분자와 반응성
•흡습성 (H₂S 생성)
•대기중 반응성, 고순도 황화물 요구
전고체 배터리 기술적 걸림돌[편집]
전고체 배터리가 리튬이온배터리의 최대 약점인 안전성을 개선할 유망 기술임은 확실하지만, 상용화하는 데 있어 아직 해결해야 할 숙제가 많다.
전해질의 본질적인 기능은 '리튬 이온의 이동수단'이다. 안정성도 중요하지만, 무엇보다 리튬이온이 원활하게 이동하도록 '이온전도도'가 높아야 한다. 하지만 전해질이 고체인 관계로 전극과 전해질의 밀착성이 떨어져 불연속 계면을 형성한다. 이렇게 되면 배터리 성능을 저하시키는 내부의 저항이 증가하게 한다. 따라서, 전해질과 양 극판의 접촉을 최대화하고 접촉면에서의 저항을 최소화해야 하는 기술적 과제를 해결해야 하는 상황이다.
또 고체전해질은 액체 전해질보다 상온(15~25℃)에서는 이온전도도가 낮은 특성이 있다. 그 때문에 상온에서 작동이 필요한 스마트폰과 같은 IT기기에 적용하기 쉽지 않다. 따라서 상용화가 되면 주변 온도 제어가 가능한 전기자동차와 에너지저장장치(ESS) 분야에 우선 적용될 것으로 바라보고 있다.[1]
현황[편집]
- 업계에서 유일하게 고분자계와 황화물계 전고체 배터리를 모두 개발 중인 LG에너지솔루션은 2026년 고분자계, 2030년 황화물계 배터리를 각각 상용화한다는 목표다. 삼성SDI와 SK온은 2027년과 2030년 각각 황화물계 배터리 상용화를 계획하고 있다.[1]
- 포스코는 산화물계 전고체 배터리 업체 프롤로지움(Prologium) 지분 투자, 황화물계 고체전해질 생산 본격화 등 차세대 이차전지소재 분야 사업 포트폴리오 강화에 나서고 있다. 프롤로지움은 2006년 대만에서 설립된 세계 최초의 전고체 배터리 제조기업으로, 현재 독일의 다임러그룹 등 주요 완성차업체와 함께 전기차용 전고체 배터리를 공동 개발하고 있다. 포스코홀딩스는 프롤로지움과 협력해 및 핵심소재인 전고체 배터리 전용 양극재와 실리콘 음극재, 고체전해질 공동개발 및 글로벌 공급 체계를 구축할 방침이다. 포스코그룹은 포스코JK솔리드솔루션( 2022년 2월 포스코홀딩스가 국내 최고 수준의 고체전해질 기술을 보유한 정관(JK)과 함께 설립한 합작법인)의 고체전해질 생산공장을 준공했다. 이번 준공을 통해 연산 24톤 규모의 고체전해질 생산라인을 갖추게 됐다. 이는 전기차 약 1,000대 분량으로, 아직 극초기 단계인 고체전해질 시장에선 국내 최대 규모다.[1]
- 한국과학기술연구원(KIST, 원장 윤석진)은 높은 이온전도성과 탄성변형성을 가진 고체전해질과 이 소재를 적은 비용으로 생산하는 공정을 개발했다. 상온·상압 환경에서 여러 공정을 하나로 단순하게 통합한 원팟(one-pot) 공정으로 합성할 수 있어 전고체 소재 생산성을 극대화하는 한편, 탄성변형력을 제고해 고질적 계면 문제를 해결할 수 있으리란 기대다. 에너지소재연구센터 김형철 박사 연구팀은 상온·상압 조건에서 고탄성·고이온 전도성 고체전해질 소재를 합성하기 위해 황화물 아지로다이트(argyrodite) 소재에 주목했다. 이론적으로는 아지로다이트 결정 내 4a 및 4c 자리의 할로겐 치환율을 최대로 높인 상태에서 이온전도성을 극대화할 수 있지만, 열역학적 불안정성으로 소재가 실용적으로 합성된 사례가 없었다. 또 일반적인 슈퍼 이온전도성 아지로다이트 결정질 소재는 500℃ 이상의 고온 열처리를 거쳐야하므로 할로겐 치환율을 극대화할 수 없었으며, 높아진 결정성만큼 탄성변형성은 낮아져 전지 성능이 빠르게 열화됐다. 고온 열처리를 하지 않으면 유리질처럼 낮은 탄성계수를 얻을 수 있지만, 이온전도도는 3mS/㎝ 내외에 머물러 고체전해질의 가치가 낮아진다. 연구팀은 결정질과 유리질 각각의 장점을 취하고, 열역학적으로 불안정한 할로겐 완전 치환형 구조를 확보하기 위해 새로운 전략을 택했다. 아지로다이트의 결정화 온도를 낮추는 조성 제어법과 낮아진 결정화 온도에 적합한 2단 기계화학적 밀링 신공정을 개발했다. 이를 통해 고온 열처리 공정 없이 약 13.23mS/㎝의 슈퍼 이온전도도를 가지는 할로겐 완전 치환형 아지로다이트 합성에 성공했다. 이 소재는 지금까지 보고된 슈퍼 이온전도성 고체전해질 가운데 가장 낮은 약 12.51GPa의 탄성계수를 가져 전고체 전지 계면성능 향상에도 유리하다. 또 상온·상압 원팟 신공정은 15시간 안에 공정이 끝난다. 이는 기존 슈퍼 이온전도성 고체전해질 합성 공정보다 2~6배 높은 생산성이다.[3]
- 고무형태의 전해질을 통해 세계 최고성능의 전고체전지를 구현할 수 있는 기술이 국내에서 개발돼 눈길을 끌고 있다. 이 기술을 통해 전기자동차 배터리 기술에 혁신적인 변화가 있을 것으로 기대된다. KAIST는 김범준 생명화학공학과 교수 연구팀이 이승우 미국 조지아공대(Georgia Tech) 교수팀과 공동연구를 통해 새로운 개념의 엘라스토머 고분자 전해질을 개발하고 이를 통해 세계 최고성능의 전고체전지를 구현했다. 공동 연구팀은 상온에서 리튬(Li) 이온의 전도도가 탁월하며, 기계적 신축성이 모두 확보된 엘라스토머(고무) 형태의 고분자 전해질을 개발했으며, 이를 전고체전지에 적용해 410Wh/kg의 세계 최고성능을 보이는 전고체 리튬 메탈전지를 구현했다. 이러한 기술을 도입하면 현재 한번 충전으로 800㎞까지 주행 가능한 전기자동차의 구현(현재 500㎞ 수준)이 가능할 것으로 보이며, 기존의 액체 전해질을 적용한 리튬이온전지의 안정성을 획기적으로 향상할 것으로 기대된다.연구팀은 고무처럼 신축성이 탁월한 엘라스토머 내부에 리튬 이온전도도가 매우 높은 플라스틱 결정 물질을 3차원적으로 연결한 엘라스토머 고분자 고체전해질을 개발했다. 연구팀이 개발한 전해질은 기존에 대표적인 폴리에틸렌옥사이드(PEO) 기반의 고분자 전해질에 비해 100배 정도 향상된 10-3 S/㎝의 이온전도도를 가진다. 또한, 고무처럼 신축성이 우수한 전해질은 전지 충‧방전 시 안정성에 가장 큰 문제가 되는 리튬 덴드라이트(dendrite)의 성장을 억제해, 탁월한 전지 성능 및 안정성을 확보했다. 개발된 고분자 전해질은 얇은 리튬금속 음극과 니켈 리치 양극(NCM-Ni83)으로 구성된 전고체전지에서 4.5V 이상의 고전압에서도 안정적인 구동을 보였으며, 410Wh/kg 이상의 세계 최고의 에너지밀도를 보였다.[4]
동영상[편집]
각주[편집]
- ↑ 1.0 1.1 1.2 1.3 1.4 〈궁금한 THE 이야기 ⑤ 한계를 뛰어넘는 차세대 혁신! ‘전고체 배터리’〉, 《포스코뉴스룸》, 2023-01-04
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 〈전고체 전해질의 종류 및 분류〉, 《티스토리》, 2022-11-18
- ↑ 한세희 과학전문기자, 〈전고체 전지 고체 전해질 성능-생산효율 높였다〉, 《지디넷코리아》, 2023-03-15
- ↑ 최아름 기자, 〈고무형태 전해질로 최고성능 고체전지 구현〉, 《정보통신신문》, 2022-01-14
참고자료[편집]
- 〈궁금한 THE 이야기 ⑤ 한계를 뛰어넘는 차세대 혁신! ‘전고체 배터리’〉, 《포스코뉴스룸》, 2023-01-04
- 최아름 기자, 〈고무형태 전해질로 최고성능 고체전지 구현〉, 《정보통신신문》, 2022-01-14
- 한세희 과학전문기자, 〈전고체 전지 고체 전해질 성능-생산효율 높였다〉, 《지디넷코리아》, 2023-03-15
- 〈전고체 전해질의 종류 및 분류〉, 《티스토리》, 2022-11-18
같이 보기[편집]

 위키원
위키원