"유기 고체 전해질"의 두 판 사이의 차이
잔글 |
|||
| 1번째 줄: | 1번째 줄: | ||
[[파일:유기 고체 전해질.png|썸네일|300픽셀|유기 고체 전해질]] | [[파일:유기 고체 전해질.png|썸네일|300픽셀|유기 고체 전해질]] | ||
| − | '''유기 고체 전해질'''(Organic solid-state electrolyte)<!--고분자 고체 전해질-->은 사용되는 소재에 따라 분류되는 [[고체전해질]]의 일종이다. 유기 고체 전해질의 소재로는 [[고분자]]가 사용된다. 고분자 고체 전해질은 오른쪽 그림과 같이 리튬염(LiClO₄, LiBrF₄, LiPF₆, LiNSO₃CF₃, LiN(SO₂CF₃)₂이 PEO, PCL, PEC, PPC, PEEC 등과 같은 고분자 매트릭스 내에서 해리되어 리튬이온 전도가 이루어진다.<ref name="티"> 〈[https://battkcs.tistory.com/entry/%EC%9C%A0%EA%B8%B0-%EA%B3%A0%EC%B2%B4-%EC%A0%84%ED%95%B4%EC%A7%88-Organic-solid-state-electrolyte 유기 고체 전해질 (Organic solid-state electrolyte)]〉, 《티스토리》, 2022-11-25</ref> | + | '''유기 고체 전해질'''(Organic solid-state electrolyte)<!--고분자 고체 전해질, 고분자고체전해질, 고분자고체 전해질, 고분자 고체전해질-->은 사용되는 소재에 따라 분류되는 [[고체전해질]]의 일종이다. 유기 고체 전해질의 소재로는 [[고분자]]가 사용된다. 고분자 고체 전해질은 오른쪽 그림과 같이 리튬염(LiClO₄, LiBrF₄, LiPF₆, LiNSO₃CF₃, LiN(SO₂CF₃)₂이 PEO, PCL, PEC, PPC, PEEC 등과 같은 고분자 매트릭스 내에서 해리되어 리튬이온 전도가 이루어진다.<ref name="티"> 〈[https://battkcs.tistory.com/entry/%EC%9C%A0%EA%B8%B0-%EA%B3%A0%EC%B2%B4-%EC%A0%84%ED%95%B4%EC%A7%88-Organic-solid-state-electrolyte 유기 고체 전해질 (Organic solid-state electrolyte)]〉, 《티스토리》, 2022-11-25</ref> |
== 개요 == | == 개요 == | ||
2023년 5월 31일 (수) 18:37 기준 최신판
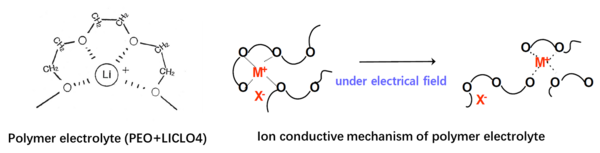
유기 고체 전해질(Organic solid-state electrolyte)은 사용되는 소재에 따라 분류되는 고체전해질의 일종이다. 유기 고체 전해질의 소재로는 고분자가 사용된다. 고분자 고체 전해질은 오른쪽 그림과 같이 리튬염(LiClO₄, LiBrF₄, LiPF₆, LiNSO₃CF₃, LiN(SO₂CF₃)₂이 PEO, PCL, PEC, PPC, PEEC 등과 같은 고분자 매트릭스 내에서 해리되어 리튬이온 전도가 이루어진다.[1]
개요[편집]
1973년 이온전도성이 있는 고분자인 PEO가 발견되면서 고체 전해질의 연구가 본격적으로 시작되었다.
PEO 고체 전해질의 경우 아래 그림 왼쪽과 같이 Li이온과 PEO의 배위 결합 (coordination)에 의해 고분자 전해질이 형성되고 이렇게 형성된 고분자 전해질내에서 분절 (segement) 운동에 의해 Li+이 이동하는 것으로 밝혀졌다. 상온에서의 이온전도도는 10-7~10-5S/cm 수준으로 낮은 편인데 이는 60℃ 이하에서 PEO가 부분적으로 결정화되어 Li+을 이동시키는 분절 운동이 감소하기 때문이다.
이를 해결하기 위해 고분자의 결정화도를 감소시키거나 계면 전도를 신속하게 진행시켜 이온전도도를 향상하는 방법이 연구되고 있다. 이를 위해 세라믹 충진재, 가소제, 고분자 혼합체, 공중합체 등을 혼합하거나 금속-유기 구조체 나노입자의 첨가, 유기 강직성 울타리를 도입하는 방안 등이 연구되고 있다. 또한 고분자 고체 전해질은 리튬 덴드라이트 성장을 억제하기 위해 기계적 강도의 강화가 필요하며, 고전압 시 고체 전해질의 산화분해에 견디도록 전기화학적 안정성 창의 확장도 필요하며, 이에 대해 앞의 방법과 같이 다양한 강화 연구가 진행되고 있다.[1]
구성 요소[편집]
고분자계 고체 전해질은 크게 고분자 물질 + 단량체 + 리튬염 + 용매 + 첨가제 + 가소제 + 개시제 및 가교제로 이루어져있다.
- 고분자 물질(고분자 고체 전해질 전구체) : 우선 기존의 폴리에틸렌옥사이드(PEO)는 단점이 많기 때문에 새로운 고분자 물질이 필요gk다. 그래서 코오롱인더스트리는 폴리티오에테르 고분자를 사용했다. 폴리티오에테르를 사용함으로써 결정화를 억제하여 저온에서도 전해질 이온전도성을 향상시킬 수 있다.
- 다관능 단량체 : 코오롱인더스트리는 아크릴로일기 2개 이상을 포함하는 다관능 단량체를 넣는다. 다관능 단량체는 중합 및 가교 반응을 거쳐 3차원구조로 형성된다. 그러면서 고분자 고체 전해질이 기계적 물성을 가지게 한다.
- 가소제 : 가소제는 고체 고분자 전해질을 형성하는 고분자 사슬 간의 결정성을 낮추어서 저온에서의 이온전도성을 높이고 고체 전해질의 가공성을 개선하는 첨가제 역할을 한다.
- 개시제 및 가교제 : 개시제는 열 또는 빛에 분해되어 라디칼을 생성한다. 생성된 라디칼은 다관능 단량체와 중합반응하여 고분자 물질을 생성한다. 가교제는 고체 고분자 조성물의 가교 반응을 촉발하여 고체상의 고분자 전해질을 형성을 도와주는 역할을 한다.[2]
고분자 고체 전해질의 구조[편집]
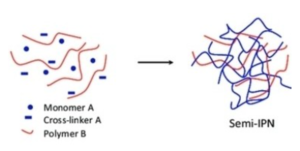
- monomer를 다관능 단량체
- Cross linker를 가교제
- Polymer를 고분자물질인 폴리티오 에테르
다관능 단량체가 가교제 및 개시제에 의해서 중합 및 가교되어 중합체가 되고 그림상의 파란색 선이 된다. 그리고 빨간색 선인 고분자물질인 폴리티오 에테르와 함께 위의 그림인 Semi-IPN 구조가 되면서 고체 고분자 전해질이 된다. 그리고 이 안에 리튬염과 가소제 첨가제가 고르게 분포되어 있다.[2]
고분자 고체 전해질의 제조방법[편집]
우선 폴리티오에테르를 제조한다. 그리고 제조된 폴리티오 에테르와 다관능단량체, 리튬염, 유기용매, 가소제, 첨가제, 개시재 및 가교제를 넣고 고체 고분자 전해질 조성물을 제조한다. 그리고 고체 고분자 전해질 조성물을 유리판 및 필름에 도포하고 UV를 조사한 후 고체 전해질을 유리판 및 필름에서 박리해 고분자계 고체 전해질막을 제조할 수 있다.
고분자 고체 전해질의 재료의 중량비는 폴리티오에테르 5~10% 리튬염 30% 가소제 50~60% 단량체 5~10%정도 이다.[2]
상용화 현황[편집]
대부분의 전고체전지들이 아직 상용화하기 멀었다고 생각하지만 프랑스 기업인 볼로레는 자회사인 블루솔루션(Blue solution)이 개발한 LMP (Lithium Metal Polymer) 배터리를 카쉐어링 프로그램과 버스에 이미 상용화하여 시장을 넓혀가고 있다.
LMP배터리는 양극에 리튬인산철 (LFP)과 음극으로는 리튬메탈을 사용하며 전해질로는 PEO기반의 고분자 전해질을 사용하고 있다.[1]
- 볼로레(Bolloré) 블루카 (Blue car) 2011년
볼로레는 소형 4인승 3도어 전기 자동차인 블루카 (Bluecar)에 블루솔루션이 제작한 LMP배터리를 채용하였다.
배터리 팩의 용량은 30kWh로 시내에서 최대 250km, 고속도로에서 최대 150km를 운행할 수 있다. 최대 속도는 130km/h이고 배터리 무게는 300kg이다
2011년부터 프랑스에서 Autolib라는 차량 공유프로그램에 공급되었고 이후 미국과 영국, 싱가포르에서도 카쉐어링 프로그램에 공급하였다.
위에서 언급한대로 PEO 고체 전해질의 경우 60도 이하에서 이온 전도도가 떨어지기 때문에 블루카의 LMP 배터리 작동 온도는 60~80도이다.[1]
- 메르세데스 벤츠 eCitaro bus 2018년
2018년에 블루솔루션은 메르세데스벤츠의 전기버스 브랜드인 eCitaro에 자사의 LMP배터리를 탑재하였다.
eCtrao는 LMP배터리 버젼과 NCM양극, 액체 전해질을 사용하는 NCM버전 두가지를 출시하였다.
2020년에는 18m 굴절식 eCitaro G 모델에도 LMP배터리를 적용하여 운행 중이다.[1]
고체전해질의 특성과 장단점[편집]
각 고체 전해질의 특성과 장단점 비교 종류 이온전도도 (S/cm)
전위창 (V vs Li/Li+)
장점 단점 고분자 10⁻⁸~10⁻⁴ 0~5 •얇은 필름으로 성형 가능 •유연성이 있어 셀 제조 용이
•전극과의 점착성 우수
•가격이 저렴
•상온에서 이온 전도도 낮음 •고온에서 기계적 물성 떨어짐
•이온 전도도의 온도 의존성 큼
산화물 페롭스카이트 (Peroskite)
10⁻⁶~10⁻³ 1.5~5.5 •단결정 상태에서 이온전도성 우수 •다결정 상태에서 입계저항 증가 •음의 전위창이 나쁨
가넷 (Garnet)
10⁻⁶~10⁻³ 0~5.5 •전위창, 이온전도도 우수 •대기중 취급용의, 기계적, 화학적 안정성 우수
•대기 및 수분 중 장기 방치시 표면 반응 및 셀 열화 영향 나시콘 (NASICON)
10⁻⁶~10⁻³ 2.5~5.5 •단결정 상태에서 이온전도성 우수 •다결정 상태에서 입계저항 증가 •음의 전위창이 나쁨
황화물 10⁻⁴~10⁻² 0~5.5 •이온전도도, 전위창 매우 우수 •양극/음극 소재와 반응성 •고분자와 반응성
•흡습성 (H₂S 생성)
•대기중 반응성, 고순도 황화물 요구
각주[편집]
- ↑ 1.0 1.1 1.2 1.3 1.4 〈유기 고체 전해질 (Organic solid-state electrolyte)〉, 《티스토리》, 2022-11-25
- ↑ 2.0 2.1 2.2 준, 〈전고체 전지 2 - 고분자계 전해질〉, 《네이버 블로그》, 2022-07-03
참고자료[편집]
- 준, 〈전고체 전지 2 - 고분자계 전해질〉, 《네이버 블로그》, 2022-07-03
- 〈유기 고체 전해질 (Organic solid-state electrolyte)〉, 《티스토리》, 2022-11-25
- 〈전고체 전해질의 종류 및 분류〉, 《티스토리》, 2022-11-18
- 김주미·오지민·김주영·이영기·김광만 연구원, 〈리튬이차전지용 고체 전해질의 최근 진전과 전망〉, 《한국과학》, 2019-08-04
같이 보기[편집]

 위키원
위키원