무기 고체 전해질
무기 고체 전해질(Inorganice solid-state electrolyte)은 사용되는 소재에 따라 분류되는 전고체 전해질의 일종이다. 무기 고체 전해질은 열 안정성, 이온 전도도 및 넓은 전기화학적 영역에서 명백한 이점을 제공한다.
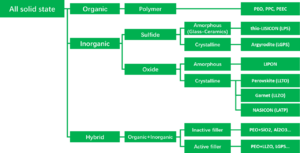
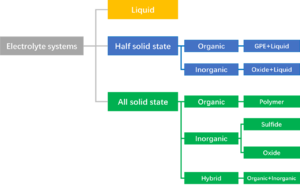
고체전해질은 사용되는 소재에 따라 아래와 같이 유기, 무기, 유기와 무기를 혼합한 하이브리드의 세 가지로 크게 분류할 수 있다. 무기 고체 전해질의 경우 위의 일반적으로 산화물계와 황화물계로 분류하는데 산화물계를 좀 더 정확하게 분류하면 Perovskite와 Garnet은 산화물(Oxide)계, Nasicon은 인산염 (Phospate)계, LIPON은 산화질화물 (Oxinitride)계의 4가지로 구분할 수 있다.[1]
목차
개요
무기 고체 전해질의 초기 개발품인 LixPOyNz(LiPON)은 주로 박막형 ASSLB용 전해질로 널리 사용되었으나 높은 공정비용 및 낮은 이온전도도(25℃에서 ~10⁻⁶S/cm)와 깨지기 쉬운 물성 때문에 실제 전지로의 응용이 제한되었다. 이후에 본격적으로 산화물계 및 황화물계 고체 전해질의 개발이 진행되었다. 대표적인 산화물 고체 전해질인 garnet형 Li₇La₃Zr₂O₁₂(LLZO)가 ~10⁻⁴S/cm의 높은 이온전도도와 우수한 열적 및 화학적 안정성을 보여 ASSLB 적용 가능성을 보였으며, LLZO에 소량의 Ta, Al, Ge, Nb, Te가 도핑되어 격자 에너지 활성화를 통해 이론적인 10⁻³S/cm에 근접하는 이온전도도 향상이 진행되었다. 또한 perovskite형 Li₀.₅La₀.₅TiO₃(LLTO)를 비롯하여 Na-type 초이온전도체(NASICON)형 Li₁+xAlxGe₂-x(PO₄)₃(LAGP)와 Li₁+xAlxTi₂-x(PO₄)₃(LATP) 등이 10⁻⁴~10⁻³S/cm의 우수한 이온전도도를 나타내었다. 이러한 산화물계 고체 전해질이 비교적 높은 이온전도도와 기계적 강도를 가지므로 리튬 덴드라이트의 억제에 도움을 줄 수 있는 한편, 깨지기 쉬운 물성 및 표면 거칠기로 인해 전극과의 접촉성은 열악하다.
한편 황화물계 고체 전해질은 높은 상온 이온전도도와 비교적 연질의 기계적 특성 때문에 전극과의 접촉성이 우수하여 ASSLB에 대한 적용성이 높다. 특히 2011년에 발표된 Li₁₀GeP₂S₁₂(LGPS)가 1.2×10⁻²S/cm, 2014년의 Li₇P₃S₁₁(LPS)가 1.7×10⁻²S/cm, 2016년에 보고된 LPSCl계 Li₉.₅₄Si₁.₇₄P₁.₄₄ S₁₁.₇Cl₀.₃이 2.5×10⁻²S/cm으로 리튬이온전지용 전해액 수준의 이온전도도를 기록한데 힘입어, 황화물계 무기 고체 전해질 연구가 ASSLB 실용화에 큰 가능성을 보이고 있다.
지금까지 발표된 무기 고체 전해질을 적용한 ASSLB 최고의 결과는 삼성종합기술원이 개발한 0.6 Ah급 Ag-/Li₆PS₅Cl/NMC 파우치 셀로서, 초기에 리튬 성분이 없는 Ag-C 전극 위에서 충방전이 반복됨에 따라 in-situ로 리튬이 균일하게 석출되는, 소위 "anodeless" 시스템을 채택하고 있다. 이 Ag-C층은 리튬 석출량을 조절하여 전기화학적 사이클 수명을 더욱 향상할 수 있는데, 실제로 이 전지는 에너지밀도 >900Wh/L, >99.8%의 쿨롱 효율, >1000 사이클의 장수명을 나타내고 있다.[2]
분류
산화물계 고체전해질 (Oxide)
무기 고체 전해질의 본격적인 전개는 1992년 LixPOyNz (lithium phosphorus oxynitride; LiPON)의 개발에서 비롯되었는데, LiPON은 리튬금속과의 안정적 접촉이 가능하고 넓은 전기화학적 창 (0-5.5V vs. Li/Li+)을 가질뿐만 아니라 무시할 정도로 낮은 전기전도도를 보인다는 장점이 있다. 그래서 LiPON은 박막형 전고체 리튬전지의 연구개발 시 기준 전해질로 널리 사용되었다. 그러나 낮은 이온전도도 (25℃에서 ~10⁻⁶S/cm)로인해 박막 전해질의 형태로만 사용할 수 있었고 깨지기 쉬워서 실제 전지로의 응용이 제한되었다.
1993년에는 Perovskite형 LLTO (Li₀.₅La₀.₅TiO₃)가 개발되어 2×10⁻⁵S/cm 이상의 이온전도도를 보였으며, 1997년에는 LAGP (Li₁+xAlxGe₂-x(PO₄)₃)와 LATP (Li1+xAlxTi₂-x(PO₄)₃)를 포함한 NASICON형 무기 고체 전해질이 처음 개발되어 각각 10⁻⁴S/cm와 1.3×10⁻³S/cm의 높은 이온전도도를 보였다. 2007년에는 garnet형 이온 전도체 LLZO (Li₇La₃Zr₂O1₂)가 처음 보고되었는데, 상온에서 3×10⁻⁴S/cm의 탁월한 이온전도도와 우수한 열적 및 화학적 안정성을 보여 전고체 리튬전지에 적용 가능성을 보였다.[1]
황화물계 고체 전해질 (Sulfide)
2011년에는 도쿄 공업대학의 Kanno 교수에 의해 "리튬 초이온전도체" (LISICON: Lithium Super Ion CONductor) LGPS (Li₁₀GeP₂S₁₂)가 상온에서 전해액 수준의 높은 이온전도도 1.2×10⁻²S/cm를 보이는 것이 보고되었다. 이 연구는 무기 고체 전해질 개발 역사상 획기적인 일로서, 전기자동차에 실제 적용을 위한 고출력, 고에너지밀도 에너지 저장 시스템의 가능성을 열었다.
그 이후 2014년에 다른 황화물 고체 전해질인 LPS (Li₇P₃S₁₁)가 1.7×10⁻²S/cm의 높은 이온전도도를 나타내는 것으로 보고되었다.
2016년에는 다시 Kanno 그룹에서 초이온전도체 Li₉.₅₄Si₁.₇₄P₁.₄₄ S₁₁.₇Cl₀.₃을 보고하였는데 이는 현재까지 최고의 상온 이온전도도인 2.5×10⁻²S/cm를 기록하였다.[1]
인산염계
Li₁+xAlxTi₂-x(PO₄)₃ (LATP)와 Li₁+xAlxGe₂-x(PO₄)₃(LAGP)와 같이 NASICON형 구조를 갖는 결정성 인화물도 상온에서 ~7×10⁻⁴ S cm-1의 높은 이온전도도, 6V의 넓은 전기화학적 창, 수분 환경에 대한 안정성을 갖는 탁월한 리튬이온 전도체로 알려져 있다. 상용 LATP의 전도도는 1.3×10⁻³S cm⁻¹까지 도달할 수 있다.
그러나 LLTO와 유사하게 LATP도 리튬금속 음전극에 대해 불안정하다. LISICON형 화합물의 결정구조가 gLi₃PO₄의 경우와 유사하게도 orthorhombic 단위 셀과 모든 양이온이 tetrahedral하게 배위되어 있는 Pnma 공간그룹을 보인다. 그러나 이런 종류의 소재는 상온에서 보통 ~10⁻⁷ S cm⁻¹ 정도의 낮은 이온전도도를 보이지만, g-Li₃PO₄의 P⁵⁺를 Si⁴⁺로 aliovalent 대체 개질을 통해 이온전도체 Li₃+x(P₁-xSix)O₄를 합성하면 3×10⁻⁶S cm⁻¹의 이온전도도를 얻는다.[3]
무기 고체 전해질을 이용한 전고체 전지의 이점과 연구 동향
Cool Earth50 무렵부터 축전지에 관해서는 문부 과학성 경제 산업성이 공동으로 나라의 로드맵을 작성해 왔다. 현재는 리튬 이온 배터리가 조금 진화하고 있고 스마트폰에 사용되는 작은 전지라면 300Whkg 가까운 에너지 밀도가 있지만 차량 탑재용으로는 아직 200Whkg에도 이르지 못하고 있다. 그것을 500Whkg이상으로 하지 않으면 자동차용으로 사용할 수 없기 때문에 차세대 축전지가 필요하다는 이야기가 되어 있다. 그 중 하나가 전고체 배터리이다. 단 전고체 자체는 에너지 밀도를 높이는 데에는 아무런 도움이 되지 않는다. 고체 전해질을 사용하기 때문이 아니라 활물질이 변함으로써 에너지 밀도는 올라간다. 그럼 왜 전고체로 에너지 밀도가 올라간다고 하는 것인가.
리튬이온전지가 전고체화되는 즉 전해액이 무기 고체 전해질이 되는 것으로 가장 중요한 것은 리튬이온 수율이 1이 된다. 싱글이온전도가 된다는 점, 그리고 유동하지 않는다는 점이다. 전고체화의 장점은 우선 안전성 신뢰성의 비약적 향상이다. 물론 난연성도 있지만 고체는 전해액에 비해 반응성이 압도적으로 낮고 반응이 그다지 일어나지 않으므로 제어하면 상당히 양호한 계면이 된다. 게다가 음이온이 움직이지 않기 때문에 반응이 심플하고 잘 만들면 이상적인 가역성이 높은 전지라 할 수 있다. 전지를 크게 하면 안전성에 문제가 생겨 여분의 부속품이 여러 가지 필요하지만 전고체화함으로써 그것들을 줄일 수 있다. 다음은 획기적 고에너지 밀도화이다. 지금 전기 자동차에서는 작은 전지를 많이 연결하여 사용하는 것이 주류가 되어 있고 예를 들면 통상의 리튬 이온 배터리를 몇백 개와 연결하여 몇백 볼트를 얻고 있다. 전고체의 경우 유동성이 없으므로 양극 전해질 부극을 100층 적층하면 수백 볼트의 전지가 된다. 즉 패키지로 에너지 밀도를 높일 수 있다. 또 전해액은 유동하기 때문에 기본적으로 1종류밖에 사용할 수 없지만 고체라면 정극에 적합한 산화안정성이 높은 것, 부극에 적합한 것, 세퍼레이터는 단락되기 어려운 것으로 구분하여 고전압의 전지를 구축할 수 있다. 게다가 지금은 잘 다루지 못하고 있는 재료, 예를 들면 금속 리튬이나 단체황 등, 고용량의 전극 활물질을 사용할 수 있을 가능성이 있어 혁신적 축전지를 모두 전고체로 실현할 수 있을 가능성이 있다.
마지막은 획기적 고출력화이다. 도요타와 도쿄공대가 발표한 논문에서는 전해액의 약 2배의 도전율을 가진 고체 전해질이 개발됐다고 했다. 지금까지도 전해액과 동등한 유리 세라믹이나 결정은 있었지만 그것을 뛰어 넘었다. 동시에 다양한 전지계 안에는 1000C라고 하는 대출력도 실증되었다. 라곤 플롯에서는 파워 밀도도 에너지 밀도도 슈퍼 캐패시터나 모든 차세대 전지의 위를 가는 전고체 전지가 나타나 주목받고 있다. 최근 10년간의 특허출원 현황을 보면 최근 56년 사이에 황화물형의 전고체 전지에 관한 출원수가 매우 증가하고 있다. 황화물형 전 고체전지는 일본이 앞서고 있으며 2013년 특허청 조사에서는 압도적으로 일본 기업의 출원이 많았지만 2020년쯤부터 해외에서의 대응이 급증하고 있어 상황은 변화하고 있다.[4]
무기 유리 베이스 고체 전해질과 그것을 이용한 전고체 리튬전지
산화물계의 무기 고체 전해질로 지금 매우 연구가 활발한 것은 Li₇La₃Zr₂O₁₂(LLZ)계이다 리튬금속에 대한 안정성이높다. Li₃BO₃Li₂SO₄계는 산화물계에서는 어려운 활물질과의 계면을 실온에서 만들 수 있다. 황화물계에서는 Li₁₀ GeP₂S₁₂(LGPS)가 유명하며 전해액과 동등한 10의 -2승 도전율이다. 알지로다이트(Li₆PS₅Cl)도 세계적으로 주목받는 재료로 실온에서 10의 -3승 도전율이다. 우리들의 연구실에서는 Li₇P₃S₁₁LPS₇0₃0나 Li₃.₂₅P₀.₉₅S₄라고 하는 유리의 가열에 의해서 세라믹화하는 프로세스에 임하고 있다. LPS(70:30)는 유리에서는 도전율은 낮지만 결정화에 수반해 높아져 소결로 10의 -2승까지 도달한다.
전고체 전지를 만들 때의 기본형이 박막전지이다. 역사도 오래되어 수십만 사이클로 움직이는 것도 있다. 그러나 에너지를 저축하는 것은 활물질이므로 활물질이 박막이면 자동차는 움직일 수 없다. 활물질을 조밀하게 채워 넣은 리튬이온 2차전지와 같은 구성으로 하려면 활물질과 고체 전해질의 입자를 배합한 복합체로 할 필요가 있다. 일반적으로 고체와 고체의 계면은 고액계면처럼 쉽게 만들 수 없는데 예를 들어 코발트산 리튬입자와 LPS(70:30) 유리세라믹을 배합하여 콜드프레스하면 그것만으로 계면이 생기고 LPS만의 프레스로는 10의 -3승 도전율이 나온다. 이 현상을 도레이 리서치 센터에서 분석한 결과 분체 입자를 프레스한 것만으로 입계가 거의 보이지 않게 되는 것을 알았다.
산화물계의 LLZ의 경우 1200°C로 소결하면 10의 -4승에서 -3승 가까운 도전율을 나타내지만 실온에서 프레스한 것만으로는 입계 투성이로 측정조차 할 수 없다. 이것이 고체 전해질로 황화물계가 선택되는 이유이다. 우리는 현재 JST의 첨단 저탄소화 기술개발차세대 축전지ALCASPRING의 전고체전지팀으로 활동하고 있는데 전고체전지 개발의 방향성으로서 두 가지 흐름이 있다. 하나는 부피 에너지 밀도 중시의 예를 들면 전고체 리튬 이온 전지 고전위의 산화물계의 정극을 사용한다. 에너지 밀도를 높이기 위해서 활물질의 비율을 얼마나 늘릴지가 중요한 과제이다. 또 하나는 중량 에너지 밀도 중시의 예를 들면 전고체 리튬 황전지다. 고체 전해질이 황화물계이므로 모두 활물질로 만들어 버리는 즉 고체 전해질과 활물질을 일체화하는 방향으로 개발에 임하고 있다. 이 대처는 산화물계에도 적용할 수 있어 전고체 전지의 하나의 모습이 된다고 생각한다.[4]
각주
- ↑ 1.0 1.1 1.2 〈전고체 전해질의 종류 및 분류〉, 《티스토리》, 2022-11-18
- ↑ 김광만 연구원, 〈차세대 리튬이차전지용 고체 전해질 기술〉, 《전자통신동향분석》, 2021
- ↑ 김주미·오지민·김주영·이영기·김광만 연구원, 〈리튬이차전지용 고체 전해질의 최근 진전과 전망〉, 《한국과학》, 2019-08-04
- ↑ 4.0 4.1 ceraMing, 〈(2018)무기고체전해질을 이용한 전고체Li2차전지의 개발〉, 《티스토리》, 2021-08-28
참고자료
- 〈전고체 전해질의 종류 및 분류〉, 《티스토리》, 2022-11-18
- 김광만 연구원, 〈차세대 리튬이차전지용 고체 전해질 기술〉, 《전자통신동향분석》, 2021
- ceraMing, 〈(2018)무기고체전해질을 이용한 전고체Li2차전지의 개발〉, 《티스토리》, 2021-08-28
- 김주미·오지민·김주영·이영기·김광만 연구원, 〈리튬이차전지용 고체 전해질의 최근 진전과 전망〉, 《한국과학》, 2019-08-04
같이 보기

 위키원
위키원