납축전지

납축전지(lead–acid battery, 鉛蓄電池)는 납과 황산을 전극과 전해질로 사용하는 전지로서, 충전 방전을 통해 반복해 사용할 수 있는 2차전지이다. 납산배터리, 납전지, 연축전지라고도 부른다. 1859년 프랑스의 가스통 플랑테(Gaston Planté)가 개발한 가장 오래된 형태의 2차전지로 현재 자동차에 널리 활용되고 있다. 지금도 가장 많이 사용되는 이유는 안정된 품질과 신뢰성, 경제성 때문이며, 니켈 카드늄 축전지도 사용되는데 납축전지 대비, 비싸지만(약 5배정도) 강도, 수명, 취급 용이성에서 우수함으로 사용된다.
| [타고] 1개월 단위로 전기차가 필요할 때! 타고 월렌트 서비스 |
목차
개요[편집]
납축전지는 전기화학반응을 이용하는 축전지로 과산화납을 양극(陽極)으로, 납을 음극으로 사용하고 전해액(電解液)으로는 비중 약 1.2의 묽은 황산을 쓴다. 화학반응이 가역적(可逆的)이며 충전해서 사용할 수 있는 2차전지이다. 자동차 축전지 등으로 널리 쓰인다.
이온화도가 다른 두 개의 전극으로 이루어진 회로를 전해액을 통하도록 구성하면 이온화도가 큰 쪽의 전극으로부터 반대쪽 전극으로 전자가 이동하게 된다. 1800년 이탈리아의 볼타는 이러한 현상을 이용하여 은판과 아연판을 이용한 최초의 1차전지인 볼타전지를 발명하였다.
납축전지는 볼타전지와 같은 전기화학반응을 이용하는 2차전지이다. 과산화납(PbO2)을 양극(陽極)으로, 납(Pb)을 음극으로 사용하고 전해액(電解液)으로는 비중 약 1.2의 묽은 황산(H2SO4)을 쓰며 전류가 흐를 때 각각의 전극에서는 다음과 같은 화학반응이 일어난다.
역사[편집]
1800년 세계최초의 전지로 일컬어지는 볼타전지 이후에 전지의 계보는 다니엘 전지, 르크랑세 전지로 이어졌다. 그런데 이 기간 동안인 1839년에는 영국의 윌리엄 그로브(William Robert Grove)에 의해서 세계 최초의 연료전지(fuel cell)가 개발되었고, 공기전지의 원리가 발견되었다. 1840년에는 영국의 Amstring에 의해서 수력발전기가 발명되었다. 그리고 1859년 전지 역사에 있어서 또 하나의 위대한 발명인 프랑스의 물리학자 가스통 플랑테(Gaston Plante)에 의해서 오늘 날까지도 가장 큰 전지 시장을 이루고 있는 납축전지(연(鉛)축전지라고도 한다.)가 발명되게 된다. 이때까지의 모든 전지는 화학적 반응이 다 되면 폐기하여야 하는 화학적으로 비가역적인 상태의 1차전지였는데 Plante의 납축전지는 납-산성(lead-acid)전지로서 이 전지의 의미는 전기를 사용함으로써 화학반응이 진행되고 난 이후에 다시 전기를 재충전할 수 있는 화학적으로 가역상태의 2차전지라는데 있다고 하겠다. 1854년 독일의 진스테텐은 황산에 2장의 납판을 담그고 여기에 직류를 흘려 보내는 실험을 하였다. 플랑테는 이 실험을 더 진행시켜 얇은 박막 형태로 만든 납 박(箔)2장을 김밥 모양(spiral)으로 둘둘 말아 전해액에 담그고 전기를 흘려 보내면 2차 기전력이 발생하는 것을 발견하였고, 1859년에 납축전지의 발명에 성공하였던 것이다. 그의 전지는 열차가 역에 정지하고 있는 동안 객차에 불을 밝히는데 사용되었다. 독일의 지멘스(Siemens)가 직류발전기를 발명한 것은 이보다 7년 뒤인 1866년의 일이었을 만큼 전기가 다른 전기 분야에 비하여 발전이 빨랐다.
그런데 플랑테 납축전지의 단점은 납판을 충전시켜 축전지의 캐소드로 만드는데 며칠씩 걸렸기 때문에 이 시간 단축을 위하여 많은 노력들이 이루어졌다. 1881년에 프랑스의 카밀 알폰스 파우레(Camille Alphonse Faure)는 납 산화물의 분말을 황산에 개어 페이스트 형태의 황산아연으로 만든 뒤, 이것을 납으로 된 격자(Grid)에 바르는 획기적인 방법을 개발하였다. 이 격자판이 많을수록 더 좋은 성능을 얻을 수 있었고, 이것은 쉽게 양산화될 수 있는 디자인을 지니고 있었다. 납산 배터리를 제조한 초기(1886년) 제조자는 헨리 튜더(Henri Tudor)였다. 납과 황산을 이용한 납전지 이외에도 납과 강염기성의 수산화칼륨 용액을 이용한 알칼리 축전지도 개발되었다.
이 배터리는 액체 대신 젤 전해액을 사용하여 누출 없이 배터리를 서로 다른 위치에서 사용할 수 있었다. 1930년대에는 젤 전해액 배터리가 처음 사용되었고, 1920년대 후반에는 휴대용 여행 가방 라디오 세트가 밸브 설계로 인해 셀을 수직 또는 수평으로(반전하지는 않음) 사용할 수 있게 되었다. 1970년대에는 현대적인 AGM(Absorbed Glass Mat) 타입을 포함하여 밸브 조절식 납산 배터리(VRLA 또는 "sealed")가 개발되어 어느 위치에서나 작동이 가능해졌다.
2011년 초에 납산 배터리는 실제로 기능을 위해 상대성이론의 일부 측면을 사용했으며, Ca-Sb 및 Sn-Bi와 같은 낮은 수준의 액체 금속 및 용융 염 배터리도 이 효과를 사용한다는 것이 발견되었다.[1] [2]
구조[편집]
양극(+)극으로 쓰이는 이산화 납판과 음극(-)극으로 쓰이는 납판이 진한 황산에 잠겨 있는 구조를 한다.(음극은 산화전극을 일컫는 말이며, 양극은 환원전극을 일컫는 말이다. 구형 납 축전지는 밀폐 상태가 안 좋아 주기적으로 진한 황산을 채워 넣어주어야 했지만 현재 시판중인 납 축전지는 내부가 완전히 밀폐되어 황산 누출의 위험이 없다.
장단점[편집]
장점[편집]
- 낮은 제조 원가 : 사용되는 원재료 구입이 용이함
- 대용량이 가능하며 다양한 크기로 제작 가능함(최소 1AH에서 수천 AH용량의 전지)
- 고율 방전 특성이 우수함(Ni-Cd가 더 우수)
- 저온, 고온 방전 특성이 우수함
- 충전 효율이 우수함 : 방전/충전 = 70%이상
- 높은 cell 전압 : 개회로 전압 : 2.0V이상
- 쉽게 충전 상태 확인 : 밀폐형인 경우 어렵다.
- 과 충전 저항력이 강함
- 무보수 축전지 가능
- 다른 2차 전지 대비 가격 경쟁력 우수[3]
단점[편집]
- 상대적으로 수명이 짧음(Ni-Cd대비)
- 에너지 밀도가 낮음. 30-40Wh/kg
- 충전상태 지속성이 낮음. 자기방전
- 방전후 장기 보존이 어렵다. 수명에 치명적임
- 매우 작은 size로 제작이 어려움. Ni-Cd:단추형 및 500mAH 이하 가능
- 수소가스 발생. 화기 주의
- 중금속: 납
- 국부 열화(thermal runaway)현상 발생 위험 -VRLA(valveregulated lead acid) [3]
원리[편집]
납 축전지의 원리는 다음 반응식으로 설명되며, 반응하는 순간은 고체 상 반응이 아닌 액상 반응이라는 점이다. 이는 매우 중요한 사실이며 고체↔액체↔고체 사이로 움직이므로 움직이는 과정에서 필연코 손실이 발생한다. 이것이 수명 종료 원인이다.
- 전체 반응식 PbO₂ + Pb + 2H₂SO₄ ⇔ 2PbSO₄ + 2H₂O
- 양극 반응식 PbO₂ + 3H⁺ + HSO₄⁻ + 2e ⇔ PbSO₄+ 2H₂O
- 음극 반응식 Pb + HSO₄⁻ ⇔ PbSO₄ + H⁺ + 2e
위 반응식에 음극 반응식을 보면 전자가 생성됨을 알 수 있다. 이는 전자가 음극에서 양극으로 이동하여 전류가 양극에서 음극으로 발생됨을 알 수 있다. 즉 축전지의 용량을 결정하는 것은 전자를 흡수하여 조절하는 양극 반응물이라는 점이다. 축전지를 설계하는 자들은 양극 반응물로 축전지 용량을 설계하며, 음극은 양극대비, 부족하게 설계한다. (주 절대적인 것은 아니며, 이는 밀폐형 납 축전지에서 설명한다.) 중요한 점은 액상 반응이라는 것을 필히 인지하여야 다음에 기술되는 축전지가 조기에 수명이 종료되는 것을 이해할 수 있다.
상세[편집]
배터리의 충전/방전 원리는 기본적으로 물질의 산화/환원 반응이다. 간략하게 산화(oxidation)는 전자를 잃는 것을 말하며, 환원(reduction)은 전자를 얻는 것을 말한다. 납축전지의 음극과 양극에서 발생하는 반응은 다음과 같다.
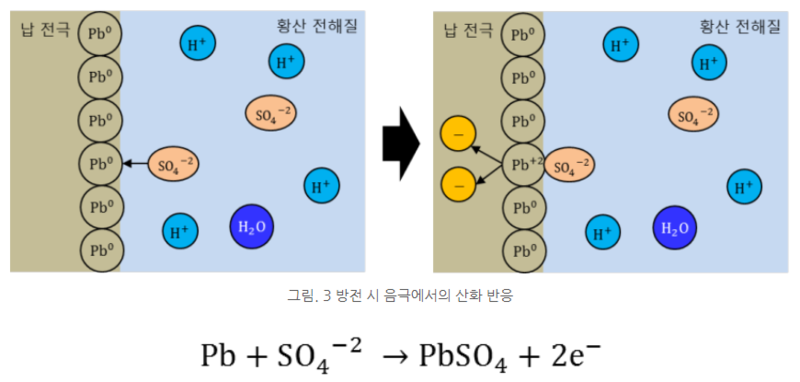
방전 시 음극에서는 산화 반응이 발생하며, 양극에서는 환원 반응이 발생한다. 그림과 같이 납 전극에서는 황산 이온이 납과 결합하면서 전자 2개가 방출된다.
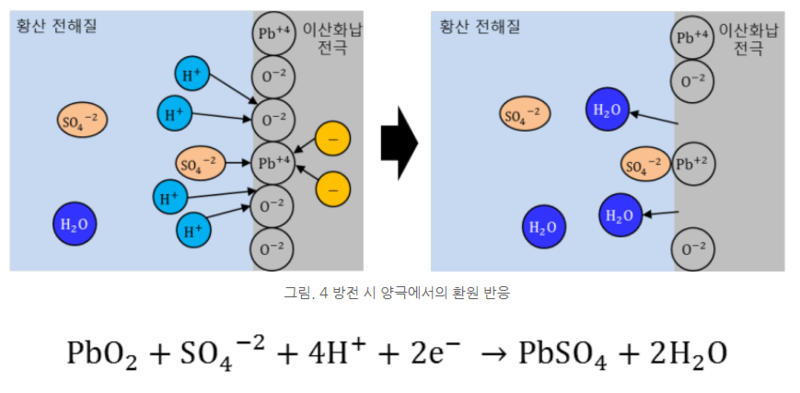
아래 그림과 같이 이산화 납 전극 표면에서는 황산 이온과 수소 이온이 이산화 납과 반응한다. 이때 전자 2개가 납과 결합하면서 황산납이 된다. 그리고 산소 이온은 전해질의 수소 이온과 반응하여 물 분자가 생성된다.
납축전지에서 공칭 평형 전압은 셀당 2V이며 방전 시에는 셀당 2V 이하가 된다. 자동차에서 사용하는 납축전지는 셀을 6개 연결하여 12V 공칭 전압을 만들어내며, 방전 시는 12V 이하로 떨어진다. 충전 시에는 위 그림의 반대 방향으로 반응이 발생한다. 그리고 셀당 2V 이상이 되어 납축전지 공칭 전압은 12V 이상이 된다.[4]
종류[편집]
납축전지는 역사가 오래된 만큼 사용분야에 따라 종류도 많고 사이즈도 다양해 구분방법도 자료마다 조금씩 차이가 난다. 크게 나누자면 '사용분야'와 '설계방법'에 의한 2가지 구분 방법이 있다.
사용에 따른 구분[편집]
자동차용 납축전지와 딥-싸이클 두가지로 나뉜다. 납축전지가 가장 많이 사용되는 분야는 자동차이다. 자동차에 사용되는 모든 배터리는 전기자동차가 아닌 이상 납축전지라고 보면 된다. 가격대비 제조비나 성능이 제일 좋기 때문에 개발된지 거의 150년이 넘어가지만 아직도 주류제품으로 자리를 잡고 있다. 그 다음으로 많이 사용되는 분야는 '태양광'을 통한 백업용 전력저장 장치나 골프카트, 모터보트, 오토바이 등 모터로 구동하는 소형 운송수단의 전원으로 사용되는 딥싸이클(Deep cycle) 배터리가 있는데 자동차용 납축전지는 스타터 배터리(starter battery) 또는 크랭크 배터리(cranking battery)라 부르고 그 이외의 납축전지는 보통 딥싸이클 배터리라고 부른다.
이 둘의 차이점은 기본설계는 동일하지만 내부 부품들의 설계가 다르다. 자동차용 배터리는 짧은 시간 동안 아주 높은 전류가 흘러야 하고 전체 배터리용량을 다 사용하지 않고 아주 심한 경우에도 용량의 20% 정도까지만 사용할 수 있게 설계된 반면(그 이상 방전시키면 배터리 수명이 급격히 떨어짐), 딥싸이클 배터리는 자동차 배터리보다 낮은 전류를(같은 용량의 자동차용 배터리 대비 1/2수준) 계속 사용하면서 배터리 용량의 45~75%까지도 사용할 수 있게 만든 배터리로 서로 호환해서 사용할 수 없다.[3]
설계방법에 따른 구분[편집]
모든 배터리는 내부에서 화학반응을 일으켜 전기를 축적하기 위해 '전해액'을 사용하는데 전해액이 액체상태인 배터리를 플러디드 타입(Flooded type)이라고 부른다. 'Flooded'란 단어는 액체에 담궈진 정도의 의미인데 (+)극과 (-)극을 구성하는 금속판을 전해액에 담그는 형태를 일컫는다. 그래서 자동차 배터리를 보면 내부에 황산(sulfuric acid)와 물을 섞은 전해액이 들어있고 반드시 반듯한 상태에서 사용하게 되어 있다. 배터리를 구성하는 단위 셀이 젖어 있는 상태라고 해서 'Wet cell'이라고도 부른다.
전해액을 액상이 아니라 '젤(gel)'형태로 만들거나 유리섬유에 전해질을 같이 밀착시켜 사용하는 AGM(absorbed glass mat)형태로 만든 것이 보통 'VRLA(Valve Regulated Lead Acid)' 또는 'MF배터리라고 불리는 배터리이다.
MF란 maintenance free의 약어로 쉽게 말해 '유지보구가 필요없는' 배터리라는 뜻이고 이 말은 초기의 납축전지가 배터리에 증류수를 채워 넣거나 전해액 상태를 수시로 확인하는 것과 같은 잡업이 필요 없다는 의미로 사용된 것이다. 요즘은 자동차용 납축전지도 MF배터리 형태로 나오기 때문에 MF배터리가 반드시 젤형태나 AGM형태라고 말할 수 없다. 납축전지 라벨에 표시된 배터리 형태를 보고 구분하는 수 밖에 없으나 소형 납축전지는 대부분 AGM형태가 많고 대형 배터리일 수록 액체상태의 전해액을 사용하는 것으로 보면 된다. 구분 방법은 전해액이 액상인 경우는 배터리 외부에 내부 전해액 상태를 확인할 수 있는 작은 창이 있어(유지보수 목적보다는 배터리 수명을 판단하기 위해)색깔로 구분할 수 있으면 플러디드 타입, 창이 없으면 젤이나 AGM타입으로 보면 된다.
일반적으로 자체방전은 플러디드 타입이 심하고 VRLA타입이 덜하지만 과충전에 대한 내성은 플러디드 타입이 좋고 VRLA타입은 약한 것으로 알려져 있어 충전 시 신경을 써야 한다.
자동차용 납축전지는 항상 반듯한 상태에서 사용하도록 되어 있고 수시로 전해액 상태를 점검해야 하지만 MF배터리는 점검할 필요가 없는 대신 한번 일정전압 이하로 방전되면 배터리를 못쓰게 되어 버린다. 그래서 어느 형태든 수시로 전압을 확인하고 다시 충전을 시켜줘야 한다.[3]
특징[편집]
납축전지는 자체방전이 심한 편이다. 3~20%/month 정도라해도 오래 사용하지 않는 경우 충전을 해주어야 한다. Wet타입이 자체방전이 더 심하고 VRLA타입은 상대적으로 작으나 역시 높은 수준이다. 특히 자동차배터리 같은 경우 몇 주 동안 사용을 하지 않으면 배터리에 문제가 생길 수 있다. 그래서 오래 사용하지 않을 때에는 가능한 1시간 정도 주행을 한 후 완전 충전시켜 놓는다.
니카드 배터리가 메모리 효과가 문제라고 하지만 납축전지의 황산화(sulfation)만큼은 아니다 라고 할 정도로 납축전지는 황산화가 문제인데 대부분 제 수명을 못 채우고 폐기되는 납축전지의 90%가 이 황산화때문이다. 여기서 황산화라 함은 배터리가 방전하면서 전해질 속 황산이 분해되어 황과 물로 분해되는데 이때 황 결정이 플레이트에 쌍ㅎ이게 되고 이때는 부드러운 상태의 황이라 충전을 하면 다시 물과 결합되면서 황산으로 되면서 없어지게 되는데 배터리를 방전이 계속된 상태로 오래 놔두거나 오래 방치하는 경우 이 부드러운 황이 딱딱한 황 결정으로 변해 버리게 되면 그때는 충전을 해도 없어지지 않게 되어 문제가 생기게 되는 것을 말한다. 그래서 납축전지는 수시로 전압을 확인해 방전이 어느 정도 진행되면 충전을 계속해서 완충 상태로 유지하는 것이 중요하다.
방전상태에서 오래 놓아두면 황산화가 생기지만 반대로 과충전(overcharge) 상태로 오래 놓아두면 내부 그리드가 부식되는 현상이 빨라지고 가스 발생이 높아진다. 이 부식현상은 외부 배터리 전극에서도 나타나는데 납축전지는 문제소지가 많은 배터리임에는 틀립없다. 그러니 수시로 체크하고 관리가 필요하다.
또 한가지 문제는 위 두가지 현상 외에 내부쇼트라는 현상이 발생하는데 방전을 하면서 납-플레이트에 황산결정이 쌓이면서 플레이트가 팽창해 두꺼워지면서 내부에서 쇼트가 발생할 수 있고 그리드가 부식하면서 부서진 납가루들이 내부에 쌓이면서 자체방전이 심해지는 현상으로 나타나기도 한다. 특히 이 현상은 딥싸이클 배터리의 경우에 심하다고 한다. 이유는 플레이트의 두께가 상대적으로 두꺼워 그렇고 이름처럼 방전을 오래하는 배터리의 특성상 확률이 높아지기 때문이라고 보면 된다.
이 밖에도 배터리 제조 시 분리막과 플레이트의 정렬이 틀어지면서 발생하는 'mossing', 그리고 플레이트에 용접되는 연결막대에서 분리된 커다란 납덩어리에 의해 발생하는 'lead drop'이라는 현상도 있다.[3]
충전방법[편집]
납산 배터리의 충전 방법은 아래 그림과 같다. 초기에 큰 전류가 흐르지 않도록 제한하면서 정전류 (constant current : cc) 충전을 진행한다. 재충전이 되면 전류를 낮은 값으로 감소시키며 셀 전압이 2.39V 가 넘어가지 않게 정전압 (constant voltage : cv) 충전을 진행한다. 셀이 과충전 되면 가스가 발생하여 배터리의 수명이 떨어지기 때문이다. 이제 배터리에서 부하를 통해 방전되면 그때마다 펄스 형태로 충전을 진행한다..[4]
용도[편집]
토요타 캠리 하이브리드에도 납축전지가 들어가 있다. 납축전지는 자동차 SLI(Starting, Lighting, Ignition) 역할을 한다. 시동, 점등, 점화의 역할만이 아니라 내비게이션, 블랙박스, 통풍/온열 시트 같이 점점 세밀해지는 자동차 성능에 대한 요구 때문에 납축전지도 중요해지고 있다. 리튬이온 배터리가 배터리 역사에 극적으로 등장했고 미래의 배터리로 이야기되지만, 납축전지 역시 여전히 필요한 배터리이다.
납축전지는 크게 운송 장치(Transportation), 동력 장치(Motive Power), 예비 전력(Reserve Power)으로 나눌 수 있다. 운송 장치로는 자동차, 선박, 오토바이, 골프 카 등이 있고 동력 장치로는 산업용 리프트, 기관차 등이 있다. 예비 전력으로 무정전 전원 장치(UPS) 등이 있다. 이 중에서 자동차가 납축전지 시장의 80%를 차지할 정도이며 무정전 전원 장치(UPS, Uninterruptible Power System) 수요의 증가로 산업용 배터리 수요도 늘고 있다.
각주[편집]
참고자료[편집]
- 〈납축전지〉, 《화학백과》
- 〈납축전지〉, 《두산백과》
- 〈납축전지〉, 《위키백과》
- 납축전지교육(글로벌파워) - file:///C:/Users/sms/Downloads/%EB%82%A9%EC%B6%95%EC%A0%84%EC%A7%80%EA%B5%90%EC%9C%A1-1.pdf
같이 보기[편집]

 위키원
위키원