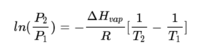기화
기화(氣化, vaporization, evaporation)란, 액체 상태의 물질이 기체 상태의 물질로 되는 현상을 말한다. 기화의 반대말은 액화이다. 주로 액체가 증발하거나 끓을 때 기화가 일어나며, 운동이 활발해진다. 기화가 일어나는 주된 원인은 바로 열에너지 흡수 때문이다.
액체가 기화 시 열에너지가 필요하며, 기화 시 액체가 흡수하는 열을 기화열이라고 한다. 액체는 주변에서 기화열을 흡수하며, 이러한 현상을 활용해 땀이 기화할 때 체온 저하 효과가 크게 나타나도록 만든 섬유를 '냉감섬유' 라고 한다. 냉감섬유로는 '쿨토시' 등 각종 기능성 의류를 제작한다.
리튬이온 배터리가 고온에 노출되면 가장먼저 유기 전해액인 전해질 용액이 기화된다. 가스로 변하면서 부피가 커지고 때문에 리튬이온 배터리가 고온에 노출되면 빵빵하게 부풀어 오르는 부피변화를 가져 오는데 이 원인제공자가 바로 전해액이다. 때문에 고온에 노출된 상태에서 계속적인 충전과 방전이 진행되면 더욱 열이 높아져 기화 수준을 높게 하고 동시에 양극재료의 결정구조가 붕괴되면서 산소이온이 탈리가 일어나 산소와 일부 혼합되거나 또는 기체가 만들어내는 압력을 외부 케이스가 버티지 못하고 파손되어 만들어진 틈으로 공기중의 산소와 혼합되고 여기에 일그러진 배터리의 변형으로 인하여 격리막이 파손되고 음극과 양극이 충전 상에서 접촉하여 쇼트를 일으켜 불꽃이 발생하여 점화원을 제공하면 발화가 일어나고 이모든 과정이 순차적으로 겉잡을 수 없이 벌어지기 때문에 이러한 고온의 노출에 인하여 열폭주 현상이 발생한다.[1] 그리하여 업계에서는 액체 전해질 대신 고체를 사용한 전고체 배터리를 개발 연구하고 있다.
개요
액체 상태의 물질이 기체 상태로 바뀌는 현상을 기화(vaporization)라고 한다. 기화에는 두 가지 현상이 있는데 증발(evaporation)과 끓음(boiling)이다.
증발(evaporation)은 표면의 액체 분자가 참여한다는 점에서 액체 전체가 기체로 바뀌는 끓음(boiling)과 구별된다. 끓음은 끓는점에서 액체상태와 기체상태의 자유에너지가 같아지고 그 이상의 온도가 되면 기체상태의 자유에너지가 액체상태보다 더 작아져서 열역학적으로 자발적으로 기체가 되는 현상이다. 하지만, 증발은 액체 분자가 주변 분자와 끊임없이 충돌을 하는 과정에서 순간적으로 높은 에너지를 가지게 되어 주변 액체분자들과의 결합을 끊고 기체가 되어 액체와 분리되는 상황을 일컫는다. 액체 내 분자는 다른 분자들로 둘러싸여 강하게 속박되므로 끓는점에 이르러서야 결합을 끊고 기체로 변할 수 있으나 표면에 있는 분자는 아래로만 속박되고 표면은 노출되어 있어 더 낮은 온도에서도 기체로 변할 수 있다. 증발에 의해 액체 분자가 기체 분자로 바뀌어 액체가 감소하는 것을 관찰하려면 액체 위 공기가 기체분자로 포화되어 있지 않아야 하고 기체 상태의 증기압(vapor pressure)이 너무 크지 않아 에너지를 흡수한 분자가 증기압을 이겨내고 공기 중으로 나갈 수 있어야 한다. 증발이 일어나려면 분자가 이에 충분한 에너지를 확보하여야 한다. 이때, 기체로 바뀌는 분자는 주변부에서 에너지를 빼앗아 오므로 (흡열반응) 증발에 의한 냉각 효과가 일어난다. 이 에너지를 기화열이라고 한다. 따라서, 증발은 에너지 분배에 요동에 의해 보유 에너지가 속박을 끊을 만큼 큰 에너지를 가지게 되는 아주 소수의 분자에 의해서만 일어난다. 높은 에너지를 갖는 분자들의 무리가 기화되고 남아있는 분자들은 가지고 있는 에너지를 재분배하여 볼츠만-맥스웰 분포 (Boltzmann-Maxwell distribution) 형태의 에너지 분포를 갖고 액체계는 에너지를 잃고 온도가 감소하게 된다. 이렇게 냉각이 일어난다. 한편, 기체 분자가 점점 늘어나면 증기압이 더 커지게 되고 어느 순간 냉각된 액체가 갖는 증발하려는 경향이 더 커진 증기압과 같아지게 된다면, 즉, 응결하려는 경향과 같아지게 되면, 순 증발량이 0이 되어 증발이 멈추게 된다. 닫힌 용기 안에서 증발이 일어나는 경우에는 계속 증발이 일어나다가 주변 공기부가 포화가 되면서 증발이 멈추게 된다.
위에서 언급한 바와 같이 일부 고에너지 분자가 먼저 증발에 의해 기화되면 액체계의 평균 에너지는 감소하게 된다. 즉, 냉각된다. 이를 증발냉각(아래 그림)이라고 한다. 뜨거운 커피나 차에 입김을 불면 커피나 차가 점점 식는 이유도 증발냉각 때문이며, 땀이 증발하거나 알코올이 묻은 후 증발하면 차갑게 느껴지는 것도 이 과정에서 발생하는 기화열이 몸의 열을 빼앗아 가기 때문이다. 이와 물리적으로 같은 원리가 원자 가스를 냉각하여 보즈-아인슈타인 응축체 (Bose-Einstein condensate) 를 만들 때 이용하는 증발 냉각(evaporation cooling) 기술이다.
닫힌 공간에서 증발이 일어나면 액체 상을 떠난 입자는 점차 공기 중에 축적된다. 기체상의 입자 밀도가 커지고 증기압이 커지면 이들 중 더 많은 입자가 다시 액체상으로 돌아오게 된다. 이러한 증발과 응결이 어느 순간 동일하게 일어나면 증발 평형에 도달하고 이때 공기는 포화되었다고 말한다. 이 순간 어느 한 쪽 방향으로의 물질의 순 이동이 없다. 기체와 액체로 구성된 순수한 물질의 계에서 평형 상태는, 클라우지우스-클레이페이론 관계식 (Clausius-Clapeyron relation) 에 따라, 온도와 그 온도에서의 증기압, 기화 엔탈피 사이에 다음과 같은 관계식이 성립한다.
여기서 P₁, P₂는 온도 T₁, T₂일 때의 기체의 압력이고 ∆Huap는 기화 엔탈피이고 R은 기체상수이다. 두 상태 사이의 엔탈피는 주어지므로 한 (온도) 상태에서의 증기압을 안다면 다른 온도에서의 증기압을 알 수 있고, 특히 증기압이 대기압과 같아지는 온도를 찾을 수 있고 이것이 끓는점이 된다. 또는 온도와 압력의 관계를 실험적으로 구한다면 이로부터 기화 엔탈피도 구할 수 있다.
증발 속도에 영향을 미치는 요소들은 다음과 같다. 공기 중 증발 물질의 농도: 이미 증발 물질이 공기 중에 많다면 액체 물질의 순 증발 속도는 작아진다. 순 증발 속도는 증발/기화 속도에서 응결 속도를 상쇄하고 남는 것인데, 이미 공기 중 증발 물질의 포화상태라면 응결 속도가 기화 속도만큼 커서 순 증발 속도는 0이 될 것이다. 공기 유속: 액체 위 신선한 공기가 흘러 지나가고, 그 속도가 크다면, 계속 증발 물질의 농도를 낮게 유지할 수 있을 것이다. 압력: 공기 압력이 크다면 분자들이 표면을 떠나서 증발되는 것을 억제할 것이다. 표면적: 액체의 표면적이 넓다면 증발하는 물질의 양이 더 클 것이다. 온도: 물질의 온도가 높다면 분자 당 평균 운동에너지가 더 클 것이고 그러면 액체 상태에서 속박하는 에너지를 극복하고 더 잘 증발할 것이다.
각주
- ↑ 평범한 사람, 〈리튬이온배터리에 관한 고찰 - 전해질, 집전체, 케이스〉, 《네이버 블로그》, 2010-03-12
참고자료
같이 보기

 위키원
위키원