암모니아
암모니아(ammonia)는 1개의 질소 원자와 3개의 수소 원자가 결합된 알칼리성의 화합물이다. 분자식은 NH₃이다. 상온에서는 특유의 자극적인 냄새가 나는 무색의 기체 상태로 존재하고 있다. 대기 중에도 소량에 양이 포함되어 있으며, 천연수에 미량 함유되어 있기도 하다. 토양 중에도 세균의 질소 유기물의 분해 과정에서 생겨난 암모니아가 존재할 수 있다. 대표적인 반자성체 중 하나이다.
부식성이 있고, 삼킬 경우 입과 목, 위장에 화상을 입히며, 심할 경우 사망할 수도 있다. 목의 통증, 구토, 설사 등을 유발할 수 있다.
부식성이 있으며, 점액질과 상부 기도의 조직에 심한 해를 입힌다. 타는 듯한 느낌, 기침, 헐떡거림, 후두염, 숨 가쁨, 두통, 구토, 설사 등을 유발할 수 있다. 발작이나 후두부종, 기관지부종, 화학 물질에 의한 폐렴, 폐수종이 발생할 경우 치명적일 수 있다.피부 접촉은 염기에 의한 부식으로 통증, 발적, 심각한 염증 또는 3도 화상을 일으킬 수 있다. 피부를 통한 흡수는 몸 전체에 영향을 줄 수 있다. 장기적인 피부 노출은 피부염을 일으킬 수 있다.[13] 흐릿한 시야, 발작, 통증, 심각한 조직 화상과 눈의 손상을 가져올 수 있다. 일시적 또는 영구적 실명을 일으킬 수 있다.
독성물질로 분류되어 있으나, 최근 수소 경제와 연관된 에너지원으로 고려되고 있다.
개요
가장 간단한 수소화 닉토젠(pnictogen) 계열의 화합물이자 독특한 자극적인 냄새가 나는 무색 기체인 암모니아는 음식과 비료의 전구체로써 육상 생물에게 필요한 영양소를 제공한다. 대기 중에도 소량 포함되어 있으며, 하천이나 토양의 세균이 질소 함유 유기물을 분해하는 과정에서도 생성되기에 미량으로 존재할 수 있다. 직간접적으로 다양한 제약 제품 합성 과정에 사용되며 상업적으로 판매되는 세정제에도 쓰인다. '암모니아'라는 이름은 의식(rituals) 중에 염화 암모늄(NH₄Cl)을 사용했던 이집트 신 '아멘(Amun)'의 숭배자들을 지칭하던 암모니안(Ammonian)에서 유래되었다. 고농도의 암모니아는 부식성이 있고 극도로 유해한 물질이며, 물에 매우 잘 녹아 흔히 암모니아수로도 불리는 염기성의 수산화 암모늄(NH₄OH)을 만든다. 산업용 암모니아는 일반적으로 28% 암모니아가 녹아 있는 수용액 형태이나, 일반적으로 가압하거나 냉동시켜 무수 액화 암모니아 형태로도 사용될 수 있다.
역사
고대 그리스 역사가 헤로도토스(Herodotus)의 기록에 리비아 지역의 지표에 노출된 염화 암모늄(NH₄Cl) 광맥 근처에 거주하며 이집트 주신 '아멘(Amun)'을 섬기던 '암모니안'에 대한 기술이 남아있으며, 이로부터 '암모니아'라는 이름이 유래되었다. 소변이 박테리아에 의해 발효(fermentation)되면 암모니아수가 생성되기에, 고대 그리스와 로마 시대 때부터 발효된 소변을 직물이나 옷의 세척액으로, 피혁이나 모피를 얻기 위해 가죽의 털 제거용으로, 염색된 직물에 매염제로, 철 제품의 녹 제거 등 다양한 용도로 썼다.
염화 암모늄 형태의 암모니아는 8세기 초 페르시아-아랍의 연금술사 하이얀(J. i. Hayyan)에 의해 처음으로 언급된 이후 13세기까지 유럽의 연금술사들에게 중요한 화학 물질로 사용되었다. 중세에는 발효된 소변을 식물에서 얻은 염료의 색상을 바꾸는 시약으로도 사용하였다. 1756년 영국의 화학자 블랙(J. Black)은 염화 암모늄과 산화 마그네슘(MgO)을 반응시켜 처음으로 기체 상태의 암모니아를 분리하였으며 그 후 1785년 프랑스의 화학자 베르톨레(C. L. Berthollet)에 의해 암모니아의 화학적 조성이 확인되었다.
2NH₄Cl(s) + MgO(s) → 2NH₃(g) + MgCl₂(aq) + H₂O(l)
공기 중의 질소를 이용하여 암모니아를 생산하는 하버-보슈 공정(Haber–Bosch process)은 1909년 독일의 화학자 하버(F. Haber)와 공업화학자 보슈(C. Bosch)에 의해 개발되었고 1910년 특허를 취득하였다. 20세기 철강 산업이 발전하면서 암모니아는 점결탄(coking coal)을 생산하기 위한 석탄 건류 과정의 부산물로 생산되었다.
성질
구조
암모니아의 분자 구조는 한 변이 1.63Å(0.163nm)인 정삼각형을 이루고 있는 3개의 수소 원자가 있고, 정삼각형의 중심으로부터 질소 원자가 0.38Å(0.038 nm)만큼 떠 있는 모양이다. 이러한 분자 구조를 삼각뿔형이라고 하며, 원자가껍질 전자쌍 반발(VSEPR) 이론을 통해 예측이 가능하다. 암모니아를 이루고 있는 질소 원자에는 비공유 전자쌍이 한 쌍 존재하는데, 이것으로 인해 암모니아는 양성자 받개, 즉 염기로 작용할 수 있다. 분자 구조로 말미암아 암모니아의 쌍극자 모멘트는 0이 아니게 되며, 따라서 암모니아는 극성 물질이 된다. N-H 결합의 길이는 1.014Å(0.1014 nm)이며 H-N-H의 결합각은 107°이다. 또한 암모니아는 수소 결합을 한다.
원자가 결합 이론으로 이 구조를 설명할 때 질소 원자는 sp³ 혼성 오비탈을 이루고 있다고 설명한다. 기본적으로 sp³ 혼성 오비탈을 이룰 경우 분자의 모양은 정사면체형이 되나, 암모니아의 경우 질소 원자의 하나의 s 오비탈과 3개의 p 오비탈이 혼성을 이루어 생성되는 4개의 sp³ 혼성 오비탈 중 하나는 비공유 전자쌍이 차지하고 있어서 이 비공유 전자쌍의 반발 효과로 인하여 H-N-H의 결합각이 완전한 정사면체 구조일 때의 109.5°보다 약간 줄어들게 된다.
삼각뿔의 꼭짓점이 있는 질소 원자는 터널 효과에 따라 수소 원자로 이루어진 삼각형의 밑면을 쉽게 빠져나갈 수 있다. 따라서 질소 원자의 안정적인 위치는 삼각뿔의 밑면을 기준으로 위아래 양쪽에 존재하며, 질소 원자가 두 위치를 이동할 때의 에너지 장벽이 크지 않기 때문에 질소 원자는 상하로 움직이는 공명을 하게 된다. 이 성질은 매우 정밀한 시계인 원자 시계에 이용된다
물리적 성질
암모니아는 표준 상태에서 특유의 자극적 냄새가 나는 무색의 기체로 존재한다. 밀도는 0.771g/l(리터당 그램)이며, 이는 공기의 0.5971배에 해당한다. 상온에서도 압축시키면 비교적 간단하게 액화시킬 수 있다. 쌍극자 모멘트는 1.48D이다. 녹는점은 -77.7℃, 끓는점은 -33.4℃, 임계 온도는 132.5℃이고, 임계 압력은 112.5atm이다. 생성열은 46.23kJ/mol(몰당 킬로줄), 융해열은 5.653kJ/mol, 기화열은 23.35kJ/mol이다.
암모니아는 물에 잘 녹는 물질이다. 용액의 어는점에서 암모니아는 질량 퍼센트로 약 45퍼센트까지 녹을 수 있으며 표준 상태에서 암모니아는 질량 퍼센트로 약 30퍼센트까지 녹을 수 있다. 용해도는 0℃의 물에 89.9g/100ml(100밀리리터당 그램), 20℃의 물에 52.0g/100ml, 96℃의 물에 7.4g/100ml이며 20℃의 에탄올에서의 용해도는 14.8g/100ml이다. 에테르에도 녹는다. 암모니아의 물리적 성질은 부분적으로 수소 결합에 영향을 받는다. 암모니아의 온도별 증기압은 다음과 같다.
온도 -33℃ 4.7℃ 20℃ 20℃ 50.1℃ 증기압력 1atm 5atm 8atm 10atm 20atm
화학적 성질
암모니아가 관여된 대부분의 반응은 크게 암모니아 [[첨가 반응], 암모니아 치환 반응, 산화·환원 반응으로 나눌 수 있다.
- 암모니아 첨가 반응
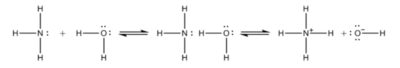
암모니아 첨가 반응은 암모니아 분자가 다른 분자 또는 이온에 공유 결합, 수소 결합 또는 이온-쌍극자 간의 전기적인 인력으로 인한 결합을 하게 되는 반응을 뜻한다. 가장 대표적인 것으로 암모니아와 물이 반응하여 암모니아수를 생성하는 반응을 들 수 있다. 반응식은 다음과 같다.
이 반응으로 인해서 암모니아는 물에 대해 비교적 높은 용해도를 가진다. 수화 암모니아(NH₃·H₂O)의 이온화 상수는 1.77×10⁻⁵이고, pKd는 4.75이다. 2NH₃·H₂O 형태의 분자도 발견되지만, NH₄OH 형태의 분자는 발견되지 않는다.
암모니아는 강산과 반응하여 암모늄염을 생성한다. 반응식은 다음과 같다.
4NH₃ + HX → NH₄⁺ + X ⁻
암모니아는 전이 금속에 배위되어 고차 화합물을 형성할 수 있다. Hg(NH₃)₂⁺, Cr(NH₃)₆³+, Zn(NH₃)₄²⁺, Co(NH₃)₆³⁺, Cu(NH₃)₄²⁺ 등이 대표적이다. 다음 반응식은 암모니아가 구리 이온에 배위되는 반응을 나타낸 것이다.
Cu²⁺ + 4NH₃ → [Cu(NH₃)₄]²⁺
암모니아가 전자쌍을 제공하는 루이스 염기로 작용하는 경우도 암모니아 첨가 반응이라고 할 수 있다. 암모니아가 삼산화 황, 이산화 황, 사플루오르화 규소, 삼플루오르화 붕소와 반응하는 경우를 예로 들 수 있다. 다음 반응식은 암모니아가 삼플루오르화 붕소와 반응하는 경우이다.
- 암모니아 치환 반응
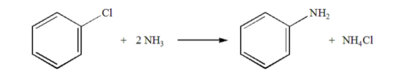
암모니아가 다른 원자 혹은 원자단을 치환하여 아미드기(-NH₂), 이미드기(=NH), 질화기(≡N)를 생성하는 반응을 암모니아 치환 반응이라 한다. 반응의 대표적인 예는 클로로벤젠과 암모니아가 반응하여 아닐린을 생성하는 것이 있다.
또는 염화 수은(II)과 반응하여 염소 원자를 NH₂로 치환하는 반응을 들 수 있다.
4HgCl₂ + 2NH₃ → Hg(NH ₂)Cl + NH₄Cl
- 산화·환원 반응
암모니아의 산화·환원 반응은 암모니아에 포함된 질소의 산화 상태가 바뀌는 반응과 수소가 해리되는 반응으로 나눌 수 있다. 전자의 예로는 다음과 같이 백금 촉매의 존재 하에 암모니아가 일산화 질소로 산화되는 반응을 들 수 있다.
4NH₃ + 5O₂ → 4NO + 6H₂O
촉매가 존재하지 않는다면 암모니아는 산소로 인하여 연소되어 질소와 물을 내놓는다. 이 과정에서 소량의 질산 암모늄, 이산화 질소 등이 생성되기도 한다.
4NH₃ + 3O₂ → 2N₂ + 6H₂O
암모니아는 할로젠과 반응하여 산화되어 질소를 내놓고, 생성된 할로젠화 수소는 다시 암모니아와 결합하여 염을 만든다. 암모니아가 염소로 산화될 경우의 반응식은 다음과 같다.
2NH₃+ 3Cl₂ → 2N₂ + 6HCl
HCl + NH₃ → NH₄Cl
앞의 반응에서 염소가 과잉으로 있다면 다음과 같은 반응이 추가적으로 진행되어 폭발성의 황색 기름인 삼염화 질소가 생성된다.
NH₄Cl + 3Cl₂ → NCl₃ + 4HCl
암모니아와 금속 산화물의 반응 역시 질소가 산화되는 반응이다. 다음은 암모니아가 산화 구리(II)와 반응하는 경우이다.
3CuO + 2NH₃ → 3Cu + 3H₂O + N₂
수소가 해리되는 반응의 예로는 금속과 암모니아의 반응을 들 수 있다. 반응성이 높은 금속과 암모니아가 반응하면 아마이드가 형성된다. 예를 들어, 암모니아와 나트륨이 반응하면 나트륨아마이드가 생성된다.
2NH₃+ 2Na → 2NaNH₂ + H₂
암모니아가 고온에서 마그네슘과 반응하는 경우 마그네슘이 암모니아의 모든 수소 원자를 치환하여 삼차 아마이드인 질화마그네슘을 만든다. 반응식은 다음과 같다.
2NH₃+ 3Mg → 3Mg₃N₂ + 3H₂
중요성
동영상
참고자료
같이 보기

 위키원
위키원