1차전지
1차전지(一次電池, primary cell)는 한번 방전해 버리면 충전해서 재사용 할 수 없는 전지이다. 즉 방전한 뒤 충전으로 본래의 상태로 되돌릴 수 없는 비가역적 화학반응을 하는 전지이다. 대표적 1차전지에는 망가니즈전지가 있으며 최근에는 알카라인전지가 많이 쓰인다. 보통 1.5V 정도의 전압을 내지만, 수십 V의 전압에 이르는 것도 있다.
| [타고] 1개월 단위로 전기차가 필요할 때! 타고 월렌트 서비스 |
목차
개요
전지는 전자의 산화환원반응을 이용하여 화학에너지를 전기에너지로 바꾸는 장치이다. 1차전지는 방전한 후 충전이 불가능한 일회용전지로 보통 건전지라고 한다. 1차전지에는 많은 종류가 있으나, 기본적으로 양극과 음극 그리고 전해질로 구성되어 있다. 음극은 이온화경향이 큰 금속을 사용하여 전자를 내어 놓는 산화반응이 일어나며, 양극은 이온화경향이 작은 금속을 사용하여 전자를 얻어 환원반응이 일어난다.
1차전지 & 2차전지
1차전지와 2차전지는 작동원리는 비슷하다. 배터리 내부의 구조와 사용된 소재가 다르다는 특징을 가지고 있다. 1차전지나 2차전지 모두 기본적으로 양극과 음극으로 구성되어 있는데 음극을 구성하는 물질 중 일부가 배터리 내부에서 양극으로 이동하며 외부로 연결된 회로에 전력을 공급하게 된다. 이때 음극에서 떨어져 나와 양극으로 이동한 물질이 양극을 구성하는 물질과 화학적으로 반응을 일으키게 된다.
이 반응에 의해 떨어져 나온 물질이 다시 양극과 분리되지 못하고 영구적으로 새로운 화학물질로 영구 고정된다면 충전이 불가능한 1차전지가 되고 양극으로 이동했던 물질이 다시 떨어져 나와 음극으로 돌아올 수 있다면 충전이 가능한 2차전지가 된다.
양극과 음극에 사용하는 물질은 여러가지 종류가 있다. 사용하는 물질의 종류에 따라 리튬전지, 망간전지, 알카라인전지 등 종류가 여러 종류로 나뉘게 된다. 이처럼 여러 가지 종류의 물질이 사용되는 이유는 배터리 성능을 다양하기 위함이다. 배터리에 따라 전압이 다른 다른 배터리가 필요하기도 하고 수명이 다양한 배터리가 필요하기도 하고 작동 온도나 작동 시간 등이 다양하게 필요하기 때문에 여러종류의 배터리가 개발된 것이다.
주요 종류
망가니즈전지
1차전지 중 가장 많이 쓰이는 전지이다. 1868년 프랑스의 조지 르클랑셰(George Leclanché)가 발명하였다. 망가니즈 전지는 음극이 아연(Zn)으로 이루어져 있고 망간과 산소가 결합한 이산화망가니즈(Mn0₂)로 구성되어 있다. 양극과 음극 사이에는 염화아연(ZnCI₂)이나 염화암모늄(NH₄CI)이 수용액 상태로 존재하게 된다. 배터리가 작동함에 따라 이들 소재간의 반응이 일어나며 음극과 양극이 수용액 내부로 녹아들며 성분비가 변형되는 특징을 가지고 있다. 배터리가 소진된 뒤에는 이러한 반응이 역으로 일어나지 않기 때문에 충전이 불가능하다.
망가니즈전지에서 일어나는 산화반응과 환원반응은 다음과 같다.
아래에서 이산화망가니즈 MnO₂는 양극에서 발생한 수소 기체 H₂가 수소 이온 H⁺로 산화되어 기전력을 떨어뜨리는 것을 방지하기 위한 감극제 역할을 한다.
(-)극: Zn → Zn ²⁺ + 2e⁻
- Zn ²⁺ + 4NH ₃ → Zn(NH ₃)₄ ²⁺
(+)극: 2H⁺ + 2e⁻ → H₂
- H₂ + 2MnO₂ → Mn₂O ₃ + H₂O
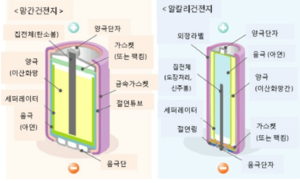
대표적 1차전지인 망가니즈전지는 르클랑셰 전지를 건전지화한 것이다. 아연통을 용기겸 음극으로 하며, 양극합제(陽極合劑)로 이산화망가니즈와 전기전도성의 탄소 가루(아세틸렌블랙, 흑연), 염화암모늄 가루의 3가지를 전해액(염화암모늄·염화아연이 주성분임)으로 굳혀 형성시킨 것이다. 그 중심에 탄소막대가 있다. 탄소막대와 덮개 사이에는 세퍼레이터와 전해액에 콘스타치와 밀가루를 섞어 겔화한 전해액층이 사이에 끼어 있다.
특성
셀 공칭전압은 1.5V(작동전압: 1.5 ~ 0.9V)이며, 최대 출력 가능한 전류는 1A 이하 수준이다. 방전 시 전압평탄성이 좋지 않은 편이며, 전지의 에너지 밀도는 100~190Wh/ℓ 수준이다. 저온에서 전지의 성능이 현저히 저하(-20℃ 이하에서는 전해액 동결)되고, 고온에서는 자기 방전의 촉진 및 전해액 건조에 의한 내부저항 증가 등의 현상이 발생하여 일반적으로 -10℃ ~ 45℃의 온도범위에서 사용하는 것이 좋다. 전지의 취급에 있어서 안전성은 우수한 편이나 전지의 충전, 단락, 화기에 투입하는 경우 등에 있어서 누액 및 파열 등의 현상이 발생할 수 있으며, 저온 또는 고온 저장시 전지의 성능을 열화시킬 수 있으므로 -10℃ ~ 25℃ 환경에서 저장하는 것이 좋다.
현황
세계적으로 상용시장에서 소형가전, 완구 등에 가장 많이 사용되는 전지 중 하나로 국내에서도 대량 생산되고 있어 일반 시중에서 쉽게 구매가 가능하다. 전지의 형태로는 다양한 크기의 원통형과 각형 전지가 있다.
알칼리(망간) 전지
알칼리전지(Alkaline Manganese Drycell)는 망가니즈건전지의 중성전해질 대신에 가성알칼리인 수산화칼륨(KOH) 용액을 이용한다. 양극으로는 이산화망가니즈와 흑연의 혼합체를 음극으로 아연을 사용한다. 망가니즈건전지보다 이산화망가니즈와 아연을 다량으로 넣어 성능이 좋고 수명이 길어서 연속적으로 큰 전류를 필요로 하는 헤드폰 스테레오나 카메라 스트로브에 많이 사용된다.
전지의 반응식은 아래와 같다.
- 양극: MnO₂ + H₂O + e⁻ → MnOOH + OH⁻
- 음극: Zn + 2OH⁻ → ZnO + H₂O + 2e⁻
특성
전압은 1.5V로 망가니즈전지와 동일하여 호환 사용이 가능하며, 전지 방전율은 망가니즈전지보다 높아 더 큰 부하조건에서도 사용할 수 있다. 전지의 에너지 밀도는 200~350Wh/ℓ 정도로 망간전지의 2배 수준이며, -20℃에서도 전해액이 동결되지 않으나 통상 -10℃~45℃ 온도범위에서 사용이 가능하다. 기타 취급 방법은 망간전지와 유사하다.
현황
사용되는 용도는 망간전지와 거의 동일하나, 망간전지보다 용량이 커 점차 망간전지를 대체해가고 있는 추세에 있다. 국내에서도 대량 생산되고 있으며 일반 시중에서 쉽게 구매가 가능하다. 전지의 형태로는 다양한 크기의 원통형과 각형 전지가 있다.
산화은전지
산화은 전지는 산화은 또는 과산화은(Ag2O 또는 AgO)을 양극 활물질로, 아연(Zn)을 음극 활물질로 하고 알칼리 금속 수산화물(KOH 또는 NaOH)의 수용액을 전해액으로 하는 전지이다. 산화은전지는 전압이 상당히 안정되어 있는 것이 특징이며, 수명이 다하는 직전까지 일정한 전압을 유지하기 때문에 카메라의 노출계, 수정시계와 같은 정밀전자기기에 많이 사용된다. 하지만 산화은전지는 가격이 비싸다는 단점이 있어 그에 비해 경제성이 뛰어난 알칼리버튼전지가 폭넓게 사용되고 있다. 반응식은 아래와 같다.
- 양극: Ag₂O + H₂O + 2e⁻ → 2Ag + 2OH⁻
- 음극: Zn + 2OH⁻ → Zn(OH)₂ + 2e⁻
- 전체: Ag₂O + Zn + H₂O → 2Ag + Zn(OH)₂
특성
초기에는 고출력 고에너지밀도의 특징을 살려 주로 군사용ㆍ우주용 2차 전지 및 비축전지로 주목을 받았으나 현재는 산화은(Ag2O)을 사용하는 단추형 또는 초박형 소형 1차 전지가 주로 실용화되어 있다. 과산화은(AgO)을 사용한 전지는 산화은을 사용한 전지보다 에너지 밀도를 2배 가까이 높일 수 있으나 과산화은의 알칼리성 전해액속에서 불안정한 특성으로 그 취급이 어렵고 소형 전지에서는 큰 에너지 밀도의 특징을 살리지 못하는 점이 있어 거의 실용화 되고 있지 않다. 산화은 전지의 주요 장점은 다음과 같다.
- 개로전압이 1.58V, 방전전압이 1.55V로 높으며 방전량에 의한 전압 변동이 적어 안정적임.
- 단위 중량 및 부피당 에너지 밀도가 큼.
- 사용 가능한 온도범위가 넓음 (-30℃ ~ 60℃)
- 중부하 방전용에 적합.
- 자기 방전율이 낮음 (5%/년 이하)
이러한 특징에 의해 단추형 산화은 전지는 시계, 카메라, 계산기, 완구, 의료기기 등의 소형 정밀 전지기기에 폭넓게 사용되고 있다.
현황
현재 국내에서 민수용으로 사용되는 소형 버튼형 산화은 전지를 제조하는 업체는 없으며 전량 수입에 의존하고 있다. 군용으로 사용되는 과산화은 전지의 경우 일부 셀 단위 국산화 개발이 완료되어 양산되고 있다.
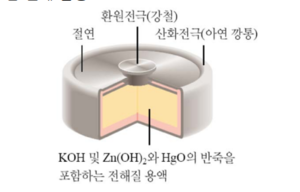
수은전지
수은전지는 산화수은을 양극 활물질로 사용하고, 수산화칼륨(KOH) 또는 수산화나트륨(NaOH) 수용액을 전해질로 사용하며, 아연(Zn)을 음극 활물질로 사용하는 전지이다. 수은전지는 사용 중 전압이 1.35V로 거의 일정하며 자체방전이 적어 제조 후 1년이 지나도 용량이 감소하지 않는 장점이 있다. 또한 소형으로 전기용량이 큰 것을 만들 수 있으며 고온에서도 사용이 가능하다. 최근에는 꾸준한 연구개발로 유해한 중금속으로 지목되어온 수은과 카드뮴이 사용되지 않은 환경친화적인 무수은전지, 무카드뮴전지가 생산되고 있다.
반응식은 아래와 같다.
- 양극: HgO + H₂O + 2e⁻ → Hg + 2OH⁻
- 음극: Zn + 2OH⁻ → ZnO + H₂O + 2e⁻
- 전체: Zn + HgO → ZnO + Hg
특성
안정된 작동 전압 특성(방전 전압의 평탄성)을 가지고 있어 미국에서는 군용 전지로 다량 생산된 적이 있으나 민수에서는 주로 소형(단추형) 전지로 주로 실용화 되었고, 특히 측정기기의 기준전압이나 카메라 노출계 및 보청기 등의 전원으로 많이 사용된 전지이다. 최근에는 수은의 환경에 미치는 영향이 문제가 되어 추가적인 개발이 중단된 상태이고, 보청기용 전지는 공기아연 전지로 카메라용 전지는 리튬전지로 많이 대체된 상태이다.
현황
현재 국내에서 수은 전지를 제조하는 업체는 없으며 전량 수입에 의존하고 있다.
공기아연전지
공기아연전지는 공기 중의 산소를 양극 활물질로 사용하고, 수산화칼륨(KOH) 또는 수산화나트륨(NaOH) 수용액을 전해질로 사용하며, 아연(Zn)을 음극 활물질로 사용하는 전지이다. 공기아연 전지는 양극에 공기 중의 산소를 사용하기 때문에 전지 내 음극에 다량의 아연을 채울 수가 있어 적은 크기로 대용량을 낼 수가 있어서 보청기나 포켓 벨 등에 사용되고 있다. 반응식은 아래와 같다.
- 양극: 1/2 O₂+ H₂O + 2e⁻ → 2OH
- 음극: Zn + 2OH⁻ → ZnO + H₂O + 2e⁻
- 전체: 1/2 O₂ + Zn → ZnO
특성
고 용량, 고 에너지 밀도 가진 전지로 수은전지에 비해 2배 가까운 방전 지속시간을 나타낸다. 공기전지의 보존특성은 밀폐상태와 개방상태에 현저한 차이가 있다. 즉, 밀폐상태에서 자기방전율은 연 2% 미만으로 우수하나, 사용을 위해 개방을 하고 나면 공기 중의 이산화탄소나 수증기의 유입으로 전지 성능이 열화되어 저장 가능 기간이 크게 단축되는 단점이 있다. 주로 보청기나 기타 의료기구용으로 많이 사용된다.
현황
현재 국내에서 공기아연 전지를 제조하는 업체는 없으며 전량 수입에 의존하고 있다.
리튬1차전지
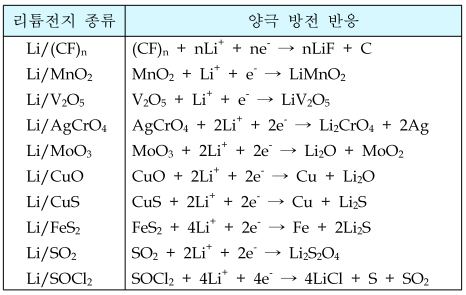
리튬전지는 금속 리튬을 음극활물질로 사용하고 비수전해액을 사용하여 3V 이상의 고전압이 가능하다. 소형이며 고에너지 밀도의 전지로서 저온 특성 및 장기 보존 성능이 우수한 전지이다. 사용하는 양극활물질의 종류, 전해질, 전극 및 전지형태에 따라 몇 종류로 구분되며 각각 작동전압, 사용 한계전류, 에너지 밀도, 동작온도, 보관수명, 안전성 등의 특성이 다르게 나타난다. 사용하는 양극활물질에 따라 Li/SOCl₂, Li/SO₂, Li/MnO₂, Li/(CF)ₙ 전지 등으로 나뉘어진다.
리튬1차전지는 1950년대 말에 들어 미국 NASA를 중심으로 우주 개발용 전원으로 연구되어온 고 에너지 밀도의 전지이다. 음극은 리튬(Li)을 사용하고, 전해액은 프로필렌 카보네이트 등의 유기 용매에 리튬염을 용해시켜 사용한다. 리튬전지는 양극 활물질로 사용되는 재료에 따라 여러 가지 종류가 있으며, 그 특성도 많은 차이가 있다. 실용화된 리튬전지 중 양극 활물질로 주로 사용되고 있는 것은 금속산화물, 황화물, 할로겐화물, 옥시할로겐화물 등이 있다. 리튬 1차 전지의 반응식은 아래와 같다.
- 음극: Li → Li+ + e⁻
- 양극: 표 참조
특성
높은 에너지 밀도(부피당, 중량당)를 가지고 있는 전지이며 사용되는 양극활물질에 따라 여러 가지 특성을 가지고 있다. 리튬 1차전지의 주요 특성은 아래와 같다.
- 리튬1차전지의 장점
- 고 전압(2.8V~3.8V)
- 고 에너지 밀도 (600 Wh/ℓ, 300 Wh/kg)
- 낮은 자기 방전율 (1~2% / 년)
- 방전 전압의 평탄성 우수
- 넓은 사용 온도범위 (-40℃ ~ 60℃)
- 리튬 1차 전지의 단점
- 안전성 문제 (리튬 금속의 강한 활성으로 인한 파열)
- 초기전압 지연 (전지 장기 저장 시 리튬 음극 표면에 부동태 피막 형성)
- 고가 (고가 원료 사용 및 생산 공정이 까다로움)
현재 군용전지로 주로 사용되는 고 전류용(스파이럴 형) Li/SO2 또는 Li/SOCl2 전지의 경우 각국에서 간헐적으로 파열사고가 발생하고 있는 경우가 있다. 민수용으로 많이 사용되는 Li/(CF)n, Li/MnO2 전지 등의 경우 안전성을 고려하여 소형 저 전류형으로 개발되어 한 번 장착 후 장기적인(반영구적인) 작동을 요하는 컴퓨터 메모리 백업용, 의료기기(페이스 메이커)용 등에 많이 활용되며, 일부 대용량이 요구되는 카메라 전지로 많이 사용되고 있다.
현황
현재 국내에서는 군사적 용도로 고 출력형(스파이럴 형) 리튬염화타이오닐(Li/SOCl2) 전지가 주로 제조되고 있으며(D형, AA형), 수출용으로 보빈형 전지도 제조되고 있다. 또 안전성이 높아 카메라 전지로 많이 사용되는 Li/MnO2 전지도 일부 시중에 제조 판매되고 있다.
양극활물질로 이산화망가니즈를 사용한 코인형리튬전지는 전자수첩, IC카드, 완구, 계측기 등과 같이 안정된 성능과 저출력이 요구되는 전자기기에 사용된다. 양극활물질로 SO2를 사용한 전지는 주로 군수용으로 사용되고 있다.
리튬전지는 용도에 따라 원통형, 핀형, 페이퍼형, 각형과 같이 여러 형상으로 만들 수 있어 사용범위가 넓다. 원통형리튬전지는 컴퓨터의 메모리 백업(기억유지기능)용, 휴대폰 등 고출력이 요구되는 전자기기 전원으로 많이 사용되고 있으며 5~10년간 사용이 가능하다. 핀형리튬전지는 야간 낚시용 전기찌의 전원으로 사용되며, 페이퍼형리튬전지는 얇은 메모리 카드나 IC 카드 등에 사용된다.
이밖에도 망가니즈건전지의 음극을 아연 대신 마그네슘으로 한 마그네슘건전지가 있다.
1차전지가 필요한 이유
1차전지가 도대체 왜 필요한지 궁금할수도 있다. 충전과 방전을 반복하며 오래 사용할 수 있는 2차전지가 뻔히 있는데 왜 굳이 한번밖에 쓸수 없는 1차전지를 사용할까?
가장 큰 이유는 바로 성능과 가격때문이다. 1차전지는 양극과 음극에 사용하는 물질의 종류에 따라 매우 다양한 성능을 갖는 배터리를 제조할 수 있다. 이에 반해 2차전지는 소재의 종류가 매우 한정적이고 그러다보니 성능도 매우 제한적이다. 특히 우리가 일반적으로 사용하는 2차전지는 방전속도가 빠르고 수명이 짧다는 단점을 가지고 있다. 핸드폰 배터리를 생각해보면 배터리를 전혀 사용하지 않아도 수 일이 지나면 배터리가 일부 방전이 되어 있다. 또한 1년 정도 사용하면 배터리의 수명이 급격히 짧아지며 핸드폰이 예전보다 일찍 꺼져버리기도 한다.
이에 반해 1차전지는 수명이 매우 길고 용량이 2차전지에 비해 매우 커 10년동안 사용할 수 있거나 고온이나 저온 또는 습환 환경에서 사용해도 안정성이 훨씬 높거나 저렴한 가격에도 불구하고 1년 내내 작동하는 등의 장점을 갖고 있다. 무선 마우스 등에 사용하는 건전지만 살펴봐도 알카바와 같은 1회용 건전지는 불과 천원대로 매우 저렴하다. 게다가 마우스에 건전지를 끼워 넣으면 마우스에 따라 1~3년까지도 사용할 수 있다. 하지만 에네루프와 같은 2차전지 기반의 충전지를 사용하면 가격도 20배 가까이 비싸고 지속시간도 알카바보다 다소 짧다.
성능과 가격외에도 중요한 이유는 배터리가 사용되는 일부 영역에서는 배터리를 갈아 끼울수 없는 환경인 영역도 있다. 대표적으로는 라디오존데가 있다. 라디오존데는 열기구를 띄워 올려 고도에 따라 기상 환경을 측정하는 장비이다. 하늘로 올라간 뒤 다시 회수되지 않고 영구적으로 버려지기 때문에 굳이 가격이 비싼 2차전지를 탑재할 필요가 없으며 더욱이 고도가 높아질수록 매우 추워지므로 저온에서도 원활히 작동할 수 있는 배터리가 필요하다.
이 외에도 석유시추설비나 송유관 같은 곳에 설치된 계측기용 배터리에는 고온의 환경에 설치되거나 배터리 교체없이 장시간의 모니터링을 필요로 하기 때문에 리튬1차전지가 제격이다. 실제로 시추설비 시장은 리튬1차전지의 큰 전방시장으로 시추설비 등 한정된 산업영역에 배터리를 전문적으로 공급하는 Electrochem과 같은 리튬1차전지 전문기업도 있다.
이처럼 1차전지는 자주 충전이 필요한 영역에서는 사용될 수 없지만 2차전지가 사용되기 어려운 니치 마켓에서 매우 활발히 사용되고 있다. 이러한 니치 마켓은 대부분 제품의 안정성이 중요해 폐쇄적인 구조를 가지면서도 꾸준이 안정적으로 규모가 확대되는 특징을 가지고 있다. [1]
관련기업
비츠로셀
비츠로셀은 리튬1차전지의 제조를 주력 사업으로 영위하는 코스닥 상장사이다. 1987년에 테크라프로라는 이름으로 설립되었으며 다음해 미국의 기업을 통해 리튬1차전지 제조 기술 제휴를 맺어 리튬1차전지 제조사업을 본격적으로 시작했다. 1991년에는 자체적으로 개발한 양산설비를 통해 리튬1차전지의 제조 기술실력을 향상시키게 되었고 이후 군사용 배터리 납품, 민간용 배터리 시장의 확대로 국내 1위의 리튬전지 업체로 자리잡게 되었다.
비츠로셀이 제조하는 리튬 1차전지는 2차 전지와는 달리 비충전 방식의 전지다. 휴대폰·전기자동차용 배터리 같이 충전 가능한 2차전지와 달리 1차 전지는 충전이 되지 않지만 방전율이 연간 1% 수준이라 10년 이상 사용할 수 있고 배터리 용량 또한 5배 이상 크다. 일례로 스마트 그리드 장비에 들어가는 배터리 수명만 15~20년 정도에 이른다. 뿐만 아니라 리튬 1차전지는 극한 환경에서 사용해야 하는 석유·가스 등 에너지 시추장비용 고온 전지나 군사용 장비에도 필수적으로 쓰인다.
비츠로셀은 업무의 특수성상 배터리를 자주 교체 해줄수없는 특수 사업군들(군용, 특수발전용, 시추선, 스마트계량기)에 이 산업용 1차전지를 납품하고 있습니다. 그중에서도 스마트미터기(계량기) 부분에 큰 경쟁력을 가지고 있으며 글로벌 1위이다.
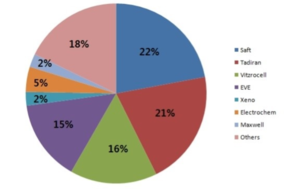
샤프트 & 타디란
샤프트(Saft)와 타디란(Tadiran)은 각각 글로벌 M/S 1위와 2위를 차지하고 있었는데, 두 회사가 합병하며 산업용 1차전지 시장 M/S를 50% 가까이 차지하는 공룡기업이 탄생하였다.
EVE에너지
중국의 EVE에너지는 관세철벽으로 보호받아 중국시장을 독점하고 있다. 2003년부터 염화 티오닐 리튬 배터리 개발에 진입하였으며 2년 뒤인 2005년에 배터리 재료성분, 구조, 패키징, 내열온도변화 등의 문제를 해결하고 그 뒤에 프랑스 배터리업체 SAFT와 같은 국제 리튬 배터리 거물들이 독점하고 있던 시장에 진출하였으며 2008년에 중국 정부의 스마트그리드(Smart grid) 구축에 힘 입어 중국 스마트미터 시장 80%를 점유하게 되었으며 중국에서 가장 규모가 크고 전 세계 5순위에 있는 염화티오닐 리튬 배터리 업체로 되었다.
2010년에 스퀘어 타입 소프트 팩 리튬 배터리와 실린더 타입 리튬 배터리를 개발완료하고 컨슈머전자 리튬 배터리 시장에 진출하였으며 후에 전자담배와 웨어러블 디바이스 등 세분화 시장의 리딩 업체로 성장하였다.
2차전지 배터리도 생산하고있다.
주의사항
전지를 안전하게 사용하기 위해서는 전지를 장착할 때 양극과 음극을 확인하여 역접속이 되지 않도록 주의해야 하며, 종류가 다른 전지는 같이 사용하지 않는 것이 좋다. 전해질용액이 샐 염려가 있으므로 전지 표면의 비닐을 벗기거나 흠집을 내어서는 안되며, 전해질용액이 눈에 들어가면 바로 물로 씻어 낸다. 다 쓴 후에는 전지를 불 속에 넣지 않도록 하며, 전지에 적혀 있는 지시에 따라 여러 가지 주의를 하면서 버려야 한다.
각주
- ↑ hodolry, 〈2차전지 산업을 쉽게 이해하자 (1편)〉, 《네이버블로그》, 2020-11-02
참고자료
- 〈1차전지〉, 《두산백과》
- 전지 및 발전기 표준화 방안 연구(국방기술품질원) - file:///C:/Users/sms/Downloads/GOV_2014_PRISM_000344.pdf
같이 보기

 위키원
위키원