리튬이온 배터리
리튬이온 배터리(Lithium-ion battery, Li-ion battery, 锂离子电池)는 2차전지의 일종으로 방전 과정에서 리튬이온이 음극에서 양극으로 이동하는 전지이다. 충전시에는 리튬 이온이 양극에서 음극으로 다시 이동하여 제자리를 찾게 된다. 리튬이온 배터리는 충전 및 재사용이 불가능한 1차전지인 리튬 전지와는 다르며, 전해질로서 고체 폴리머를 이용하는 리튬 이온 폴리머 전지와도 다르다.
리튬이온 배터리는 에너지 밀도가 높고 기억 효과가 없으며, 사용하지 않을 때에도 자가방전이 일어나는 정도가 작기 때문에 시중의 휴대용 전자 기기들에 많이 사용되고 있다. 이 외에도 에너지밀도가 높은 특성을 이용하여 방산업이나 자동화시스템, 그리고 항공산업 분야에서도 점점 그 사용 빈도가 증가하는 추세이다. 그러나 일반적인 리튬이온 배터리는 잘못 사용하게 되면 폭발할 염려가 있으므로 주의해야 한다.
리튬이온 배터리는 크게 양극, 음극, 전해질의 세 부분으로 나눌 수 있는데, 다양한 종류의 물질들이 이용될 수 있다. 상업적으로 가장 많이 이용되는 음극 재질은 흑연이다. 양극에는 층상의 리튬코발트산화물(lithium cobalt oxide)과 같은 산화물, 인산철리튬(lithium iron phosphate, LiFePO4)과 같은 폴리음이온, 리튬망간 산화물, 스피넬 등이 쓰이며, 초기에는 이황화티탄(TiS2)도 쓰였다. 음극, 양극과 전해질로 어떤 물질을 사용하느냐에 따라 전지의 전압과 수명, 용량, 안정성 등이 크게 바뀔 수 있다. 최근에는 나노기술을 응용한 제작으로 전지의 성능을 높이고 있다.
전지의 용량은 mAh(밀리암페어시) 또는 Ah(암페어시)로 표시하는데, 휴대폰에 사용하는 전지는 3000~4000mAh가 가장 많이 쓰이며, 스마트폰에는 1500~5000mAh도 사용된다. 노트북에 사용되는 전지는 2400~5500mAh가 가장 많이 사용된다.
목차
개요[편집]
리튬이온 배터리는 재충전 가능 배터리의 일종이다. 리튬이온배터리는 휴대용 전자제품과 전기자동차에 흔히 사용되며 군사 및 항공우주 분야에 대한 인기가 높아지고 있다. 1985년 요시노 아키라(Akira Yoshino)가 리튬 이온 전지를 개발한 것은 1970년대부터 1980년대까지 존 구디너프(John Goodenough), 스탠리 휘팅엄(M. Stanley Whittham), 라시드 야자미(Rachid Yazami)와 미즈시마 고이치(水島公一)의 초기 연구를 바탕으로 했으며 이후 소니와 아사히에서 리튬이온 전지 상용화에 성공했다.
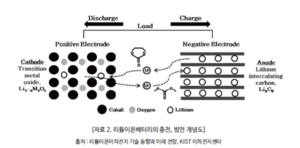
배터리에서 리튬이온은 방전 중에 음극 전극에서 전해질을 통해 양극 전극으로 이동하고 충전할 때 되돌아 간다. 리튬이온 배터리는 양극재로 리튬 화홥물을 사용하며, 음극재로 일반적으로 흑연을 사용한다. 배터리는 에너지 밀도가 높고 메모리 효과 없으며(LFP 제외) 자가 방전이 약하다. 하지만 가연성 전해질이 함유되어 있어 안전상 위험요소가 될 수 있으며, 손상되거나 잘못 충전되면 폭발과 화재를 초래할 수 있다. 삼성전자는 리튬이온 화재 이후 갤럭시노트7 단말기를 리콜할 수 밖에 없었고, 보잉 787기에서도 배터리 관련 사고가 여러 차례 발생했다.
리튬 이온 배터리의 연구 영역에는 수명 연장, 에너지 밀도 증가, 안전성 향상, 비용 절감, 충전 속도 증가 등이 포함된다. 대표적인 전해질에 사용되는 유기용제의 인화성과 변동성을 기반으로 안전성을 높이기 위한 경로로 비인화성 전해액 영역에서 연구가 진행되고 있다. 전략으로는 수용성 리튬이온 배터리, 세라믹 고체 전해질, 폴리머 전해질, 이온 액체, 불소화 시스템 등이 있다.
역사[편집]
리튬이온 배터리는 미국 뉴욕 빙엄턴 대학교의 스탠리 휘팅엄(Stanley Whittingham) 교수와 엑슨에 의해 1970년대에 처음 제안되었다. 휘팅엄 교수는 이황화티탄을 양극으로, 금속 리튬을 음극으로 사용하였다. 이후 1980년에 라시드 야자미를 필두로 하는 그르노블 공과대학(INPG)과 프랑스 국립 과학 연구센터의 연구진에 의해 흑연 내에 삽입된 리튬 원소의 전기화학적 성질이 밝혀졌다. 그들은 리튬과 폴리머 전해질, 흑연으로 이루어진 반쪽 전지 구조에 대한 실험을 통하여 흑연에 리튬 원소가 가역적으로 삽입됨을 밝혀냈고, 1982년과 1983년에 해당 연구 내용이 출판되었다. 이 연구는 리튬의 흑연 내 가역적 삽입에 관해 열역학적인 내용과 이온 확산에 관련된 동역학적인 내용을 모두 포함하고 있다.
기존의 리튬 전지는 음극이 금속 리튬으로 이루어져 있었고, 그 때문에 안전성이 낮았다. 따라서 리튬이온 배터리는는 금속의 리튬 덩어리가 아니라 리튬 이온을 포함하는 물질을 음극과 양극으로 사용하는 방향으로 개발되었다. 1981년 벨 연구소에서는 리튬 전지에 금속 리튬 대신 사용 가능한 흑연 음극을 개발하여 특허를 획득하였다. 그 후 존 구디너프가 이끄는 연구팀이 새로운 양극을 개발함으로써 비로소 1991년 소니에 의해 최초의 상업적 리튬 이온 전지가 출시되었다. 당시의 배터리는 층상 구조의 산화물(리튬코발트산화물)을 이용하였으며, 당시 가전제품 분야에 혁명을 일으켰다.
1983년 태커레이(Michael Thackeray)와 구디너프 등이 망간으로 이루어진 스피넬을 양극 물질로 사용할 수 있음을 발견하였다. 스피넬은 가격이 싸고 전기전도도와 리튬 이온 전도도가 우수하며 구조적으로 안정적이기 때문에 매우 각광받았다. 비록 순수한 망간으로 이루어진 스피넬은 반복되는 사용으로 인해 성능이 저하되지만, 이러한 점은 스피넬을 구성하는 화학 원소에 변화를 줌으로써 해결할 수 있다. 망간 스피넬은 오늘날 상업적인 리튬 이온 전지들에 사용되고 있다. 그리고 1985년에 도시바의 미즈시마 고이치(水島公一)는 최초로 리튬이온 전지의 정극 재료를 개발하였다. 이 성과를 살려, 같은 해 아사히 카세이의 요시노 아키라가 현재 쓰이는 리튬 이온 전지에 가까운 원형을 만들어내었다.
1989년 텍사스 대학교 오스틴의 만티람(Arumugam Manthiram)과 구디너프는 폴리음이온을 함유하는 양극이 유도 효과를 갖기 때문에 산화물을 사용하는 양극보다 더 높은 전압을 낼 수 있음을 발견하였다. 이를 바탕으로 1990년말 소니의 니시 요시오(西美緒)는 처음으로 리튬 이온 전지의 개발에 성공했고, 이듬해 1991년 소니는 리튬 이온 전지를 대량생산하여 상용화했다.
1996년 파디(Akshaya Padhi), 구디너프 등은 인산철리튬과 감람석 결정구조를 갖는 인산금속계 리튬을 리튬 이온 배터리의 양극 물질로 사용할 수 있음을 발견했다. 인산철리튬은 여느 양극 물질과 비교해도 저렴한 가격과 뛰어난 안전성, 성능, 그리고 안정적인 작동 성능을 보였다. 또한 인산철리튬은 전기 자동차에 사용되는 거대한 전지와 같이 안전성을 요구하는 에너지 저장 장치로서 적합하다. 인산철리튬은 오늘날 노트북 컴퓨터와 같은 휴대용 전자기기 등에 널리 사용되고 있다.
2002년 MIT의 치앙(Yet-Ming Chiang)과 그 연구팀은 전극에 알루미늄이나 니오브, 또는 지르코늄을 도핑함으로써 전기전도도를 크게 증가시켜 리튬이온 배터리의 성능을 극대화할 수 있다는 것을 발견하였다. 그러나 이 도핑 처리에 의해 성능이 향상되는 원리가 실제로 어떻게 되는지에 대해서는 많은 논쟁이 있다.
2004년 치앙의 연구팀은 또 다른 기술을 개발하는데, 100나노미터의 지름을 갖는 인산철 입자를 전극에 도핑하는 것이다. 이를 통하여 밀도가 100분의 1 이하로 감소하였고 전극의 표면적과 전지의 용량이 증가하는 효과를 얻었다. 인산철을 이용하는 기술의 상업화는 치열한 시장 경쟁을 낳았고, 또한 치앙과 구니너프 간의 특허 침해 분쟁을 야기했다.
2005년 Y Song, PY Zavalij 및 스탠리 휘팅엄은 높은 에너지 밀도를 갖는 새로운 2전자 바나듐 인산염 양극 물질을 발표했다.
2011년 아르곤국립연구소(Argonne National Laboratory)에서 개발된 리튬 니켈 망간 코발트 산화물(NMC) 캐소드는 오하이오 주 BASF에서 상업적으로 제조되었다. 리튬이온 배터리는 일본에서 모든 휴대용 보조(즉, 충전 가능) 배터리 판매의 66%를 차지했다.
2012년 존 구디너프, 라시드 야자미, 요시노 아키라는 리튬이온 배터리 개발로 2012 IEEE 환경 및 안전 기술 훈장을 받았다.
2014년 존 구디너프, 요시오 니시(Yoshio Nishi), 라시드 야자미, 요시노 아키라는 이 분야에서 선구적인 노력으로 국립공학 아카데이미의 찰스 스타크 드레이퍼상( Charles Stark Drape)을 수상하였다. 앰프리우스(Amprius Corporation)의 상용 배터리는 실리콘 양극재를 사용하여 650Wh/L(20% 증가)에 도달하여 고객에게 공급되었다.
2016년 미즈시마 고이치와 요시노 아키라는 리튬이온 배터리용 LiCoO2 양극재 발견과 요시노의 리튬이온 배터리 개발로 국립재료과학연구소(NIMS)로부터 NIMS 어워드를 수상했다. Z Qi와 Gary Koenig는 템플릿 기반 접근 방식을 사용하여 서브 마이크로미터 크기의 LiCoO₂를 생성하는 확장 가능한 방법을 보고했다.
2019년 "리튬이온 배터리 개발"로 존 구디너프, 스탠리 휘팅엄, 요시노 아키라에게 노벨 화학상이 공동 수여되었다.
4대 구성 요소[편집]
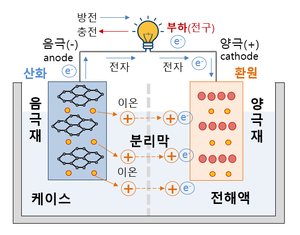
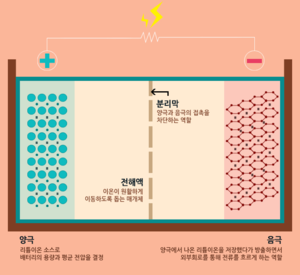
리튬이온 배터리의 4대 구성요소 양극, 음극, 전해액, 분리막이다.
양극[편집]
리튬이온 배터리의 용량과 전압을 결정하는 양극이다. 리튬이온 배터리는 리튬의 화학적 반응으로 전기를 생산하는 배터리이다. 그래서 당연히 리튬이 들어가게 되는데 그 공간이 바로 '양극'이다. 하지만 리튬은 원소 상태에서는 반응이 불안정해서 리튬과 산소가 만난 리튬산화물이 양극에 사용된다. 리튬산화물처럼 양극에서 실제 배터리의 전극 반응에 관여하는 물질을 '활물질'이라고 부른다. 즉, 리튬이온 배터리의 양극에서는 리튬산화물이 활물질로 사용된다.
양극을 조금 더 자세히 살펴보면, 양극의 틀을 잡아주는 얇은 알루미늄 기재에 활물질과 도전재 그리고 바인더가 섞인 합제가 입혀져 있다. 활물질은 리튬이온을 포함하고 있는 물질이고, 도전재는 리튬산화물의 전도성을 높이기 위해서 넣고, 바인더는 알루미늄기재에 활물질과 도전재가 잘 정착할 수 있도록 도와주는 일종의 접착 역할을 한다. 이렇게 만들어진 양극은 배터리의 특성을 결정짓는 중요한 역할을 한다. 어떤 양극활물질을 사용했느냐에 따라 배터리의 용량과 전압이 결정된다. 리튬을 많이 포함했다면 용량이 커지게 되고, 음극과 양극의 전위차가 크면 전압이 커진다. 일반적으로 음극은 종류에 따라 전위의 차이가 작은데 반해 양극은 상대적으로 차이가 크기 때문에 양극이 배터리 전압을 결정짓는 데 중요한 역할을 한다.
리튬이차전지는 양극과 음극사이에 리튬이온의 이동으로 충전과 방전이 수백 회 이상 반복되며 이 전지를 구성하는 핵심 부품소재 가운데 원가 비중이 35%로 가장 높고 성능에 영향을 많이 주는 것이 양극재이며 이차전지를 생산하는데 가장 핵심 재료로 구성하는 재료에 따라 LCO(리튬코발트), NCM(리튬니켈코발트망간), NCA(리튬니켈코발트알루미늄), LMO(리튬망간), LFP(리튬철인) 등으로 구성되어 있으며 가장 대표적인 소재는 코발트, 니켈, 망간 등이 있다.
음극[편집]
전자를 도선으로 내보내는 음극이다. 음극 역시 양극처럼 음극 기재에 활물질이 입혀진 형태로 이루어져 있다. 음극 활물질은 양극에서 나온 리튬이온을 가역적으로 흡수/방출하면서 외부회로를 통해 전류를 흐르게 하는 역할을 수행한다. 배터리가 충전상태일 때 리튬 이온은 양극이 아닌 음극에 존재한다. 이 때 양극과 음극을 도선으로 이어주면(방전) 리튬 이온은 자연스럽게 전해액을 통해 다시 양극으로 이동하게 되고, 리튬이온과 분리된 전자(e-)는 도선을 따라 이동하면서 전기를 발생한다. 음극은 구리 기재 위에 활물질, 도전재, 바인더가 입혀진다.
음극활물질이란 산화시 전자를 방출하는 소재로 리튬이온전지 재료의 10% 정도를 차지하며, 초기 리튬금속전지에서는 리튬을 직접 활용하였지만 위험성 등의 문제로 다른 물질로 대체되었다. 리튬 금속을 대체할 음극재료가 갖추어야 할 요건들은 다음과 같다. [금속 리튬의 전극전위에 근접한 전위를 가져야 하며, 부피당 무게당 에너지 밀도가 높아야 한다. 뛰어난 충방전 안전성을 가지며 고속 충방전에 견딜 수 있어야 한다.
음극재는 양극재와 함께 전기를 생산하는 주요 재료이나 비중은 약 10%로 양극재에 비해서 상대적으로 재료비에서 차지하는 비중은 낮지만 연간 평균 15~30% 사이의 성장률로 2025년 음극재시장규모는 76억달러까지 성장할 것으로 예상되며 이는 현재 시장규모의 4배 이상이 될 전망이다.
음극재의 에너지 밀도 개선을 위해서 전극재료의 변경, 도포 기술의 향상, 전극 Packing 기술의 향상, 음극의 충방전 효율 향상 등이 있으나 전극재료의 변경을 제외한 수단은 이미 한계에 이른 것으로 판단되고 있다.
사실 더 오래 가고 빨리 충전되는 배터리를 만들려면 전극의 성능이 좋아야 한다. 현재 리튬이온배터리의 경우 음극재로 흑연이 널리 쓰이고 있다. 흔하고 싼 재료인데다 층상 구조라 틈새에 리튬이온이 쉽게 들어갔다가(충전) 나올 수 있고(방전), 이 과정이 반복돼도 안정적이기 때문이다. 다만 에너지 밀도가 높지 않고 충전 속도도 빠르지 않다.
이 약점을 극복하기 위해 유니스트의 조재필 교수 연구팀은 먼저 흑연의 가장자리를 살짝 부식시켜 리튬이온이 좀 더 쉽게 드나들 수 있게 하고, 여기에 실리콘 나노층을 입혀 에너지 밀도를 높였다. 그 결과 기존 흑연 음극에 비해 충전 시간과 속도가 모두 개선된 음극 소재를 개발하는 등 효과적인 전극재료의 변경을 위한 연구들이 진행중이다.
전해액[편집]
전해액은 이온만 이동시킨다. 리튬 이온은 전해액을 통해 이동하고, 전자는 도선을 통해 이동한다. 이온은 전해액으로 이동하고, 전자는 도선으로 이동하게 하는 것이 배터리에서 전기를 사용할 수 있는 가장 중요한 포인트이다. 만약 전자가 도선이 아니라 전해액을 통해 이동하게 되면 전기를 사용할 수 없는 것은 물론이고, 안전성까지 위협 받게 된다. 전해액이 바로 그 역할을 수행하는 구성요소이다. 양극과 음극 사이에서 리튬 이온을 이동할 수 있도록 하는 매개체인 셈이다. 전해액은 리튬이온을 잘 이동시킬 수 있도록 이온 전도도가 높은 물질이 주로 사용된다. 전해액은 염, 용매, 첨가제로 구성되어 있다. 염은 리튬이온이 지나갈 수 있는 이동 통로, 용매는 염을 용해시키기 위해 사용되는 유기 액체, 첨가제는 특정 목적을 위해 소량으로 첨가되는 물질이다. 이렇게 만들어진 전해액은 이온들만 전극으로 이동시키고, 전자는 통과하지 못하게 한다. 전해액의 종류에 따라 리튬이온의 움직임이 둔해지기도, 빨라지기도 한다. 그래서 전해액은 까다로운 조건들을 만족해야만 사용 가능하다.
분리막[편집]
양극과 음극을 분리하는 절대장벽이다. 양극과 음극이 배터리의 기본 성능을 결정한다면 전해액과 분리막은 배터리의 안전성을 결정짓는 구성요소라고 할 수 있다. 분리막은 양극과 음극이 서로 섞이지 않도록 물리적으로 막아주는 역할을 담당하고 있다. 전자가 전해액을 통해 직접 흐르지 않도록 하고, 내부의 미세한 구멍을 통해 원하는 이온만 이동할 수 있게 만든다. 즉, 물리적인 조건과 전기 화학적인 조건을 모두 충족시킬 수 있어야 한다. 현재 상용화된 분리막으로는 폴리에틸렌(PE), 폴리프로필렌(PP)와 같은 합성수지가 있다. [1] [2]
기본원리[편집]
기본적인 이차전지의 기본 원리는 전기 화학적 산화-환원 반응에 의해 발생하는 이온의 이동으로 전기를 발생시키고 그 반대 과정으로 충전되는 원리이다. 이온의 물질 상태가 양극과 음극에서 서로 달라 이때 발생되는물질의 고유에너지 차이로 인한 전압차를 이용하는데 리튬이온전지의 경우 양극에 있던 리튬이온이 빠져 나와 전해질을 통해 음극의 가는 충전과 그 반대인 방전이 일어난다.
리튬이차전지는 가역적으로 리튬이온의 삽입 및 탈리가 가능한 물질을 양극 및 음극으로 사용하고 상기 양극과 음극 사이에 유기 전해액 또는 고분자 전해액을 넣어 리튬이온의 원활한 이동을 가능하게 하며, 양극 및 음극에서 삽입/탈리 될 때 일어나는 전기화학적 산화, 환원반응에 의하여 발생하는 전자가 전기에너지를 생성한다.
리튬 이온 전지의 충전 과정은 크게 두 단계로 이루어진다.
- 정전류 과정: 충전기가 일정 전류를 유지하도록 전압을 점차적으로 올려가면서, 한계전압에 이를 때까지 전류를 공급하는 과정이다.
- 정전압 과정: 전지가 한계전압에 이르면 일정 전압을 유지하면서 전류가 문턱값보다 낮아질 때까지 전류를 공급하는 과정이다. 보통 문턱 전류값은 초기 전류값의 약 3% 정도이다.
전지가 다중 셀로 구성되어 있는 경우, 등전류 과정과 등전압 과정 사이에 각 셀이 모두 동일한 전압값을 갖도록 조정하는 과정이 추가된다.
보통 리튬 이온 전지는 셀당 4.2 ± 0.05 V 정도의 전압으로 충전되고, 전지 수명이 중요한 군용 전지는 3.92 V를 이용한다. 전지의 보호회로는 입력 전압이 4.3V이상이면 입력을 차단한다. 배터리의 전압이 셀 당 2.5V 이하로 내려가면 보호회로가 정지되므로 일반 충전기로는 더 이상 충전을 할 수 없다. 대부분의 전지는 셀당 2.7-3V 정도에서 작동을 정지한다.
모양에 따른 분류[편집]
리튬이온전지는 제조 형상에 따라 원통형, 각형, 파우치형(pouch)으로 구분할 수 있다. 오랜 개발 역사를 지닌 원통형 구조는 생산 비용이 낮지만, 에너지량이 제한적이고 잦은 충방전 시에는 전지의 성능 저하가 높은 단점이 있다. 사각형 알루미늄 캔에 전지를 담은 형태로 제작되는 각형은 뛰어난 내구성을 가진다. 그러나 알루미늄 캔 사용으로 무거우며 열방출에 어려움이 있어 냉각을 위한 비용이 높다. 비교적 최근에 개발된 파우치형은 전지 구성물을 알루미늄포일에 두른 형태로 제작된다. 파우치형은 얇은 두께로 단위부피당 효율이 높으며 다양한 형상으로 제작이 가능하다. 그러나 제작 비용이 다른 두 가지 형상에 비해 높다.[3]
리튬이온 배터리 종류[편집]
리튬 코발트 배터리 (LCO)[편집]
리튬 코발트 배터리(LCO)는 최초로 개발된 리튬이온 배터리이다. 가격이 비싼 코발트를 주로 사용한다. 일본의 소니, 파나소닉등의 업체들이 개발했다. 리튬이온 배터리에서 산화 및 환원 반응을 일으키는 원소는 리튬이 아니라 코발트(27Co)이다. 코발트(27Co, cobalt)는 배터리의 안정성을 높여주는 필수 원소이다. (LixCoO2). :*코발트는 가격이 비싸고(1톤당 3,500~4,000만원), 전 세계 생산량의 60% 이상을 담당하는 아프리카 콩고민주공화국에서 내전이 발생하여 공급이 불안정하며, 코발트 광산의 아동노동 문제로 논란이 되고 있다.
리튬 하이니켈 배터리[편집]
리튬 하이니켈 배터리(NCM, NCA)는 가격이 비싼 코발트 대신 니켈을 주로 사용하는 배터리이다. 대한민국의 엘지에너지솔루션, 삼성SDI, 에스케이온㈜(SK on) 등이 개발했다. 리튬 하이니켈 배터리는 가격이 비싼 코발트 대신 상대적으로 가격이 저렴하면서도 성능은 뛰어난 니켈(nickel)을 사용하는 하이니켈(high nickel) 배터리이다. 니켈은 주로 코발트와 함께 생산되는데, 가격이 1톤당 1,500~1,700만원 정도로 상대적으로 낮은 편이다.
- NCM 배터리 = 니켈 + 코발트 + 망가니즈를 사용하는 3원계 배터리이다. 분자식은 LiNiMnCoO2 이다. 'NMC 배터리'라고도 한다.
- 니켈 함량을 높인 다양한 비율의 하이니켈 배터리를 사용한다.( NCM523, NCM622, NCM712, NCM811, NCM9½½ 등)
- 알루미늄(13Al)을 사용한 NCA 및 NCMA 배터리가 확산되고 있다.
- - NCA (3원계) : 니켈 + 코발트 + 알루미늄 (LiNiCoAlO2)
- - NCMA (4원계) : 니켈 + 코발트 + 망가니즈 + 알루미늄
리튬 인산철 배터리[편집]
리튬 인산철 배터리(LFP)는 가격이 비싼 코발트나 니켈 대신 가격이 아주 저렴한 인산철을 사용한 배터리이다. 에너지 밀도가 낮은 문제가 있으나, 화재가 발생하지 않고 경제성이 높다는 장점이 있다. 중국의 CATL, 비야디(BYD) 등은 가격이 비싼 코발트나 니켈 대신 리튬과 인산철을 사용하는 '코발트 제로' 배터리를 생산하고 있다.
장점 및 단점[편집]
- 장점 : 리튬이온 배터리는 크기와 두께를 작고 가늘게 만들 수 있으며, 고밀도로 에너지를 저장할 수 있고, 고전압까지 가능하다는 장점이 있다. 축전지의 최고 기술로 평가받고 있다. 사용하지 않을 때에도 자가방전이 일어나는 정도가 작기에 활용도가 높아 여러 휴대용 전자기기에 많이 사용되고 있다. 에너지의 밀도가 높아 방산업이나 자동화시스템, 항공산업 분야에서도 점점 사용 빈도가 증가하는 추세이다.
- 단점 : 다른 전지에 비해 안정성이 떨어지는 편이라 과방전 시 용량 감소가 매우 크고, 과충전 시에는 매우 불안정해져서 내부 전극에서 쇼트가 나거나 축전지에 충격을 주면 폭발할 수 있다. 즉, 리튬이온 배터리는 폭발 위험이라는 치명적인 단점이 있다.
시장[편집]
세계: 2018년 322억 달러에서 연평균 14.9% 성장, 2024년 799억 달러
화석연료 고갈 문제와 재사용이 가능하며 에너지 효율을 높이기 위해 리튬이온배터리를 포함한 대용량 ESS 관련 연구개발이 지속해서 성장 중이다. MarketsandMarkets(2020) 의 리튬이온배터리 보고서에 의하면, 세계 리튬이온배터리 시장규모는 2017년 322억 달러에서 2019년 400억 달러로 시장이 성장했고, 이후 연평균 14.9% 성장하여 2024년 약 799 억 달러의 규모를 형성할 것으로 전망된다. 2018년 기준, 세계 리튬이온배터리 시장 규모는 아시아-태평양 시장의 비중이 45.9%로 가장 크고, 다음으로 유럽 34.3%, 북미 19.8% 순이다. Global Trade Atlas의 수입통계에 의하면, 2019년 기준 미국의 리튬이온배터리 수입은 중국이 7,247억 달러(52.2%)로 가장 높은 비중을 차지했고, 한국이 2,795억 달러(20.1%), 일본 1,766억 달러(12.7%)로 높은 수입 점유율을 확보하고 있다
국내: 2018년 20,096억 원에서 연평균 14.9% 성장, 2024년 46,579억 원
국내 리튬이온배터리 시장은 2017년 18,214억 원 규모에서 연평균 14.9% 성장하여 2024년에는 약 46,579억 원 규모의 시장을 형성할 것으로 전망된다. 국내 전기·수소차 보급확산을 위한 정책방향]에 의하면, 2차전지 수요 급증과 주행거리 향상(1회 충전 주행거리 500km 목표)을 위해 2차전지 핵심기술인 에너지 밀도 향상과 초급속 대용량 충전 기술 충전기술 개발을 지원하며 글로벌 미래 시장 선점을 목표로 차세대 혁신성장 동력을 창출 중이다.
포스코경영연구원의 '2025년 리튬 수급 전망' 보고서에 의하면 리튬이온배터리 수요 중 전기차의 비중이 2020년 기준 37%에서 2025년 약 56%까지 꾸준히 성장하며 전체 수요 량의 절반 이상을 형성할 것으로 전망된다. 또한, 1인용 이동수단인 E-Bike와 ESS의 수요도 약 2%씩 증가할 것으로 예상된다. 반면, 소형 리튬이온배터리의 수요는 17%에서 10%로 줄어들 것으로 전망된다.
관련 기업[편집]
해외 리튬이온배터리 시장은 전기차 및 대용량 ESS용 중대형 배터리 위주로 시장 수요가 급증하는 추세로 한국, 중국, 일본, 미국의 주요 배터리 업체가 주도 중이며 전기차 탑 재 주도권을 위한 경쟁이 과열되고 있는 상황이다.
리튬이온 배터리 주요업체 동향 기업명 개발/사업화 현황 CATL(중국) ◇ Tesla, Mercedez-Benz, Audi, Volvo 등에 전기차 배터리 납품
◇ 세계 배터리 시장 28% 점유
◇ LPF 기반 양극재를 이용해 누적 주행거리 200만 km(16년) 까지 연장
파나소닉(일본) ◇ Tesla에 원통형 배터리 공급하며 전기차용 2차전지 세계 시장 점유율 1위
◇ Tesla와 함께 기가 팩토리 증설로 2021년 생산능력 35GWh 달성 예상
테슬라(미국) ◇ 2021년 전기차 생산 100만대 목표로 대형 배터리 업체와 협력 중
◇ Panasonic과 협력하여 모델3용 배터리 생산 중
◇ 배터리 업체 Maxwell 인수로 자체 기술 연구 및 대량 생산 시스템 구축
엘지화학(한국) ◇ 업계 유일 화학 기반 업체로 세계 두 번째로 리튬이온배터리 양산 성공
◇ 세계 최초 원통형 리튬이온배터리 양산 성공
◇ 배터리 업체 유일 하이브리드 및 순수 전기차 배터리 생산 가능
◇ Lamination & Stacking 제조 기술을 적용한 고용량/초슬림 배터리 구현
◇ 세라믹 소재 안전성 강화 분리막(SRSTM) 적용 배터리 안정성 향상
삼성SDI(한국) ◇ 70억 개 이상의 셀을 판매한 16년 이상의 리튬이온배터리 양산 경험 보유
◇ 1회 충전 시 주행거리 620km의 SUV용 배터리 소재 개발
◇ 업계 최고 수준 안정 장치를 내제한 모듈화가 용이한 각형 배터리 생산
SK이노베이션(한국) ◇ 업계 최초 고에너지 밀도 삼원계 소재 적용 리튬이온배터리 양산 성공
◇ 현대자동차, 폭스바겐, 베이징자동차 등 배터리 공급 계약 체결
◇ 고품질 및 고강도 습식 분리막 적용 안정성, 내열성 및 수명 향상
◇ 파우치(Pouch) 셀 기술 기반 배터리 셀 설계 및 구현 가능
*출처: 업계현황자료 종합, NICE평가정보 재가공
재개발 필요성[편집]
전 세계적으로 차세대 에너지원을 우선적으로 확보하기 위한 경쟁 상태에 돌입해 있고 그러한 에너지원으로 인해 국가간 분쟁도 일어나도 있는 실정이다. 현재 리튬이차전지가 전기자동차와 에너지 저장장치로서 각광을 받고 있어 이에 따라 전지를 구성하는 소재 확보가 문제점으로 지적되고 있다.
리튬이차전지 산업은 크게 셀 제조업과 소재산업으로 분류할 수 있다. 셀 제조업은 이차전지를 생산하는 것이며, 소재산업은 리튬이차전지를 이루는 양극활물질, 음극활물질, 분리막, 전해질을 생산하는 것이다.
4대 핵심소재산업에서는 양극재, 음극재, 전해질, 분리막으로 구성되며 스마트폰, 전기자동차 등 각각의 응용처에서 요 구하는 성능에 맞추어 다양한 성능의 이차전지가 개발되고 있으며 셀 제조업에서는 소형 이차전지의 경우 주로 스마트폰 등 휴대용 전자기기에서 사용되며 중대형 이차전지의 경우 전기자동차 대용량 에너지저장장치 등에 사용되는 이차전지를 생산하고 있다.
하지만 리튬이차전지 원가의 50~60% 가량은 소재가 차지하고 있는 상황에서 리튬이차전지를 생산하는 셀 제조업의 발전발전과 더불어 소재산업에도 충분한 관심과 연구가 필요하다. 소재산업에서는 무엇보다도 배터리의 원료가 되는 리튬, 니켈, 코발트 등에 대한 확보대책과 함께 소재분야에서의 획기적인 재료 개발이 필요할 때다.
각주[편집]
- ↑ 〈리튬이온 배터리의 4대 요소〉, 《삼성SDI》,
- ↑ R.E.F 15기 김상재, 〈리튬이온배터리 : 반도체 시대를 지나 배터리 시대로〉, 《에너지설비관리》, 2019-12-02
- ↑ KOSEN, 〈리튬이온전지의 성능 및 수명 개선을 위한 열관리 기술〉, 《한국과학기술연구원》, 2018-11-01
참고자료[편집]
- 〈리튬 이온 전지〉, 《위키백과》
- 〈锂离子电池〉, 《百度百科》
- 〈锂离子电池〉, 《维基百科》
- "Lithium-ion battery", Wikipedia
- 리튬이온배터리 혁신성장품목 분석 보고서- https://ssl.pstatic.net/imgstock/upload/research/industry/1596760942991.pdf
같이 보기[편집]

 위키원
위키원