전고체 배터리
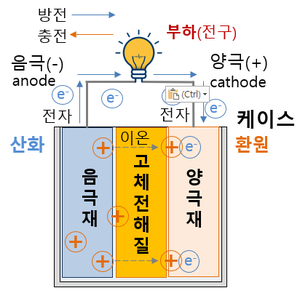
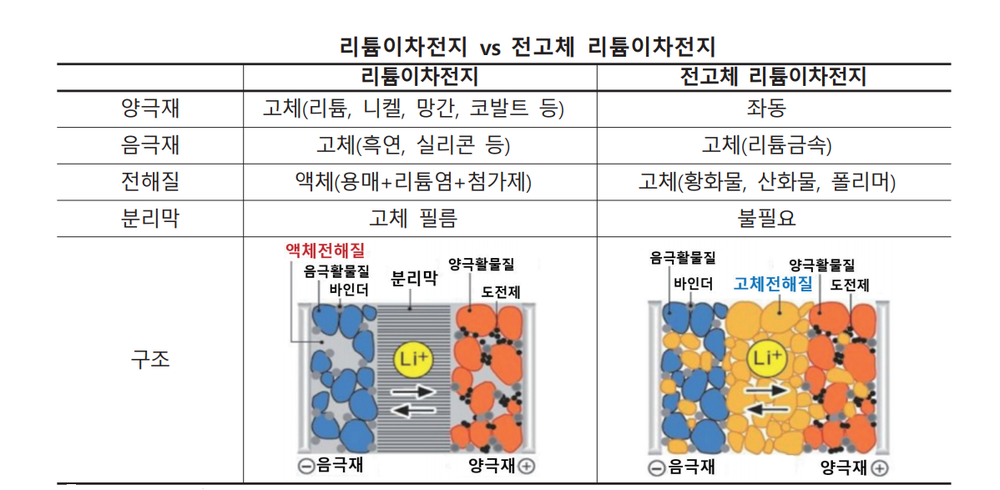
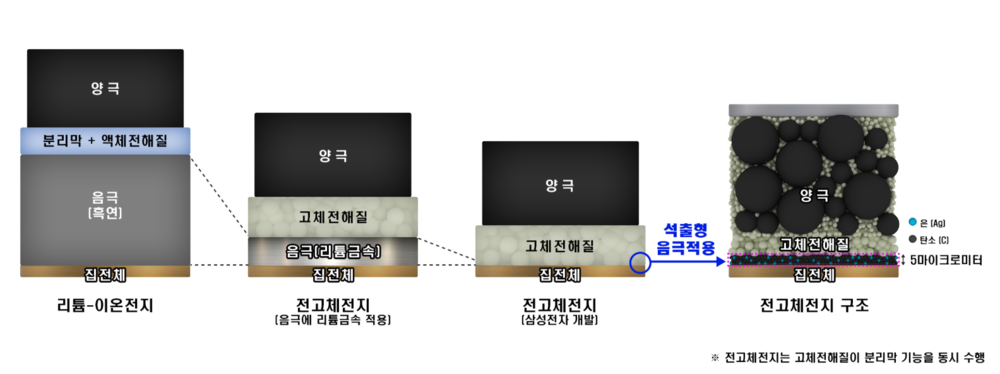
전고체 배터리(全固體, solid-state battery)는 액체 전해질 대신 고체를 사용한 배터리이다. 전고체 배터리는 에너지 밀도가 높고, 충전 시간이 빠르며, 안전성이 높고, 가격이 저렴하여 차세대 꿈의 배터리로 불린다. 즉 리튬이온 배터리에 필요한 전해액과 분리막을 없애고, 비는 공간에 에너지밀도가 더 높은 물질을 집어넣을 수 있다.
| [타고] 1개월 단위로 전기차가 필요할 때! 타고 월렌트 서비스 |
목차
개요[편집]
액체로 만들어진 기존 배터리는 양극과 음극이 만날 경우 화재가 발생할 위험이 있으나, 전고체 배터리는 리튬이온이 이동하는 전해질을 고체로 만들기 때문에 항상 고정돼 있어 구멍이 뚫려도 폭발하지 않고 정상 작동한다. 고체 전해질은 액체 전해질보다 내열성과 내구성이 뛰어나기 때문에 폭발이나 화재 가능성이 낮고 크기도 줄일 수 있다. 전고체 배터리는 안전성뿐만 아니라 용량과 두께 측면에서 "플렉서블(휘는·flexible) 배터리"를 구현하는 최적의 조건을 갖춘 것으로 평가 받는다. 전해질에 액체가 없어 초박막을 만들 수 있고, 양·음극을 여러 겹 쌓아 고전압·고밀도 배터리 구현이 가능하기 때문이다. 리튬이온 배터리보다 에너지 밀도가 높아 전기차의 주행 거리 향상과 충전 시간을 절약할 수 있다. 부품이 덜 들어가는 만큼 무게도 가벼워진다. 기존 리튬이온 전지의 에너지 밀도는 255Wh/㎏ 수준이다. 반면 전고체 전지는 이론적으로 495Wh/㎏까지 에너지 밀도가 올라간다.
그러나 전고체 전지는 고체 형태이다 보니 액체 전해질에 비해 이온전도도가 낮아 출력이 낮고 수명이 짧다는 단점이 있다. 이에 따라 세계 산업계는 최대한 이온 전도도를 높일 수 있는 전고체 재료 찾기에 나섰다. 유력한 재료로 꼽히는 것이 폴리머, 옥사이드, 인산염, 황화물 등 네 가지다. 다만 각각 그 특성에 따른 장단점이 명확하다.
폴리머는 이온전도율이나 온도 변화에 대한 안정성이 떨어지지만 생산 용이성이 높다. 보쉬에서 선제적으로 폴리머 전고체 전지 개발에 나선 상태다. 한편 옥사이드와 인산염은 이온전도율이나 안정성은 괜찮은 편이나 생산 용이성이 낮다.
산업계의 주목을 받는 물질은 황화물이다. 이온전도율, 생산 용이성, 온도 변화에 대한 방어력 등이 두루 높다. 토요타, 삼성SDI 등 세계 제조기업에서 이를 기반으로 한 전고체 전지 개발에 열을 올리고 있는 것도 이 때문이다.
전고체 전지의 실용화 시점은 2025년 안팎으로 예상된다. BMW가 전고체 전지 양산 시점을 2026년이라고 못 박기도 했다.
LG에너지솔루션과 삼성SDI, 중국 CATL, 일본 파나소닉 등이 전고체 배터리를 개발 중이다.
주요 완성차 업체들도 전고체 배터리 개발에 뛰어들었다. 일본 토요타는 2008년 차세대 배터리 연구소를 세우면서 정부, 학계와 함께 전고체 배터리를 개발한다고 발표했다. 독일 BMW는 미국의 연료전지기업 솔리드파워와 손잡고 전고체 배터리를 장착한 전기차를 2025∼2026년께 출시할 계획이다.[1]
역사[편집]
전고체 배터리 개념은 1980년대 처음 제시됐으나 한동안 빛을 보지 못했다. 그러다 일본 토요타가 2010년 황화물 전해질을 사용한 배터리 시제품을 공개한 뒤로 연구가 눈에 띄게 늘었다. 현재는 소재 후보군으로 황화물과 산화물, 고분자 3종이 발굴됐다. 이 가운데 황화물 소재는 가장 앞서 나간다. 일본은 전고체 배터리 연구에서 가장 앞서나가는 국가로 손꼽힌다. 일본에선 주로 황화물 연구가 주를 이룬다.
1991년 일본 소니가 첫 개발해 상용화한 리튬이온 배터리를 대체할 차세대 2차전지로는 리튬에어 전지, 리튬메탈 전지, 리튬황 전지, 전고체 전지가 있다. 그 중에서 전고체 전지를 탑재한 전기차를 2022년 도요타가 출시할 계획이다. 한국은 2025년 전고체 배터리를 상용화할 계획이다.
전세계 전기차용 전고체 배터리 시장이 2030년 최대 100조원 규모로 급성장할 것으로 관측되고 있다.
토요타는 전고체 배터리를 사용하면 출력과 전기저장량이 액체 전지보다 2배 이상 늘어날 것으로 보고 있다.
토요타, 다이슨, 포르셰 등 글로벌 2차전지 수요기업이 전고체 전지 사용화 계획을 연이어 발표하고 있다.
충전하는데 몇 시간씩 걸리는 리튬 이온 전지에 비해 전고체 전지는 불과 5분이면 80% 충전이 가능하다. 주행거리도 리튬이온전지의 2배 이상에 달한다. 기존의 가솔린, 경유 차량의 주유소 급유시간이 5분이다.
2012년~2014년 토요타가 출원한 차세대 전지 관련 특허의 68%는 전고체 전지 분야다. 200명의 개발인력을 전고체 전지 개발에 투입하고 있다.
리튬 이온 배터리에 비해 가격이 1/3이다.
SNE리서치에 따르면 전고체 배터리를 탑재한 전기차 비율은 2024년 2%에서 2030년 10%로 증가할 전망이다. 글로벌 조사 업체 Allied market research는 2017년 633억원이었던 글로벌 전고체 배터리 시장이 2025년 1조6820억원으로 확대한다고 예측했다. 일본 시장조사업체 후지경제는 2035년 전고체 배터리 시장규모가 32조6000억원에 이를 것으로 내다 봤다.[2]
리튬이온 배터리와 전고체 배터리[편집]
- 전고체 전지와 기존 리튬 2차전지의 작동원리는 동일하나, 전지의 구성요소 중 가연성 액체로 되어 있는 전해질을 고체 전해질로 바꾸어 온도 변화와 외부 충격에 따른 화재·폭발 위험이 현저히 감소된다. 리튬이온 배터리의 액체 또는 겔(Gel) 상태의 전해질은 온도에 따라 동파·기화·팽창하거나, 외부 충격으로 전해질이 누출될 시 화재·폭발이 발생한다.
- 온도 변화와 외부 충격 등에 대비한 안전장치 및 분리막이 필요 없으므로 동일한 크기로 원가절감과 고용량 구현이 가능하다.
- - 화재위험이 없으므로 배터리팩 공간의 30% 이상을 차지하는 냉각장치가 제거된 공간에 추가적으로 배터리셀을 채워 넣어 에너지밀도를 증대시킬 수 있다.
- - 액체 전해질에서 양극과 음극을 물리적으로 차단해 전기적 단락을 방지하는 역할을 했던 분리막이 필요 없어 부피 감소 및 원가 절감이 가능하다.
- - 기존 리튬이온 배터리는 모노폴라(Mono Polar) 구조로서 용량 확장을 위해 여러 개의 셀을 연결해야 되는 반면, 전고체 전지는 멀티폴라(MOl3R-Polar) 구조가 가능해 부피를 감소할 수 있다.
- 용량이 흑연의 10배에 달하는 등 월등한 성능에도 불구하고 극간 화재·폭발 위험때문에 사용하지 못했던 리튬금속을 음극활물질로 사용할 수 있어 동일한 크기로 고용량을 구현할 수 있다.
장점[편집]
- 폭발 및 발화 특성이 없어 안전성이 우수하다.
고체 전해질은 온도 변화에 따른 증발이나 외부 충격에 따른 누액 위험이 없다. 부피팽창(swelling)이 발생하지 않고, 열과 압력 등 극한 외부 조건에서도 정상 작동할 수 있다.
- 높은 에너지 밀도를 구현할 수 있다.
이는 적층 가능한 바이폴라(bipolar) 구조의 장점이다. 유기 전해액을 고체 전해질로 대체하면 집전체 양면에 음극과 양극이 결합된 바이폴라 전극을 제조할 수 있다. 바이폴라 전극의 적용이로 단전지에서 10V 이상의 고전압이 발현할 수 있다. 예컨대 리튬이온 배터리에서 14.4V를 구현하려면 3.6V 전지 4개를 배치해야 하는데, 전고체 배터리는 단전지로 가능하다. 단전지화의 효과로 분리막, 집전체, 셀외장재(파우치) 등이 감소해 부피가 줄어들고, BMS(battery management system)를 최소화하기 때문에 부피당 에너지 밀도를 높일 수 있다.
- 고출력이 가능하다.
액체 전해질과 달리 리튬이온이 용매와 분리되는 탈용매 반응이 불필요하다. 충방전 반응이 곧 고체 내 리튬이온의 확산 반응으로 반영돼 높은 출력이 기대된다.
- 사용 온도가 넓다.
기존 유기 전해액에 비해 넓은 온도 영역에서 안정적인 성능을 확보할 수 있다. 특히 저온에서 높은 이온 전도도가 기대된다. 전기차 사용자의 가장 큰 애로사항이 겨울철에 배터리 성능이 저하돼 주행거리가 줄어드는 것이다. 테슬라(Tesla) Model X를 충전 50% 상태에서 추운 밤에 세워두면 다음날 아침 충전율이 30%로 내려간다. 전고체 배터리 시대가 오면 저온 환경의 불안 요인이 해소될 것이다
- 전지 구조가 단순하다.
분리막이 필요 없다. 제조 공정 상에서 슬러리 상태의 고체 전해질을 양극 활물질에 코팅한다. 액체 전해질의 주액 공정 없이 연속 공정을 통해 다양한 형태의 다층 구조 셀을 구현할 수 있다.[3]
단점[편집]
- 현실은 고체 전해질 소재, 활물질-전해질 경계의 높은 저항(계면 저항), 제조 공정 등에 걸쳐 많은 논란과 과제를 안고 있다.
소재는 아직 기대 성능에 미치지 못하고, 특허 이슈가 많다. 셀 제조 과정에서 엄청난 압력과 온도를 필요로 하는데 양산 설비를 구축하기 어렵다. 고체이기 때문에 이질적인 파우더끼리 계면 저항, 전극과 전해질의 계면 저항을 피할 수 없다.
- 고체 전해질은 액체 전해질에 비해 이온전도도가 낮다는 것이 본질적 문제다.
기존 리튬이온 배터리처럼 전극 제조 시 슬러리로 코팅하면 용량이나 효율 특성이 현저하게 저하된다. 원가 측면에서는 고체 전해질이 액체 전해질과 분리막을 더한 것보다 원가가 낮아야 하는데, 소재의 특성상 당분간 어렵다. 또한 음극재까지 리튬메탈로 변경하면 새로운 생산 설비가 필요하기 때문에 제조원가가 높을 수 밖에 없다.[3]
산화물계 고체 전해질 전고체 배터리[편집]
- 전고체 배터리의 고체 전해질은 액체 전해질과 동등한 이온 전도도를 가져야 한다. 현행의 리튬 이온전지에 사용되고 있는 용매 전해질의 전기 전도도는 10⁻²S㎝⁻¹ 대이다. 이 값의 대부분은 전지의 동작과 관계되지 않는 음이온이 하전담체로 작용한 것이어서, 리튬이온 전도의 기여는 반 이하에 머무른다. 따라서 리튬이온 배터리를 전고체화 할 수 있는 고체 전해질의 이온 전도도는 10⁻³S㎝⁻¹ 정도이다.
- 리튬이온을 전도 종으로 10⁻³S㎝⁻¹ 이상의 이온 전도도를 나타내는 고체 전해질은 질화리튬이다. 그러나 이 물질은 안정인 전위 범위가 0.45V에 지나지 않고, 고전압의 전지를 구성하는데 장해가 된다. 그 후, 산화물계 재료에서도 1990년대에 나시콘형 결정 구조를 가지는 LiTi₂(P0₄)₃나 페로브스카이트형 구조의 Li₃xLa⅔-xTi0₃로 10⁻³S㎝⁻¹의 이온 전도도가 달성되었다.
- 이러한 재료 중에서 티탄의 원자가수는 +4 상태이지만 전이금속은 원자가수가 변화하기 쉬운 원소이다. LiTi₂(P0₄)₃에는 리튬 전극 기준으로 2.5V, Li₃xLa⅔-xTi0₃에서도 1.5V로 전자가 주입되어 d¹상태로 된다. 전지를 고전압화 해, 에너지 밀도를 높이기 위해서는, 음극에 낮은 전위를 나타내는 재료를 사용해야 하지만, 이러한 고체 전해질이 그러한 음극과 접촉하면 음극으로부터 주입된 d전자가 전자 전도를 가져오게 되어 전해질로는 작용하지 않는다.
- 상기 물질은 내환원성이 낮기 때문에, 가닛(garnet)형 산화물계 고체 전해질을 고려할 수 있다. 즉 Li₇ La₃Zr₂0₁₂계의 이온 전도도는 거의 10⁻³S㎝⁻¹에 달했다. 그러나 높은 이온 전도도와 내환원성을 겸비하는 가닛형의 고체 전해질에도, 산화물계 재료에 공통의 해결해야 할 과제가 남아 있다.
- 산화물계 고체 전해질의 경우, 결정격자 중의 리튬 확산은 매우 빠르다. 그러나 다결정의 세라믹은 입자 끼리나 계면(입계) 저항이 매우 높아진다. 또 리튬이온 이외의 원소도 확산을 시작해 활물질과 고체 전해질 중의 원소가 서로 만나서 계면에 반응상이 형성된다.
- 그러나 붕산리튬(Li₃B0₃)을 사용하면 반응상의 형성을 억제할 수 있다. 이 물질의 이온 전도도는 10⁻⁶S㎝⁻¹에 지나지 않지만, 융점은 700℃로 매우 낮고, 저온에서 활물질과 접합하는 것이 가능하다. 즉 분리층과 작용하는 부분의 고체 전해질에는 고온 소결한 가닛형 산화물을 사용해, 그 위에 활물질과 붕산리튬의 혼합물을 저온으로 소결한 전극층을 형성한 것이 보고되고 있다.
황화물계 고체 전해질 전고체 배터리[편집]
- 산화물 이온에 비해 큰 황화물 이온은 이온 전도 경로가 되는 음이온 간의 틈새가 넓다. 게다가 황화물 이온의 분극률이 높기 때문에 리튬이온에 대한 속박력이 약해져, 리튬이온은 움직이기 쉬운 상태가 된다. 때문에 황화물계 고체 전해질의 이온 전도도는 1980년 초에 이미 10⁻³S㎝⁻¹이었다. 더욱이 황화물계 고체 전해질은 입계저항을 낮추기 위한 고온 소결 과정이 불필요한 점도, 산화물계와 크게 다른 이점이다.
- 즉, 황화물계 고체 전해질은 실온에서 가압 성형하여 입계 저항이 매우 낮은 성형체를 얻을 수 있다. 또 수화물계 고체 전해질로 소결 시의 다른 결정구조 생성의 문제가 적고, 간단한 공정으로 전지를 제작할 수 있다. 그러나 황화물계 고체 전해질은 대기 중의 습기와 쉽게 반응해 버리는 취급하기 어려운 재료이다.
- 앞에서 기술한 바와 같이 리튬이온만을 전도 종으로 하는 고체 전해질에 요구되는 10⁻³S㎝⁻¹의 이온 전도도는, 유기용매 전해질의 10⁻²S㎝⁻¹에 상당한다. 황화물계 고체 전해질에 있어서의 이온수송 특성은 유기용매 전해질을 능가하고 있다. 그러나 황화물계 고체 전해질의 이같은 높은 이온 전도도를 전지의 출력 성능에 연결하기 위해서는 아직 해결해야 할 문제가 남아 있다.
- 이온 전도체의 표면이나 이온 전도체가 다른 물질에 접촉한 계면은 가동 이온 농도가 변화한 공간 전하층이 형성된다. 이때 고체 전해질 내부와는 다른 이온 수송거동을 나타낸다. 이와 같은 특이한 이온전제현상은 공간 전하층의 두께가 10㎚ 전후로 나노이오닉스(nano-ionics)라부른다. 황화물계 고체 전해질을 사용한 전고체 전지 문제가 되는 것은, 정극 활물질과의 계면에 있다.
- 황화물 전해질은 음이온 격자와 리튬 이온에 대한 속박력이 약하기 때문에, 리튬 이온 농도가 크게 저하한다. 그 결과, 정극 활물질과의 계면에서 공간 전하층은 리튬이온이 부족하여, 황화물계 고체 전해질을 사용한 전고체 전지의 출력 성능을 저하시킨다. 즉 황화물 이온의 높은 분극률은, 고체 전해질 중의 이온 전도도는 우수하지만, 에너지 밀도를 높이기 위해서 정극과 조합했을 때에는 결점이 된다.
- 이 문제를 해결하는 방법은 고체 전해질이 정극 활물질의 높은 전위에 노출되지 않게 하는 것이다. 이를 위해서 정극 활물질 표면에 전자 절연성의 박층을 피복하는 방법이 제안되고 있다. 이 박층은 리튬이온 결핍층의 형성에 대한 완충작용을 발휘한다. 그 결과 완충층이 형성되어 전고체 전지의 출력 성능이 높아져서, 유기용매 전해질을 사용한 현행의 리튬이온 배터리와 동등한 수준의 성능을 나타낸다.
고체 전해질 특성[편집]
- 소재 연구가 가장 우선이다. 고체 전해질은 전기화학적 안정성, 열 안정성, 전기 절연성이 요구되며 유기 액체 전해질 수준의 높은 이온전도도를 갖춰야 한다.
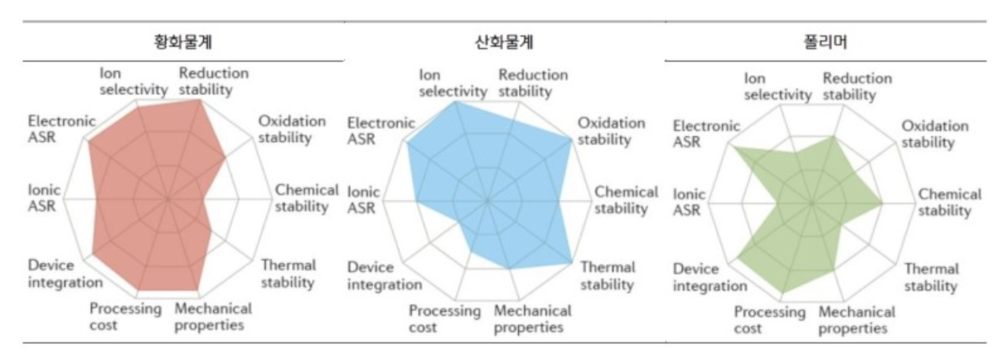
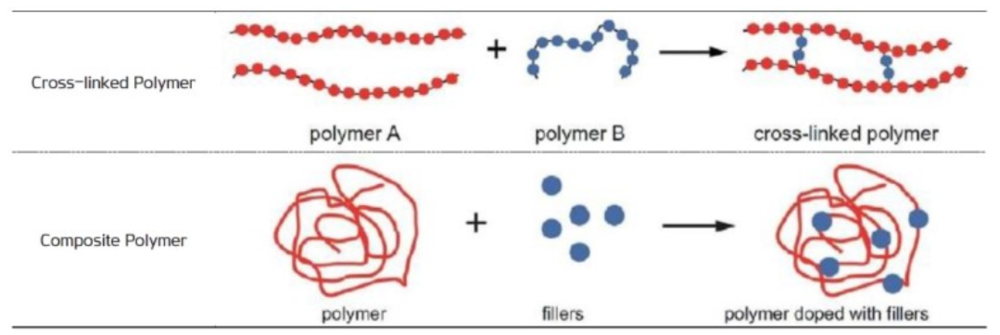
- 고체 전해질은 무기 고체 전해질(황화물계, 산화물계)과 유기 고체 전해질(폴리머)로 나뉜다. 이 가운데 황 화물계 전해질의 전도도와 셀 성능이 우수한 것으로 평가되고, 가장 활발한 연구가 진행되고 있다.
황화물계[편집]
리튬이온 전도도가 10⁻²~10⁻³ S/cm 수준으로 높고, 전극과 전해질 간 접촉 계면을 형성하기가 용이하다. 기계적 강도와 기계적 유연성이 좋은 편이다.
수분 반응성이 높기 때문에 공기 중 안전성이 취약하다. 또한 대기 중에서 불안하면 생산이 어렵고, 셀 제조 공정에서 실내 습도 제어가 매우 중요해진다. 또한 공간 전하층(Space Charge Layer, 전자 또는 이온의 이동으로 전하가 박층상으로 분포하는 영역)이 형성되어 양극과 전해질의 계면에 높은 저항층이 발생한다. 쉽게 말해 기존 양극과 잘 맞지 않아 별도의 처리가 필요하다.[3]
산화물계[편집]
공기 중 안전성이 우수하고, 리튬 이온 전도도가 10⁻³~10⁻⁴ S/cm 수준으로 황화물계보다는 낮지만 비교적 높은 편이다. 전기화학적 안전성과 기계적 강도가 우수하고, 산화 전압이 높다.
고체 전해질의 입계 저항이 크고, 전극과 전해질 간 접촉 계면 형성이 어렵다. 1,000℃ 이상의 고온 열처리 공정이 필요하고 셀을 대형화하기 어렵다.[3]
폴리머[편집]
기존 리튬 폴리머 기술과 유사해 활용성이 높다. 전극 계면 형성이 용이하고 기존 공정과 크게 다르지 않기 때문에 Roll to Roll 공정을 적용할 수 있으며 제조원가도 강점이다. 덴드라이트 생성을 최소화해 리튬메탈과 반응이 안정적이고 Flexible Form Factor를 구현하기에 적합하다.
리튬이온전도도가 낮고, 고온 환경에서만 사용할 수 있는 결정적 단점을 안고 있다. 예컨대 폴리머 고체 전해질은 Poly Ethylene Oxide(PEO)를 기본 물질로 사용하는데, 65~78℃ 일 때 10⁻⁴ S/cm 의 이온전도도를 확보한다.[3]
고체 전해질 연구 동향[편집]
현재는 3가지 전해질 모두 요구 성능을 맞추지 못하고 있다. 전고체 종류별로 가장 중요한 극복 과제를 꼽으면 황화물계는 수분 안전성, 산화물계는 전지 셀 가공성, 폴리머는 이온전도도이다.
소재 개발[편집]
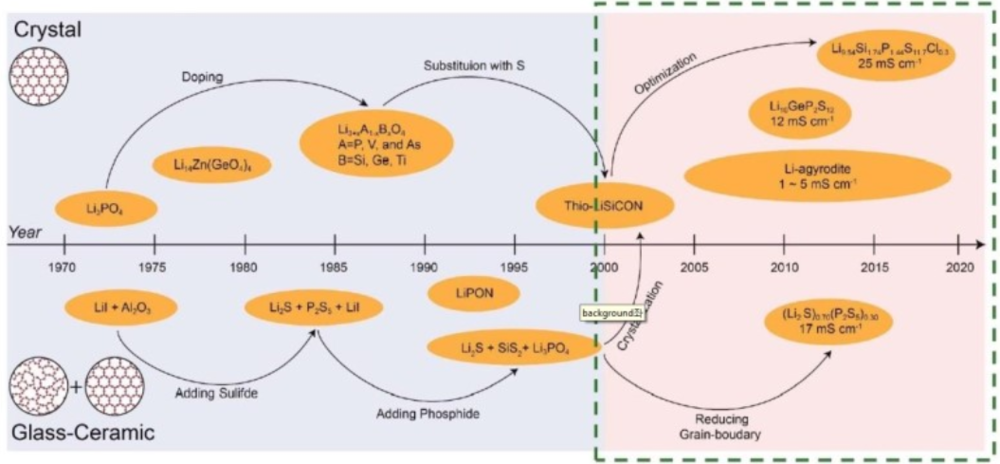
황화물계 소재는 결정형인 LGPS(Li₁₀GeP₂S₁₂), LSPSCl(Li₉.₅₄Si₁.₇₄P₁.₄₄S₁₁.₇Cl₀.₃), Argyrodite 등과 Glass ceramic 형인 LPS, LPS+LiCl 등이 주축이다. 산화물계 소재는 Perovskite(LLTO), NASICON, LISICON, Gamet(LLZO) 등이다. 폴리머 소재는 PEO 등을 중심으로 활발한 연구가 이루어지고 있다.
이 중에서 황화물계인 LGPS(LSPSCl), Glass Ceramic, 산화물계인 LLTO, LLZO 등의 상용화 가능성이 높은 것으로 거론되기도 한다.
고체 전해질 소재 기술은 일본이 많이 앞서 있다. 이에 따라 핵심 소재는 특허 이슈가 크다. 고체 전해질 중 황화물계 특허 비중이 45%로 가장 많은 비중을 차지한다. 개별 주체로는 토요타가 전고체 배터리 분야에서 가장 많은 특허를 출원하며 연구에서 앞서 있다. 후발 주자들은 특허를 피하기 위해 소재 성분을 달리 구성하는 연구에 집중하고 있다. Argyrodite가 상대적으로 특허 이슈에서 자유롭다고 알려졌다.
황화물계는 상온에서 가장 높은 이온전도도를 구현한 LGPS 계열(2011년)을 중심으로 한다.' 그 뒤로 LSPSCI 계열(2016년)이 LGPS보다 뛰어나다는 발표가 있었다. 토요타가 LGPS, LSPSCI 계열에 초점을 맞추고 있고, 두 소재를 원천 개발한 동경공업대와 공동 연구하고 있다.
LGPS 전해질은 게르마늄(Ge)이 고가이고, 저전위에서 안정성이 취약하다는 약점을 가진다. 이를 극복하기 위해 게르마늄을 대체해 원가를 낮추는 동시에 전도도를 높이고, 저전위에서 안정성을 확보하고자 하는 연구가 진행되고 있으며, LSPSCI 계열이 이를 충족시킨다.
황화물계는 수분 안전성을 향상시키는 기술이 필수적이다. 황(S)이 수분(H₂O)을 만나면 유해한 황화수소(H₂S)가 발생한다. 첨가제를 섞어 황화수소 발생을 줄이거나 황화수소 발생량과 속도를 억제하는 신규 조성소재를 연구 중이다.[3]
계면 접촉 극대화[편집]
고체 전해질은 이온이 고체 격자 사이에서 이동하기 때문에 활물질과 전해질간 접촉 계면을 극대화하는 동시에 계면 저항을 최소화해야 한다.
먼저 물리적 접촉 면적을 극대화하는 문제다. 고체 전해질은 액체 전해질과 달리 젖음성과 흐름성이 없다. 또한 고체 전해질, 활물질, 도전재 각 성분의 크기와 형상이 다양하다. 슬러리 제조 단계에서 활물질과 전해질을 무작위로 혼합하는 구조다 보니 계면 형성이 어렵고, 전자와 이온의 통로를 만드는 것이 어렵다.
접착력을 향상시키기 위해 섞는 바인더가 계면 형성을 방해하면서 계면 저항이 증가한다. 고체 전해질은 얇으면서도 결함이 없어야 하며, 양극과 계면 접촉이 좋아야 한다.
기술적으로 높은 압력과 열을 가해서 셀을 만들고, 계면 접촉을 형성한다. 황화물계는 필렛(Pellet) 형태에서 냉간 압착(Cold Pressing) 공법으로 높은 압력을 가한다. 산화물계는 압착할 수 없기 때문에 고온에서 동시소결(Co-sintering) 하는 공법을 택한다. 이때 양극활물질은 700℃에서 소성하는데 비해 산화물계 전해질은 1,000℃이상이 돼야 성능이 좋아진다. 두 물질 간 소성 온도를 맞추는 것도 관건이다.[3]
계면 저항 최소화[편집]
양극과 전해질 간 계면 저항을 억제하는 것이 핵심 과제다. 계면이 있으면 크고 작은 공간 전하(Space Charge)가 생기기 마련이다. 산화물 양극과 황화물 전해질 간에는 잠재에너지 차이가 커 계면 부반응이 유발된다. 충·방전 과정에서 양극 활물질의 부피 변화에 따라 고체 전해질과 접촉면이 분리돼 전하 이동을 어렵게 만든다. 고온 또는 고압 공정이 진행되면 계면 저항이 더욱 커진다.[3]
LGPS 등 황화물계는 1.8~2.2V까지만 안정되며 이를 벗어나면 전기화학적으로 분해된다. 이 경우 부분 절연이 발생할 수 있고, 보유 용량이 열악해진다. 이에 비해 리튬이온전지는 3.7V에서 사용하고 4.2V로 충전한다. LGPS는 LTO를 음극으로 사용하며, 고전압을 구현하기 어렵다.
계면 저항을 억제하기 위해 양극활물질 표면에 LiNbO₃ 등의 재료를 코팅해 버퍼층을 형성하는 기술이 활용되고 있다. 코팅 재료를 10 나노 이하로 균일하게 코팅하면 해결할 수 있다. 또한 동시 소결이나 저온 결정화를 통해 계면의 기계적 안정화를 꾀함으로써 계면 저항을 낮출 수 있다.
플렉시블 구현[편집]
폴리머 전고체 배터리는 플렉시블 배터리를 구현해 웨어러블 기기 등에 응용하기에 유리하다. 플렉시블 배터리가 상용화되려면 Bending 특성, 용량, 수명 특성이 향상돼야 하고, 플렉시블 파우치가 개발돼야 한다. 전지 소재 측면에서는 고체 전해질의 이온전도도와 기계적 물성을 향상시키고 전극과 전해질 간 계면 저항을 개선하며, 고체 전해질 기반의 전지 두께를 극소화(1mm 이하) 하고, 플렉시블 집전체를 개발해야 하는 과제를 안고 있다.
용매가 없는 이상적인 고체 폴리머 전해질은 전해질염이 고형화된 고분자 매트릭스에 녹아 있고, 고분자 사슬의 국소 분절 운동을 통해 전도가 이루어진다. 기본 물질인 Poly Ethylene Oxide(PEO) 비중이 높으면 실온에서 높은 결정성을 가지는 대신 전도도가 낮아지고, PEO 비중이 낮으면 기계적 강도가 취약해진다.
전도성을 향상시키기 위한 기술로서 1) 용매를 가소제(Plasticizer)로 첨가해 합성 폴리머 겔을 형성하거나 2) 무기물 필러(Al₂O₃, TiO₂ 등)를 폴리머에 결합시켜 합성 폴리머 전해질을 만드는 기술이 주로 연구되고 있다. 고분자를 교차 연계해 기계적 안정성을 높이는 기술도 유용하다.[3]
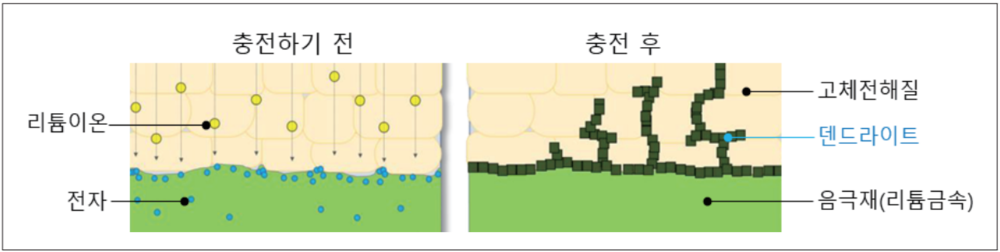
덴드라이트 현상[편집]
덴드라이트(Dendrite)는 배터리를 충전할 때 양극에서 음극으로 이동하는 리튬이 음극 표면에 적체되며 나타나는 나뭇가지 모양의 결정체다. 이 결정체가 배터리의 분리막을 훼손해 수명과 안전성이 낮아진다. 또 분리막을 찢어 화재나 폭발을 유발하기도 한다.
일반적으로 전고체 배터리에는 배터리 음극 소재로 리튬금속(Li-metal)이 쓰이는데, 리튬금속은 전고체 배터리의 수명과 안전성을 낮추는 덴드라이트(Dendrite) 문제를 해결해야 하는 기술적 난제가 있다.
삼성 종합기술원은 덴트라이트 문제를 해결하는 '석출형 리튬음극 기술'을 세계 최초로 전고체 배터리에 적용했다. 전고체 배터리의 최대 난제인 덴드라이트를 해결할 원천기술을 확보한 것이다.[4]
개발 현황[편집]
한국[편집]
2018년 3월 19일, 국책연구기관인 산업연구원(KIET)은 전고체 배터리의 양산 시점이 전기자동차 보급의 전환점이 될 것이라는 전망을 내놓았다. 한국의 자동차 업계에서는 이 시점을 2025년으로 본다. 그러나 중국은 2018년 양산을 시작했다.
2019년 6월 17일, 한국생산기술연구원은 김호성 박사(제주지역본부장) 연구팀이 폭발 및 화재 위험을 없애면서 배터리 팩의 부피를 획기적으로 줄일 수 있는 '바이폴라 구조의 전고체전지' 제조 기술을 개발했다고 밝혔다. 에너지밀도는 약 445Wh/L 수준이다.
상용화 시점이 일본보다 7~8년 늦은 2030년으로 예상되고 있다. 오는 2030년이 되면 글로벌 신차 중 절반이 전기차일 것이라는 관측이 나온다.
삼성SDI는 2020년 5월 1회 충전에 800㎞를 주행할 수 있는 전고체 배터리 연구 성과를 공개했다. 삼성SDI는 이 연구를 바탕으로 2027년께 전고체 배터리를 양산한다는 계획이다.[5]
LG에너지솔루션이 오는 2025년께 리튬 황 배터리, 전고체 배터리를 상용화한다. 리튬 황 배터리는 2025년, 전고체 배터리는 2025년부터 2027년까지를 각각 상용화 목표 시점으로 제시했다. '2021 배터리 데이'에서 LG가 차세대 배터리 개발 로드맵과 상용화 계획을 구체적으로 공개한 것은 이번이 처음이다.[6]
중국[편집]
2018년 11월 26일, 중국 칭다오에너지디벨로프먼트가 최근 10억위안(약 1600억원)을 투자해 장쑤성 쿤산시에 전고체 배터리 양산 라인을 구축, 양산에 들어갔다. 세계 최초의 전고체 전지 양산 공장이다.
이 분야를 선도하고 있는 일본은 2021년 양산 공장을 가동할 계획이다. 3년 앞섰다. 한국은 2025년 계획이다. 7년 앞섰다.
칭다오에너지는 최신 리튬이온 배터리 셀 에너지 밀도가 kg당 250~300Wh 수준인 것과 비교, 자사가 양산하는 전고체 전지는 kg당 400Wh 이상 에너지 밀도를 달성했다고 주장했다. 같은 차량 무게일 경우 더 많은 배터리 탑재가 가능하다는 의미이다.
그러나, 한국에서는 칭다오에너지의 양산이 상용화라기 보다는 연구 성과 수준이라고 본다. 한국의 배터리 기업들의 연 생산규모는 칭다오에너지의 180배에 달하기 때문이다.[2]
'제2의 테슬라'로 떠오르고 있는 중국 전기차 업체 니오는 대만 배터리 업체 프롤로지움 등과 함께 전고체 배터리를 장착하는 전기차를 개발하고 있으며, 미국 정보 기술(IT) 공룡 애플의 최대 스마트 기기 위탁 생산 업체인 대만 폭스콘도 2024년 출시를 목표로 전고체 배터리를 개발하고 있다.[7]
일본[편집]
토요타는 일찍이 2008년에 배터리 연구소를 출범, 자국 정부 및 학계와 손잡고 전고체 배터리를 개발하겠다고 발표했으며 2019년 1월에는 파나소닉과 전고체 배터리 전기차 개발용 합작 법인을 설립했다. 파나소닉-토요타 연합은 꿈의 배터리라 불리는 '전고체 배터리' 기술을 선도하는 업체다. 전 세계에서 전고체 배터리 관련 특허를 40%가량 보유하고 있다. 기술력이 가장 앞서 있다고 평가받는 일본 토요타는 대규모 민관 컨소시엄을 구성해 총 17조원을 투자, 오는 2022년에 생산할 계획이다. [2]
토요타는 2020년 12월 11일, 자체 개발한 전고체 배터리를 공개했다. 토요타에 따르면 이 배터리는 단 10분이면 완충할 수 있고, 1회 충전으로 500㎞를 달릴 수 있다. 특히 토요타가 갖고 있는 전고체 배터리 관련 특허는 1000개가 넘는다. 전고체 배터리 개발로 가는 길목 곳곳을 토요타가 특허로 가로막고 있어 후발주자가 난항을 겪고 있다는 게 업계의 설명이다. 실제로 토요타는 2021년 세계 최초로 전고체 배터리를 장착한 전기차를 공개하고, 1~2년 내에 양산한다는 목표다.[5]
이외에도 교세라·도레이·무라타·스미토모화학·히타치 등 여러 일본 기업들이 전고체 배터리 개발에 뛰어든 상황이다.[7]
미국[편집]
2017년 11월 15일, 전기차 벤처기업 피스커의 CEO 헨릭 피스커는 리튬 이온 배터리가 아닌 전고체 전지 기술을 개발해 1분 이내 충전으로 800km를 달릴 수 있는 전기차 개발에 성공했다고 밝혔다. 헨릭 피스커는 테슬라 창업에 영감을 준 것으로 유명하다. 2023년 전고체 전지 전기차 모델을 판매할 계획이다..
2019년 1월, 세계 최고 전기차 기업 테슬라가 배터리 명가 맥스웰 테크놀로지를 2억1800만달러(약 2439억원)에 인수했다. 수 년 동안 인수설 소문이 있었다. 그동안 테슬라에 독점적으로 전기차 배터리를 공급했던 일본 파나소닉 배터리에는 비상이 걸렸다. 맥스웰 테크놀로지는 1965년 세워진 배터리 회사로 본사를 미국 샌디에이고에 두고 있다. 테슬라 전기차 공장과 함께 샌프란시스코 베이에어리어에 위치한다. 맥스웰 테크놀로지 배터리 고객으로는 제너럴 모터스(GM)와 람보르기니가 있다. 최근 맥스웰 테크놀로지는 에너지 밀도 300Wh의 전고체 전지를 개발했다.[2]
빌 게이츠 마이크로소프트 창업자와 독일 폭스바겐이 투자한 회사인 전기차 배터리 스타트업 퀀텀스케이프는 2020년 12월 8일 개발 중인 전고체 배터리가 15분 안에 80%를 충전할 수 있는 수준에 이르렀다고 밝혔다. 1회 충전으로 약 300마일(483㎞)을 달릴 수 있고, 수명도 12년에 이른다. 폭스바겐은 2025년께 권텀스케이프의 전고체 배터리를 장착한 전기차를 선보일 계획이다.
삼성·현대자동차가 투자한 미국의 솔리드파워도 2026년께 전고체 배터리를 상용화할 계획이다. [5]포드자동차와 BMW 등으로부터 1억3천만달러(약 1천456억원) 규모의 투자를 추가로 유치했으며 포드와 BMW는 솔리드파워와의 합의에 따라 내년부터 시험용 전고체 배터리를 인도받을 예정이며 BMW는 2025년 이전에 전고체 배터리를 탑재한 시제용 전기차를 출시할 계획인 것으로 전해졌다.[8]
시장 전망[편집]
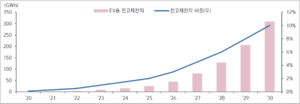
일본 후지경제 연구소는 글로벌 전고체전지 시장이 2035년에 2조 8,000억 엔 규모로 성장할 것으로 전망했다. 이 중 황화물 계열이 2조 1,200억 엔으로 산화물 계열 6,000억 엔을 압도하며 주류를 형성할 것으로 전망했다. SNE Research에 따르면, 전고체전지를 탑재한 전기차는 2030년 200만 대로 전기차 시장의 10%를 차지할 전망이다. 전망이다.[3]
각주[편집]
- ↑ 〈전고체 전지〉, 《한경 경제용어사전》,
- ↑ 2.0 2.1 2.2 2.3 〈전고체 전지〉, 《위키백과》,
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 3.8 3.9 spainorange, 〈키움증권 차세대 배터리 - (3) Post Lib(전고체전지, 리튬황전지, 리튬공기전지 〉, 《네이버블로그》, 2019-08-06
- ↑ 송기영 기자, 〈"이젠 초격차 전략 뿐"... ‘폭스바겐 쇼크’에 주목받는 전고체 배터리〉, 《조선비즈》, 2021-03-19
- ↑ 5.0 5.1 5.2 황정일 기자, 〈10분 완충에 500㎞ 주행, 한·미·일 전고체 배터리 삼국지〉, 《중앙일보》, 2021-01-02
- ↑ 윤건일 김지웅 기자, 〈배터리 데이 2021 LG엔솔 "차세대 '리튬황·전고체 배터리' 2025년부터 출격"〉, 《전자신문》, 2021-04-28
- ↑ 7.0 7.1 박민규 기자, 〈전고체 배터리가 '꿈의 전지'인 이유…상용화 과제는?〉, 《이코노믹리뷰》, 2021-02-23
- ↑ 이귀원 기자, 〈전고체 배터리 솔리드파워, 포드·BMW 등 투자 유치〉, 《연합뉴스》, 2021-05-04
참고자료[편집]
- 〈전고체 전지〉, 《한경 경제용어사전》
- 〈전고체 전지〉, 《위키백과》
- 구본혁 기자, 〈폭발위험 없는 꿈의 배터리 ‘전고체전지’ 대량생산길 열렸다!〉, 《헤럴드경제》, 2021-02-22
- 이귀원 기자, 〈전고체 배터리 솔리드파워, 포드·BMW 등 투자 유치〉, 《연합뉴스》, 2021-05-04
- 박민규 기자, 〈전고체 배터리가 '꿈의 전지'인 이유…상용화 과제는?〉, 《이코노믹리뷰》, 2021-02-23
- 윤건일 김지웅 기자, 〈배터리 데이 2021 LG엔솔 "차세대 '리튬황·전고체 배터리' 2025년부터 출격"〉, 《전자신문》, 2021-04-28
- 송기영 기자, 〈"이젠 초격차 전략 뿐"... ‘폭스바겐 쇼크’에 주목받는 전고체 배터리〉, 《조선비즈》, 2021-03-19
같이 보기[편집]

 위키원
위키원