"리튬 망간 배터리"의 두 판 사이의 차이
(새 문서: '''LMO'''((Lithium manganese oxide batteries)는 망간이산화물을 음극 물질로 사용하는 리튬이온 배터리이다. 일반적으로 '''리튬이온 망간 배터...) |
잔글 (→같이 보기) |
||
| (사용자 2명의 중간 판 23개는 보이지 않습니다) | |||
| 1번째 줄: | 1번째 줄: | ||
| + | '''리튬 망간 배터리'''<!--리튬망간 배터리, 리튬망간배터리-->는 [[망간]] 산화물을 [[양극재]]로 사용하는 [[리튬이온 배터리]]이다. 일반적으로 '''리튬이온 망가니즈 배터리'''<!--리튬이온 망간 배터리-->(lithium-ion manganese batteries) 또는 '''망간 스피넬'''(manganese spinel)이라고 불린다. 영어 약자를 사용하여, '''[[LMO]]'''(Lithium Manganese Oxide) 배터리라고도 부른다. 리튬 망간 배터리는 1980년대에 발견되었지만 리튬 망간을 양극재로 만든 최초의 상용 리튬이온 배터리는 1996년에 생산되었다. [[LiCoO₂]]와 같은 상용화된 2차전지 기술과 동일한 인터칼레이션/디칼레이션 메커니즘을 통해 작동한다. | ||
| − | + | 리튬 망간 배터리(LMO)는 [[리튬 코발트 배터리]](LCO)에서 양극재인 [[코발트]]를 [[망간]]으로 바꾼 배터리라고 생각하면 쉽다. 망간은 코발트에 비해 가격이 매우 싸며, 망간 광산이 고루 분포한 편이라 공급 불안정에 대한 우려도 크지 않다. 리튬 망간 배터리(LMO)는 [[리튬인산철]](LFP) 배터리와 장단점이 비슷하다. 가격 매력과 안정성이 높은 반면, [[에너지 밀도]]가 낮다. [[리튬인산철]] 배터리는 중국 전기차·배터리 시장에서라도 높은 비중을 점하고 있지만, 리튬 망간 배터리(LMO)의 경우 전기차용 배터리 시장에서 인기를 얻지 못하고 있다. SNE리서치에 따르면 리튬 망간 배터리는 현재 전기차용 배터리 산업에서 주로 블렌딩, 즉 다른 소재들을 섞는 데 첨가하는 용도로 쓰이고 있다. 리튬 망간 배터리(LMO)는 [[NCM]] 등 [[하이니켈]] 양극재와 블렌딩돼, 안정성을 보완하는 역할을 한다.<ref>박민규 기자, 〈[https://www.econovill.com/news/articleView.html?idxno=413890 ER궁금증 이차 전지의 핵심, 양극재는 무엇?]〉, 《이코노믹리뷰》, 2020-10-03</ref> | |
| + | |||
| + | == 화합물 == | ||
| + | === 리튬 망간 산화물(LMO, LiMnO2) === | ||
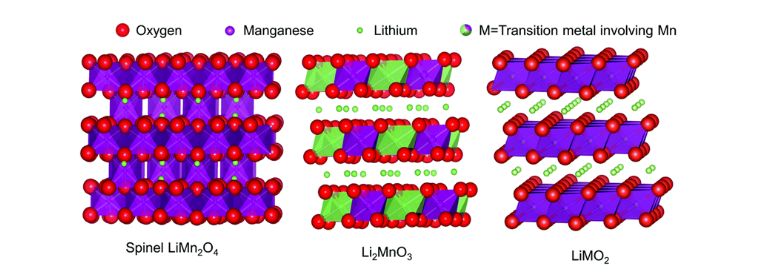
| + | 리튬 망간 산화물(LMO LiMnO2)은 나머지 두 양극 소재(LCO, LNO) 대비 훨씬 저렴하며 우수한 열적 안정성을 가진 양극 소재이다. 하지만 이 물질은 열역학적으로 안정한 상태의 물질이 아니라 통상 사용하는 고온 열처리 공정의 적용이 어려워 이온 치환공정을 통해 합성해야 한다. 이러한 합성 공정의 특수성 때문에 전기화학적 활성이 떨어져 충전 및 방전 과정에서 리튬이온의 탈리와 삽입이 제한적이라는 단점이 있다. 이는 문제는 망간이 산화환원 반응에 직접 참여할 수 없기 때문에 일어나는 현상으로 알려져 있다.<ref name="양극">이호림, 〈[https://luvlyday.tistory.com/99 리튬이온배터리 양극 활물질에 대해]〉, 《티스토리》, </ref> | ||
| + | |||
| + | [[파일:다양한 구조를 가지는 리튬망간 산화물.png|썸네일|800픽셀|가운데|다양한 구조를 가지는 리튬망간 산화물]] | ||
| + | |||
| + | === 스피넬 화합물(LiMn₂O₄) === | ||
| + | [[파일:리튬망간 구조.png|썸네일|300픽셀|오른쪽|리튬망간 구조]] | ||
| + | [[파일:순수한 리튬 망간 배터리의 스냅 샷.png|썸네일|300픽셀|오른쪽|리튬 망간 배터리의 스냅 샷]] | ||
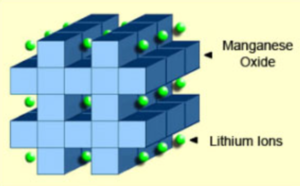
| + | 망간 스피넬이 포함된 리튬이온은 1983년 세계적인 논문 학술지인 머티어리얼 리서치 블리틴(Materials Research Bulletin)에 처음 발표되었다. 1996년 캐나다의 전지회사인 몰리에너지(Moli Energy)는 리튬 망간 산화물을 양극 재료로 사용한 리튬이온 배터리를 상용화했다. 이 아키텍처는 전극의 이온 흐름을 개선하는 3차원 스피넬 구조를 형성하여 내부 저항을 낮추고 전류 처리를 개선한다. 스피넬의 또 다른 장점은 높은 열 안정성과 향상된 안전성이지만 주기 및 달력 수명이 제한된다. | ||
| + | |||
| + | 낮은 내부 셀 저항으로 고속 충전 및 고전류 방전이 가능하다. 18650 패키지에서 리튬-망간은 적당한 열 축적과 함께 20-30A의 전류로 방전 될 수 있다. 최대 50A의 1초 부하 펄스를 적용 할 수도 있다. 이 전류에서 지속적으로 높은 부하가 발생하면 열이 축적되고 셀 온도는 80°C (176° F)를 초과 할 수 없다. 리튬 망간은 전동 공구, 의료 기기, 하이브리드 및 전기 자동차에 사용된다. | ||
| + | |||
| + | 오른쪽 그림은 리튬-망간 배터리의 음극에 3차원 결정 프레임 워크의 형성을 보여준다. 일반적으로 격자로 연결된 다이아몬드 모양으로 구성된 이 스피넬 구조는 초기 형성 후에 나타난다. | ||
| + | |||
| + | 리튬 망간 산화물의 음극 결정 형성은 초기 형성 후 나타나는 3차원 골격 구조를 가지고 있다. 스피넬은 낮은 저항을 제공하지만 코발트보다 더 적당한 비 에너지를 가지고 있다. 리튬 망간은 리튬 코발트보다 약 3분의 1 정도 낮은 용량을 가지고 있다. 설계 유연성을 통해 엔지니어는 최적의 수명(수명), 최대 부하 전류(비 전력) 또는 고용량(비 에너지)을 위해 배터리를 최대화 할 수 있다. 예를 들어, 18650 셀의 긴 수명 버전은 용량이 보통 1,100mAh에 불과하다. 고용량 버전은 1,500mAh이다. | ||
| + | |||
| + | 오른쪽 그림은 일반적인 리튬 망간 배터리의 스냅샷을 보여준다. 특성은 미미한 것처럼 보이지만 새로운 디자인은 비 출력, 안전성 및 수명 측면에서 개선되었다. | ||
| + | |||
| + | 전반적인 성능은 적당하지만 새로운 리튬 망간 디자인은 특정 전력, 안전 및 수명을 향상시킨다. 대부분의 리튬 망간 배터리는 리튬 니켈 망간 코발트 산화물(NMC)과 혼합되어 비 에너지를 개선하고 수명을 연장한다. 이 조합은 각 시스템에서 최고를 이끌어 내며 LMO(NMC)는 닛산 '''[[리프]]'''(Leaf), '''[[쉐보레 볼트]]'''(Chevy Volt) 및 '''[[BMW I3]]'''와 같은 대부분의 전기 자동차에 선택되었다. 배터리의 LMO 부분은 약 30%로 가속 시 높은 전류 부스트를 제공한다. NMC 부분은 긴 주행거리를 제공한다. | ||
| + | |||
| + | 리튬 이온 연구는 리튬 망간과 코발트, 니켈, 망간 및 또는 알루미늄을 활성 음극 물질로 결합하는 데 집중하고 있다. 일부 아키텍처에서는 소량의 실리콘이 양극에 추가된다. 이렇게 하면 용량이 25% 향상된다. 그러나 이득은 일반적으로 실리콘이 충전 및 방전과 함께 성장 및 축소되어 기계적 스트레스를 유발함에 따라 더 짧은 사이클 수명과 연결된다. | ||
| + | |||
| + | 이러한 세 가지 활성 금속과 실리콘 강화를 편리하게 선택하여 비 에너지(용량), 비 전력(부하 용량) 또는 수명을 강화할 수 있다. 소비자 용 배터리는 고용량을 사용하는 반면, 산업용 애플리케이션에는 우수한 로딩 기능이 있고 수명이 길며 안전하고 신뢰할 수 있는 서비스를 제공하는 배터리 시스템이 필요하다.<ref>주아기프트, 〈[https://blog.naver.com/jooanet123/222133210396 다양한 리튬 이온 배터리 유형]〉, 《네이버 블로그》, 2020-11-09</ref> | ||
| + | |||
| + | ==== 특성 ==== | ||
| + | * 전압 : 3.70V (3.80V) 공칭; 일반적인 작동 범위 3.0–4.2V / 셀 | ||
| + | * 특정 에너지 (용량) : 100 ~ 150Wh / kg | ||
| + | * 요금 (C-rate) : 0.7–1C 일반, 3C 최대, 4.20V까지 충전 (대부분의 셀) | ||
| + | * 방전 (C-rate) : 1C; 일부 셀에서 10C 가능, 30C 펄스 (5s), 2.50V 차단 | ||
| + | * 주기 생활 : 300–700 (방전 깊이, 온도 관련) | ||
| + | * 열 폭주 : 250 ° C (482 ° F) 일반. 높은 전하가 열 폭주를 촉진한다. | ||
| + | * 응용 : 전동 공구, 의료 기기, 전기 파워 트레인 | ||
| + | |||
| + | === 리튬과잉산화물 === | ||
| + | 2019년 노벨 화학상을 받은 텍사스 오스틴 대학의 구디너프 교수에 의해 개발된 양극 재료로 현재까지 발견된 양극 물질 중 가장 우수한 용량 특성을 가진 소재이다. 리튬 과잉 산화물은 리튬 금속 산화물인 LiMO₂와 Li₂MnO₃가 혼합되어 있는 고용체로 250 mAhg 이상의 우수한 용량과 3.5 V 이상의 높은 작동전압을 가지고 있다. 이러한 높은 용량은 LiMO | ||
| + | ₂의 층상구조 내 리튬 이온이 존재할 뿐 아니라 Li₂MnO₃의 전이금속 층에도 리튬 이온이 존재할 수 있기 때문이다. | ||
| + | |||
| + | 하지만 첫 충전 시 매우 높은 비가역적 용량 손실을 보인다는 문제가 있다. 첫 충전 과정 중 Li₂MnO₃의 리튬이 탈리되면서 MnO3로 변환되는데 MnO₃는 화학적 당량을 맞추기 위해 산소를 방출시키며 MnO₂를 형성한다. 이 과정에서 리튬 이온이 삽입될 수 있는 많은 자리가 없어지며 비가역적인 용량의 손실이 발생한다. 또한 리튬 과잉 산화물은 2D percolating network를 가지는 구조적인 특징 때문에 전기 전도도가 부도체에 가까운 ~ 10 -11 Scm로 매우 낮다는 문제가 있다. LiCoO₂의 전기 전도도는 ~ 10-4 Scm임 특히 Crate가 큰 상황에서는 분극에 의한 높은 저항으로 인해 성능감소가 심각해 고속 충방전에 사용하기 어려운 한계가 있다.<ref name="양극"></ref> | ||
| + | |||
| + | == 장점 == | ||
| + | * 다른 리튬이온 유형에 비해 열 안정성이 높기 때문에 코발트 시스템보다 안전 회로가 덜 필요하다. 빠른 충전과 고전류 방전에 도움이 되는 낮은 내부 셀 저항으로 인해 높은 속도 성능을 제공한다. | ||
| + | |||
| + | == 단점 == | ||
| + | 코발트 기반 시스템에 비해 용량은 낮지만 에너지 밀도는 니켈 기반 시스템보다 거의 50% 높다. | ||
| + | |||
| + | {{각주}} | ||
== 참고자료 == | == 참고자료 == | ||
* "[https://en.wikipedia.org/wiki/Lithium_ion_manganese_oxide_battery Lithium ion manganese oxide battery]", ''Wikipedia'' | * "[https://en.wikipedia.org/wiki/Lithium_ion_manganese_oxide_battery Lithium ion manganese oxide battery]", ''Wikipedia'' | ||
* Niclas, "[https://sinovoltaics.com/learning-center/storage/lmo-batteries/ LMO Batteries]", ''SINO VOLTAICS'' | * Niclas, "[https://sinovoltaics.com/learning-center/storage/lmo-batteries/ LMO Batteries]", ''SINO VOLTAICS'' | ||
| + | * 박민규 기자, 〈[https://www.econovill.com/news/articleView.html?idxno=413890 ER궁금증 이차 전지의 핵심, 양극재는 무엇?]〉, 《이코노믹리뷰》, 2020-10-03 | ||
== 같이 보기 == | == 같이 보기 == | ||
| + | * [[리튬]] | ||
| + | * [[망간]] | ||
| + | * [[배터리]] | ||
| + | * [[리튬이온]] | ||
* [[리튬이온 배터리]] | * [[리튬이온 배터리]] | ||
| + | * [[LMO]] | ||
| + | * [[LFP]] | ||
| + | * [[LCO]] | ||
| + | |||
| + | {{배터리|검토 필요}} | ||
2021년 9월 17일 (금) 00:17 기준 최신판
리튬 망간 배터리는 망간 산화물을 양극재로 사용하는 리튬이온 배터리이다. 일반적으로 리튬이온 망가니즈 배터리(lithium-ion manganese batteries) 또는 망간 스피넬(manganese spinel)이라고 불린다. 영어 약자를 사용하여, LMO(Lithium Manganese Oxide) 배터리라고도 부른다. 리튬 망간 배터리는 1980년대에 발견되었지만 리튬 망간을 양극재로 만든 최초의 상용 리튬이온 배터리는 1996년에 생산되었다. LiCoO₂와 같은 상용화된 2차전지 기술과 동일한 인터칼레이션/디칼레이션 메커니즘을 통해 작동한다.
리튬 망간 배터리(LMO)는 리튬 코발트 배터리(LCO)에서 양극재인 코발트를 망간으로 바꾼 배터리라고 생각하면 쉽다. 망간은 코발트에 비해 가격이 매우 싸며, 망간 광산이 고루 분포한 편이라 공급 불안정에 대한 우려도 크지 않다. 리튬 망간 배터리(LMO)는 리튬인산철(LFP) 배터리와 장단점이 비슷하다. 가격 매력과 안정성이 높은 반면, 에너지 밀도가 낮다. 리튬인산철 배터리는 중국 전기차·배터리 시장에서라도 높은 비중을 점하고 있지만, 리튬 망간 배터리(LMO)의 경우 전기차용 배터리 시장에서 인기를 얻지 못하고 있다. SNE리서치에 따르면 리튬 망간 배터리는 현재 전기차용 배터리 산업에서 주로 블렌딩, 즉 다른 소재들을 섞는 데 첨가하는 용도로 쓰이고 있다. 리튬 망간 배터리(LMO)는 NCM 등 하이니켈 양극재와 블렌딩돼, 안정성을 보완하는 역할을 한다.[1]
목차
화합물[편집]
리튬 망간 산화물(LMO, LiMnO2)[편집]
리튬 망간 산화물(LMO LiMnO2)은 나머지 두 양극 소재(LCO, LNO) 대비 훨씬 저렴하며 우수한 열적 안정성을 가진 양극 소재이다. 하지만 이 물질은 열역학적으로 안정한 상태의 물질이 아니라 통상 사용하는 고온 열처리 공정의 적용이 어려워 이온 치환공정을 통해 합성해야 한다. 이러한 합성 공정의 특수성 때문에 전기화학적 활성이 떨어져 충전 및 방전 과정에서 리튬이온의 탈리와 삽입이 제한적이라는 단점이 있다. 이는 문제는 망간이 산화환원 반응에 직접 참여할 수 없기 때문에 일어나는 현상으로 알려져 있다.[2]
스피넬 화합물(LiMn₂O₄)[편집]
망간 스피넬이 포함된 리튬이온은 1983년 세계적인 논문 학술지인 머티어리얼 리서치 블리틴(Materials Research Bulletin)에 처음 발표되었다. 1996년 캐나다의 전지회사인 몰리에너지(Moli Energy)는 리튬 망간 산화물을 양극 재료로 사용한 리튬이온 배터리를 상용화했다. 이 아키텍처는 전극의 이온 흐름을 개선하는 3차원 스피넬 구조를 형성하여 내부 저항을 낮추고 전류 처리를 개선한다. 스피넬의 또 다른 장점은 높은 열 안정성과 향상된 안전성이지만 주기 및 달력 수명이 제한된다.
낮은 내부 셀 저항으로 고속 충전 및 고전류 방전이 가능하다. 18650 패키지에서 리튬-망간은 적당한 열 축적과 함께 20-30A의 전류로 방전 될 수 있다. 최대 50A의 1초 부하 펄스를 적용 할 수도 있다. 이 전류에서 지속적으로 높은 부하가 발생하면 열이 축적되고 셀 온도는 80°C (176° F)를 초과 할 수 없다. 리튬 망간은 전동 공구, 의료 기기, 하이브리드 및 전기 자동차에 사용된다.
오른쪽 그림은 리튬-망간 배터리의 음극에 3차원 결정 프레임 워크의 형성을 보여준다. 일반적으로 격자로 연결된 다이아몬드 모양으로 구성된 이 스피넬 구조는 초기 형성 후에 나타난다.
리튬 망간 산화물의 음극 결정 형성은 초기 형성 후 나타나는 3차원 골격 구조를 가지고 있다. 스피넬은 낮은 저항을 제공하지만 코발트보다 더 적당한 비 에너지를 가지고 있다. 리튬 망간은 리튬 코발트보다 약 3분의 1 정도 낮은 용량을 가지고 있다. 설계 유연성을 통해 엔지니어는 최적의 수명(수명), 최대 부하 전류(비 전력) 또는 고용량(비 에너지)을 위해 배터리를 최대화 할 수 있다. 예를 들어, 18650 셀의 긴 수명 버전은 용량이 보통 1,100mAh에 불과하다. 고용량 버전은 1,500mAh이다.
오른쪽 그림은 일반적인 리튬 망간 배터리의 스냅샷을 보여준다. 특성은 미미한 것처럼 보이지만 새로운 디자인은 비 출력, 안전성 및 수명 측면에서 개선되었다.
전반적인 성능은 적당하지만 새로운 리튬 망간 디자인은 특정 전력, 안전 및 수명을 향상시킨다. 대부분의 리튬 망간 배터리는 리튬 니켈 망간 코발트 산화물(NMC)과 혼합되어 비 에너지를 개선하고 수명을 연장한다. 이 조합은 각 시스템에서 최고를 이끌어 내며 LMO(NMC)는 닛산 리프(Leaf), 쉐보레 볼트(Chevy Volt) 및 BMW I3와 같은 대부분의 전기 자동차에 선택되었다. 배터리의 LMO 부분은 약 30%로 가속 시 높은 전류 부스트를 제공한다. NMC 부분은 긴 주행거리를 제공한다.
리튬 이온 연구는 리튬 망간과 코발트, 니켈, 망간 및 또는 알루미늄을 활성 음극 물질로 결합하는 데 집중하고 있다. 일부 아키텍처에서는 소량의 실리콘이 양극에 추가된다. 이렇게 하면 용량이 25% 향상된다. 그러나 이득은 일반적으로 실리콘이 충전 및 방전과 함께 성장 및 축소되어 기계적 스트레스를 유발함에 따라 더 짧은 사이클 수명과 연결된다.
이러한 세 가지 활성 금속과 실리콘 강화를 편리하게 선택하여 비 에너지(용량), 비 전력(부하 용량) 또는 수명을 강화할 수 있다. 소비자 용 배터리는 고용량을 사용하는 반면, 산업용 애플리케이션에는 우수한 로딩 기능이 있고 수명이 길며 안전하고 신뢰할 수 있는 서비스를 제공하는 배터리 시스템이 필요하다.[3]
특성[편집]
- 전압 : 3.70V (3.80V) 공칭; 일반적인 작동 범위 3.0–4.2V / 셀
- 특정 에너지 (용량) : 100 ~ 150Wh / kg
- 요금 (C-rate) : 0.7–1C 일반, 3C 최대, 4.20V까지 충전 (대부분의 셀)
- 방전 (C-rate) : 1C; 일부 셀에서 10C 가능, 30C 펄스 (5s), 2.50V 차단
- 주기 생활 : 300–700 (방전 깊이, 온도 관련)
- 열 폭주 : 250 ° C (482 ° F) 일반. 높은 전하가 열 폭주를 촉진한다.
- 응용 : 전동 공구, 의료 기기, 전기 파워 트레인
리튬과잉산화물[편집]
2019년 노벨 화학상을 받은 텍사스 오스틴 대학의 구디너프 교수에 의해 개발된 양극 재료로 현재까지 발견된 양극 물질 중 가장 우수한 용량 특성을 가진 소재이다. 리튬 과잉 산화물은 리튬 금속 산화물인 LiMO₂와 Li₂MnO₃가 혼합되어 있는 고용체로 250 mAhg 이상의 우수한 용량과 3.5 V 이상의 높은 작동전압을 가지고 있다. 이러한 높은 용량은 LiMO ₂의 층상구조 내 리튬 이온이 존재할 뿐 아니라 Li₂MnO₃의 전이금속 층에도 리튬 이온이 존재할 수 있기 때문이다.
하지만 첫 충전 시 매우 높은 비가역적 용량 손실을 보인다는 문제가 있다. 첫 충전 과정 중 Li₂MnO₃의 리튬이 탈리되면서 MnO3로 변환되는데 MnO₃는 화학적 당량을 맞추기 위해 산소를 방출시키며 MnO₂를 형성한다. 이 과정에서 리튬 이온이 삽입될 수 있는 많은 자리가 없어지며 비가역적인 용량의 손실이 발생한다. 또한 리튬 과잉 산화물은 2D percolating network를 가지는 구조적인 특징 때문에 전기 전도도가 부도체에 가까운 ~ 10 -11 Scm로 매우 낮다는 문제가 있다. LiCoO₂의 전기 전도도는 ~ 10-4 Scm임 특히 Crate가 큰 상황에서는 분극에 의한 높은 저항으로 인해 성능감소가 심각해 고속 충방전에 사용하기 어려운 한계가 있다.[2]
장점[편집]
- 다른 리튬이온 유형에 비해 열 안정성이 높기 때문에 코발트 시스템보다 안전 회로가 덜 필요하다. 빠른 충전과 고전류 방전에 도움이 되는 낮은 내부 셀 저항으로 인해 높은 속도 성능을 제공한다.
단점[편집]
코발트 기반 시스템에 비해 용량은 낮지만 에너지 밀도는 니켈 기반 시스템보다 거의 50% 높다.
각주[편집]
- ↑ 박민규 기자, 〈ER궁금증 이차 전지의 핵심, 양극재는 무엇?〉, 《이코노믹리뷰》, 2020-10-03
- ↑ 2.0 2.1 이호림, 〈리튬이온배터리 양극 활물질에 대해〉, 《티스토리》,
- ↑ 주아기프트, 〈다양한 리튬 이온 배터리 유형〉, 《네이버 블로그》, 2020-11-09
참고자료[편집]
- "Lithium ion manganese oxide battery", Wikipedia
- Niclas, "LMO Batteries", SINO VOLTAICS
- 박민규 기자, 〈ER궁금증 이차 전지의 핵심, 양극재는 무엇?〉, 《이코노믹리뷰》, 2020-10-03
같이 보기[편집]

 위키원
위키원