"에테인"의 두 판 사이의 차이
(새 문서: 썸네일|300픽셀|오른쪽|에테인 구조 '''에테인'''(ethane)은 두 개의 탄소(carbon)와 여섯 개의 수소(hydrogen)로 이루어진...) |
잔글 |
||
| 1번째 줄: | 1번째 줄: | ||
[[파일:에테인.png|썸네일|300픽셀|오른쪽|에테인 구조]] | [[파일:에테인.png|썸네일|300픽셀|오른쪽|에테인 구조]] | ||
| − | '''에테인'''(ethane)은 두 개의 [[탄소]](carbon)와 여섯 개의 [[수소]](hydrogen)로 이루어진 [[탄화수소]]이다. 화학식은 C₂H₆이며, [[알케인]](alkane) 화합물의 일종이다. 상온에서 무색무취의 기체. 녹는점은 -184℃이고, 끓는점은 -89℃이다. 이성질체는 없다. 일반적으로 에테인은 천연가스(natural gas)로부터 대량으로 얻거나, 정유 과정에서 얻어진다. | + | |
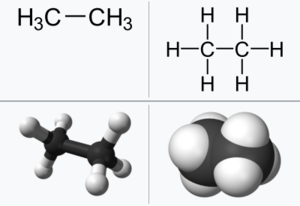
| + | '''에테인'''(ethane) 또는 '''에탄'''은 두 개의 [[탄소]](carbon)와 여섯 개의 [[수소]](hydrogen)로 이루어진 [[탄화수소]]이다. 화학식은 C₂H₆이며, [[알케인]](alkane) 화합물의 일종이다. 상온에서 무색무취의 기체. 녹는점은 -184℃이고, 끓는점은 -89℃이다. 이성질체는 없다. 일반적으로 에테인은 천연가스(natural gas)로부터 대량으로 얻거나, 정유 과정에서 얻어진다. | ||
== 개요 == | == 개요 == | ||
| 37번째 줄: | 38번째 줄: | ||
== 같이 보기 == | == 같이 보기 == | ||
| + | * [[에탄올]] | ||
* [[메테인]] | * [[메테인]] | ||
* [[에틸렌]] | * [[에틸렌]] | ||
2021년 8월 31일 (화) 21:13 판
에테인(ethane) 또는 에탄은 두 개의 탄소(carbon)와 여섯 개의 수소(hydrogen)로 이루어진 탄화수소이다. 화학식은 C₂H₆이며, 알케인(alkane) 화합물의 일종이다. 상온에서 무색무취의 기체. 녹는점은 -184℃이고, 끓는점은 -89℃이다. 이성질체는 없다. 일반적으로 에테인은 천연가스(natural gas)로부터 대량으로 얻거나, 정유 과정에서 얻어진다.
개요
에테인은 독성은 없지만, 다른 가벼운 알케인들처럼 가연성, 폭발성이 있으므로 누출되면 위험하다.
주로 천연가스에서 얻어진다. 사실 천연가스에서 두 번째로 많은 성분이긴 한데, 가장 많은 성분인 메테인이 70~90%를 차지해서 에테인의 비율은 그리 높지 않다. 예전에는 그냥 연료 역할이나 하라고 굳이 분리해 내지 않고 내버려뒀었다. 메테인보다 끓는 점이 높기 때문에 극저온으로 냉각하면 메테인으로부터 효율적으로 분리해 낼 수 있다. 천연가스 외에도 원유를 정제하는 과정에서 얻을 수 있다.
에테인의 가장 큰 용도는 에틸렌 제조의 원료로 사용하는 것이다. 에틸렌은 폴리에틸렌 수지의 원료로 쓰이며, 다른 활용도도 많은 물질이다. 에테인을 고온으로 가열하면 탄화수소 분자들이 분해 및 재결합되어서 에틸렌이 생성된다.
역사
에테인은 1834년 패러데이(Michael Faraday)에 의해 최초로 합성되었다. 그는 아세트산 포타슘(potassium acetate)의 전기분해 과정에서 에테인을 얻었다. 아세트산염(acetic acid salt) 액체의 전기분해는 양극에서 아세트산염이 산화되어 이산화 탄소(carbon dioxide)와 메틸 라디칼(methyl radical)이 생성되는데, 메틸 라디칼은 서로 결합하여 에테인을 생성한다.
CH₃Coo⁻ → CH₃· + CO₂ + e⁻
CH₃· + ·CH₃→ C₂H₆
마이클 패러데이(1791~1867)는 전자기학과 전기화학(electrochemistry) 분야에 큰 기여를 한 영국의 물리학자이자 화학자이다. 물리학자로서 전자기장(electromagnetic field)에 대한 기본적인 개념을 확립하고 전자기 유도, 반자성 현상, 전기분해에 관한 법칙도 수립하였다.
화학자로서 벤젠(benzene)을 발견하였으며 양극, 음극, 전극, 이온과 같은 용어를 처음으로 도입하였다. 1847년과 1849년에는 콜베(Hermann Kolbe)와 프랭클랜드(Edward Frankland)가 프로페인나이트릴(propane nitrile)과 아이오딘화 에틸(ethyl iodide)의 전기분해 반응을 통해 에테인을 얻었다. 하지만 이들 모두는 에테인을 메테인(methane, CH4)으로 착각하였으며, 1864년 스콜머(Carl Schorlemmer)가 그 생성물이 메테인이 아니라 에테인임을 확인하였다.
구조 및 화학적 특성
에테인은 탄화수소(hydrocarbon)의 일종으로, 각 탄소는 단일 결합(single bond)으로 연결되어 있으며, 구조상 이성질체(isomer)는 존재할 수 없다. 탄소-탄소(C-C) 결합은 두 sp3 오비탈(orbital)의 겹쳐짐으로 이루어지며, 탄소-수소(C-H) 결합은 탄소의 sp3 오비탈과 수소의 s 오비탈 겹쳐짐으로 이루어진다.
분자량은 30.07 g/mol이며, 녹는점은 -181.76 °C, 끊는점은 섭씨 -89 °C로써 표준 온도 압력(STP)에서 기체로 존재한다. 인화성, 폭발성은 있지만 화학적 활성은 낮다. 탄소와 수소의 전기음성도(electronegativity) 차이가 작아 탄소-수소 결합의 극성이 작고 분자가 대칭적 분자 구조를 가지기 때문에 비극성 분자(nonpolar molecule)로 간주된다.
에테인의 사용
에테인은 지구 대기에 기체 상태로 미량 존재하며, 온실 가스의 한 종류이다. 에테인은 천연 가스 중에 메테인(87~98%)에 이어 두 번째로 많은 성분(1.5~9%)이다. 에테인은 주로 열분해 반응을 통한 에틸렌(ethylene)을 생성하는데 사용되며, 에틸렌은 주로 가스 절단 및 용접, 그리고 각종 화합물의 원료로 사용된다.
에테인은 그외에 다양한 석유 화학제품의 제조, 약물의 합성 원료, 할로젠 화합물의 제조 원료로 사용한다. 일부 극저온 냉동 시스템의 냉매로도 활용된다. 의학적으로 높은 온도에서는 마취작용이 있음이 보고되었다.
최근에는 석유화학 산업의 주 원료이던 나프타(naphtha) 대신 저가의 에테인 가스를 원료로 하는 석유화학 공장 건설이 증가하고 있다. 연소 반응의 경우, 약 1559.7 kJ/mol (51.9 kJ/g)의 열을 발생하며, 이산화 탄소 및 물을 부가물로 생성한다.
참고자료
같이 보기

 위키원
위키원