수은전지(酸化水銀電池, mercury cell, mercury oxide cell, Quecksilberoxydzelle) 미국의 S.루벤에 의해 1947년 고안되어 P.R.맬로리사(社)에 의해서 제조된 1차전지이다. 루벤전지 ·RM전지 ·수은건전지, 아연/산화수은전지라고도 한다. 모양이 작은 단추처럼 생겼다고 해서 일명 단추전지라고도 부른다. 소형으로 만들 수 있기 때문에 보청기, 휴대용 라디오, 테이프리코더, 무선마이크나 카메라의 노출계 등에 널리 사용되고 있다. 음전극에 아연, 양전극에 산화수은, 전해액에 산화아연과 수산화칼륨을 사용한다.
기전력은 사용하는 동안 거의 일정하며 약 1.35 V이다. 소형으로 전기용량이 큰 것을 만들 수 있고, 사용 중 전압이 일정하며, 고온, 예를 들면 100 ℃에서도 완전히 사용할 수 있다. 자체 방전이 적어, 제조 후 1년 정도 경과하더라도 용량이 거의 감소하지 않는 등의 특징이 있다. 모양은 편평한 것과 원통형이 있다.
수은전지는 내용물 유출 시에 수은이 환경오염을 일으킬 수 있기 때문에 90년대 이후에 사용 금지되어 있고, 전 세계적으로도 생산하는 국가가 현재는 없다. 현재는 수은전지의 역할은 동일한 형태의 알칼라인이나 산화은(Ag2O) 전지로 전부 대체되었다.
수은전지는 산화수은을 양극 활물질로 하고, 수산화 칼륨 또는 수산화 나트륨 수용액을 전해액으로 하며, 아연을 음극 활 물질로 사용하고 있다. 1942년 미국의 루벤에 의해 발명되었고, 미국의 PR 말로리 사에 의해서 생산이 시작되었다. 1965년 내쇼날 말로리 전지(후에 마쓰시다 마이크로 전지로 개칭) 를 설립하여 생산을 본격화하였다. 또 1980년에 전해 산화법에 의한 고밀도 산화수은이 개발되어 수은전지의 고성능화가 한층 진전되었다. 아연을 음극으로 하는 1차전지 가운데서도 대단히 높은 에너지 밀도를 가지며, 또 뛰어난 전압 안정성으로 1960~1970년대의 소형 일렉트로닉스 기기의 주요 전원으로서 사용되었다. 그러나 1980년대의 수은의 공해에 대한 이미지 때문에 사용이 억제되었다. 수은 전지의 용도의 80% 이상을 점유한 보청기용 전지의 생산을 1993년 말로 중지하고, 보청기용은 공기 전지로 대체했다. 따라서 1995년말에는 수은 전지의 생산은 전면적으로 중지되었다.
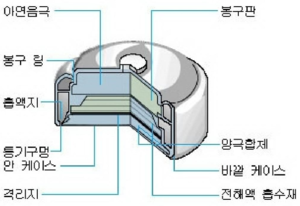
재료와 구조[편집]
수은전지의 양극합제는 1.35V와 1.4V의 2조류의 조성으로 크게 나누어진다. NR 타입의 양극은 산화 제2수은과 흑연에 다시 이산화망간을 가한것이다. 전해법에 의한 산화수은의 겉보기 밀도는, 지금까지 사용해 왔던 건식법 산화수은과 비교해서 약 1.7배인 5.0~5.5g/cm3 이기 때문에, 전지 용적중의 양극 합제의 충전량을 증대시킬 수가 있고 전기용량도 증대한다. 음극 아연은 기상 아토마이즈법으로 제조한 아연 입(입도 100~300um) 을 수은으로 아말감하고 또 CMC를 1~2% 첨가하여 겔상으로 사용한다. 또 아말감화 한, 아연입을 가압하여 다공체의 원통상으로 성형하여 사용하는 경우도 있다. 세퍼레이터는 함액성이 뛰어난 비닐론이나 알파화 펄프를 원료로 하였다.
내 알칼리성의 부직포와 방전시에 발생되는 미립 수은의 투과 방지를 목적으로 한 재료가 사용된다. 전해액은 산화 아연을 포화 가까이 용해한 수산화 칼륨 수용액 (농도35~40%) 또는 수산화 나트륨 수용액 (농도 30~35%) 이다. 상기 재료는 용도 또는 구조에 따라 재질, 가공 방법이 결정된다.[1]
수은 전지는 방전 전압의 평탄성이 특히 뛰어난 특징을 살려, 측정 기기의 기준전원이나 카메라의 노출계용 전원으로서 쓰여왔다. 또 소형이면서 대용량이기 때문에 소형 라디오, 무선 마이크 등에도 쓰이나, 그 중에서도 소형 보청기의 전원으로서 중요한 역할을 해왔다. 그러나 환경에 대한 문제와 자원의 유효 활용면에서 사용랴의 약 80%인 보청기용은 전기 용량이 보다 큰, 공기 전지로 대체가 진행되고, 카메라용도 산화은전지나 리튬전지가 그 주류가 되었다.[1]
전지반응[편집]
수은전지의 반응식은 아래와 같다.
- 음극에서의 반응은 Zn + 2OH : ZnO + H²O + 2e⁻
- 양극에서의 반응은 HgO + H²O + 2e⁻ : Hg + 2OH⁻
- 전체 반응식은 Zn + HgO : ZnO + Hg
식에서 분명한 바와 같이, 방전 반응으로 전해액이 소비되지 않기 때문에 전지 내부의 전해액량을 적게 하고, 활물질을 많이 충전할 수가 있다.[1]
참고자료[편집]
같이 보기[편집]
|
  이 수은전지 문서는 배터리에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요. 이 수은전지 문서는 배터리에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요.
|
| 자동차 : 자동차 분류, 자동차 회사, 한국 자동차, 독일 자동차, 유럽 자동차, 미국 자동차, 중국 자동차, 일본 자동차, 전기자동차, 자동차 제조, 자동차 부품, 자동차 색상, 자동차 외장, 자동차 내장, 자동차 전장, 자동차 부품 회사, 배터리 □■⊕, 배터리 회사, 충전, 자동차 판매, 자동차 판매 회사, 자동차 관리, 자동차 역사, 자동차 인물
|
|
|
| 배터리 종류
|
1차전지 • 2차전지 • 3차전지 • AA 전지 • AAA 전지 • HFC • LCO • LFP • LMO • LTO • NCA • NCM • NCMA • 각형 배터리 • 건전지 • 고전압 배터리 • 고체전지 • 공기전지 • 과산화은전지 • 구반반 배터리 • 그래핀 배터리 • 금속 공기 배터리 • 나노셀룰로스 종이 배터리 • 나트륨이온 배터리 • 나트륨 황 배터리 • 납축전지 • 니켈 수소 배터리 • 니켈 카드뮴 배터리 • 다이아몬드 배터리 • 단추형 전지 • 대용량 배터리 • 대형배터리 • 동위원소 배터리 • 리튬공기전지 • 리튬 망간 배터리 • 리튬메탈 배터리 • 리튬 이산화탄소 배터리 • 리튬이온 배터리 • 리튬 인산철 배터리 • 리튬전지 • 리튬 코발트 배터리 • 리튬 티타네이트 배터리 • 리튬 폴리머 배터리 • 리튬 하이니켈 배터리 • 리튬 황 배터리 • 마그네슘 배터리 • 망가니즈전지 • 모래 배터리 • 무음극배터리 • 물리전지 • 미생물 연료전지 • 바나듐 배터리 • 바나듐 레독스 흐름 배터리 • 바나듐이온 배터리 • 바빌로니아 전지 • 박막배터리 • 박테리아 배터리 • 박테리아 종이 배터리 • 반고체 배터리 • 배터리 • 베타 배터리 • 보조배터리 • 볼타전지 • 불소이온 배터리 • 블레이드 배터리 • 비축전지 • 사원계 배터리 • 산화물 전고체 배터리 • 산화은전지 • 삼원계 배터리 • 설탕 배터리 • 세라믹 축전기 • 소금 배터리 • 소형배터리 • 수소연료전지 • 수은전지 • 슈퍼커패시터 • 습전지 • 아연공기전지 • 아연 탄소 전지(르클랑셰 전지) • 아폴로 • 알루미늄 공기전지 • 알루미늄 공기 흐름 전지 • 알칼리전지 • 얼티엄 배터리 • 에너지저장장치(ESS) • 에이터너스 • 연료전지 • 열전지 • 용융염 배터리 • 원자력전지 • 원통형 배터리 • 육둘둘 배터리 • 인섀시 배터리 • 전고체 배터리 • 전지 • 종이 배터리 • 중형배터리 • 차세대 배터리 • 초소형배터리 • 축전기(콘덴서) • 축전지 • 칼륨 배터리 • 칼슘 배터리 • 커패시터 • 코인셀 배터리 • 태양전지 • 파우치형 배터리 • 파워월 • 팔일일 배터리 • 폐배터리 • 폴리머 배터리 • 폴리머 전고체 배터리 • 프리폼 배터리 • 플렉서블 배터리 • 하이니켈 배터리 • 하이브리드 리튬메탈 배터리 • 해수전지 • 핵 배터리 • 화학전지 • 황화물 전고체 배터리 • 흐름전지(레독스 플로우 배터리)
|
|
|
| 배터리 기술
|
ALD • CCS • CSG • CTB • CTV • K-배터리 • MPI • MTB • NCMX • PCM • SRS • 건식분리막 • 계면 • 계면저항 • 계면활성제 • 고용량 • 고체전해질 • 고출력 • 공랭식 • 굴곡도 • 기공 • 기억효과(메모리 효과) • 냉각시스템 • 다공성 • 대용량 • 덴드라이트 • 드라이룸 • 모듈투바디(MTB) • 무기 고체 전해질 • 바인더 • 박막 • 박막화 • 방열판 • 방열핀 • 배터리관리시스템(BMS) • 배터리데이 • 배터리모듈 • 배터리 보호회로모듈 • 배터리셀 • 배터리 케이스 • 배터리 패키징 • 배터리팩 • 배터리하우징 • 배터리 히팅 시스템 • 복합전해질 • 분리막 • 블랙파우더 • 비전해질 • 사물배터리 • 산화물 • 산화물계 전해질 • 세라믹 코팅 • 세라믹 코팅 분리막 • 셀밸런싱 • 셀투바디(CTB) • 셀투비클(CTV) • 셀투섀시(CTC) • 셀투카(CTC) • 셀투팩(CTP) • 소용량 • 수랭식 • 스태킹 • 습식분리막 • 실리콘 음극재 • 실버코팅 • 안전성 강화 분리막(SRS) • 액체전해질 • 양극박 • 양극소재 • 양극재 • 양극판 • 양극활물질 • 여과 • 열폭주 • 열화현상 • 와인딩 • 용량 • 유기 고체 전해질 • 유랭식 • 음극소재 • 음극재 • 음극판 • 음극활물질 • 이온전달막 • 이온전도도 • 이온화 • 저용량 • 저출력 • 전고체 • 전구체 • 전지박 • 전해액 • 전해질 • 전해질막 • 점프 • 점프케이블 • 정격용량 • 정격전압 • 제로모듈 • 젤리롤 • 집전체 • 출력 • 침출 • 콤퍼레이터 • 티본 레이아웃 • 파우치 • 패스웨이 • 폐양극재 • 활물질 • 황화물 • 황화물계 전해질 • 히트싱크 • 히트파이프 • 히트펌프
|
|
|
| 배터리 제품
|
1865 배터리 • 2170 배터리 • 4680 배터리 • 기린 배터리
|
|
|
| 위키 : 자동차, 교통, 지역, 지도, 산업, 기업, 단체, 업무, 생활, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|

 위키원
위키원