리튬 폴리머 배터리
리튬 폴리머 배터리(Lithium polymer batteries, 锂聚合物电池)는 폴리머(polymer) 형태의 전해질을 사용하는 리튬이온 배터리 중 하나이다. 보다 정확하게는 리튬이온 폴리머 배터리(LIPB)로 불리고 약어로 리포(LiPo), 리폴리(Li-poly), 리튬폴리(lithium-poly) 등으로 불린다. 고분자 전해질의 종류에는 고체 고분자 전해질(solid polymer electrolyte), 젤 고분자 전해질(gel polymer electrolyte), 고분자 염(polyelectrolyte) 등이 있다. 폭발성을 줄임과 동시 에너지 저장 밀도를 높이고 보통 사각형 박스 형태로 제작하지만 원하는 모형으로 가공이 가능하여 노트북, 컴퓨터나 핸드폰 같은 휴대용 기기에 널리 사용된다. 메모리 효과가 없어 완전 방전이 되지 않아도 필요할 때마다 충전해서 쓰면 된다.
개요
리튬 폴리머 배터리는 액체 전해질을 사용하는 리튬 이온 배터리(LIB)의 안전성 문제를 해결하기 위한 노력에 의해 만들어진 배터리로 그 작동원리는 리튬이온 배터리와 동일하며, 젤타입의 고분자 (Polymer)가 양극과 음극 사이의 분리막을 구성하며, 전해질의 역할까지 한다. 리튬폴리머 배터리는 이온 전도도가 우수한 고체 전해질을 사용, 액체전해질을 사용하던 배터리의 단점인 누액 가능성과 폭발 위험성이 없다는 것이 가장 큰 장점이다.
또 고체 전해질을 사용하고 있어 형상을 다양하게 설계하는 것이 가능하며 휴대기기의 면적 전체를 활용할 수 있다. 한 마디로 "종이처럼 얇고 가벼울 뿐만 아니라 어떠한 모양으로도 만들 수 있는 안전한 전지" 라 할 수 있다. 고출력 전압셀당 평균전압은 3.7V이다. 니카드전지나 니켈수소전지의 평균 전압이 1.2V이므로 3배의 Compact 효과가 있다고 볼 수 있다. 낮은 자가방전율은20˚C에서 한 달에 약 5% 미만이다. 이 수치는 니키드전지나 니켈수소전지보다 약 1/3 수준이다.
카드뮴이나 수은 같은 환경을 오염시키는 중금속을 사용하지 않아 환경 친화적이다. 정상적인 상태에서 500회 이상의 충방전을 거듭할 수 있다.[1]
종류
리튬이온 배터리의 (+)극과 (-)극 사이에는 액체로 된 전해액이 유기성인데 휘발유보다 잘 타는 물질로서 연소성이 높아 폭발의 위험성이 있다. 최근 리튜이온 전지 배터리의 자동차에서 일어나는 배터리의 화재는 대부분 전해액이 유기용매로 되어 있어 발화성이 극히 높기 때문이다. 리튬 폴리머는 전해액 대신에 고분자 물질로 채워 안정성을 높였다. 리튬이온 중합체 전지(리튬이온 폴리머 배터리, 폴리머 배터리)는 중합체(폴리머)를 사용한 리튬이온 배터리이다.
협의의 폴리머 배커리는 폴리머를 전해질로 사용한 것이다. 광의의 폴리머 배터리는 전해질 이외에 음극과 양극의 활성 물질에 전도성 고분자 등을 이용한 것이다. 고체나 젤 상태의 중합체를 전해질로 사용하기 때문에 안정성이 높고 무게도 가벼우며 제조과정도 간단하여 컴퓨터를 포함한 소형 전자기기에 사용된다.
현재 리튬 폴리머 배터리는 폴리에틸렌 그리콜(Polyethylene glycol)이나 폴리에틸렌 플로라이드(Polyethylene fluoride)으로 구성된 폴리머에 전기분해액을 포함시켜 교질화하여 리튬이온 배터리와 비슷하다. 그렇지만 전해질이 준고체상태이기 때문에 용액이 잘 새어 나오지 않는다. 타 2차전지에 비해 상당히 가볍고 메모리 효과도 매우 적다.
리튬 폴리머 전지는 음극과 양극 사이의 분리막이 리튬이온 배터리에서 전극의 분리역할 외에 이온전도의 매개체, 즉 전해질의 역할을 하는 것이다. 리튬 폴리머 전지는 전극재료 및 고분자 분리막의 종류에 따라 구분할 수 있다.
전해질에 의한 배터리 종류
리튬 폴리머 배터리는 기존 리튬이온 배터리의 양극, 전해액, 음극 중 하나에 폴리머 성분을 사용한 것이며 4가지 종류가 있다.
- 폴리머 전해질 전지 진성 폴리머 전해질 배터리
- 폴리머 전해질 전지 겔폴리머 전해질 배터리
- 폴리머 양극 전지 도전성 고분자 양극 전지
- 폴리머 양극 전지 황산 폴리머계 양극 전지
현재 양산되는 폴리머 배터리는 B.겔(GEL) 폴리머 전해질 배터리를 말하며 두가지 종류로 구분된다.
- 가교 폴리머형(진정한 의미 폴리머 배터리, 고온에서도 겔 구조 유지 가능)
- 비가교 폴리머형(폴리머 사이의 결합이 물리적인 얽힘이나 약한 수소 결합으로 겔 구조가 해체되기 쉽다. 고온에 쉽게 부푸는 특성을 가지고 있다.) [2]
특성
- 고전압 : 리튬이온 배터리와 같이 평균 전압이 3.7V로 니켈 카드뮴이나 니켈수소화금속과 같은 다른 2차전지에 비해 3배 정도 높다.
- 급속충전 : Constant-current'constant-voltage(CC/CV)방법으로 충전하는 경우 1~2시간 내에 완전 충전이 가능하다.
- 무공해 : 소재 물질 중에 환경 오염 물질인 카드뮴, 납, 수은 등이 들어있지 않다.
- 장수명 : 정상적인 조건에서 500회 이상의 충방전 특성을 보인다.
- 메모리 효과 제로 : 니켈카드뮴 배터리에서 나타나는 것과 같이 완전 충방전이 되지 않았을 때 용량감소가 생기는 현상이 없다.
- 리튬이온 대비 안정성 강화 : 셀 외부로 전해액이 누액 될 염려가 없고 폴리머 양이 상대적으로 리튬이온 배터리보다 많으므로 더 안전하다.
- 내부저항이 작음 : 전극과 격리판이 일체형으로 되어 있어 표면에서의 저항이 그만큼 줄어 들어 상대적으로 작은 내부저항을 갖는다.
- 얇은 배터리 제조 : 얇은 판상 구조를 가지고 있기 때문에 얇은 셀을 만들기 적당하며 또한 bag을 사용해 패키지하기 용이하기 때문에 얇은 배터리 제조가 가능하다.
- 유연성 : 폴리머 함량이 상대적으로 많아 전극 자체만으로도 필름의 특성을 가질 수 있다. 셀의 경우 이러한 필름적 특성으로 인해 형상의 자유도가 높다.
- 제조 형상 자연도 높음 : 리튬이온 배터리에서의 winding작업이 없고 여러 장의 필름을 겹치는 과정이 존재하므로 필름만 원하는 모양으로 자르면 원하는 모양으로 제조가 가능하다.[2]
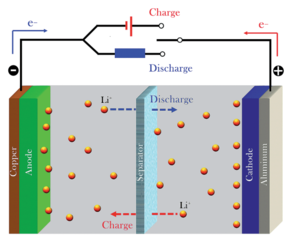
리튬이온 배터리 원리
전지가 충전, 방전을 수행할 때는 이온이 전해질 영역에서 빠른 속도로 전극 쪽으로 이동함으로써 전극 내에서의 반응속도를 결정하게 된다. 이 때 전하중성을 이루기 위해 전극에 삽입된 이온의 양이 곧 저장할 수 있는 전기에너지 양을 결정한다. 즉 전극의 소재와 이온의 종류가 실제 저장할 수 있는 전기 에너지의 양을 결정하는 주요 소제가 된다. 리튬 이온은 자연계에서 알려진 금속 중 가장 가볍고 체적 당 에너지 밀도가 높기 때문에 전지의 이온으로 사용된다. 또한 표준 환원전위가 가장 낮아 3V의 이상의 높은 기전력을 얻을 수 있어 전지의 이온으로서 효과적으로 사용할 수 있다.
양극에서 리튬 원자는 전이금속산화물과 결합된 상태이다. 충전기와 전지를 연결하면, 결합을 이루던 리튬 원자는 에너지를 받고, 결합이 깨진다. 반응성이 좋은 리튬 원자는 최외각전자를 잃으려는 경향을 가진다. 리튬원자는 최외각전자와 분리되어 리튬이온이 되고 전해질을 통해 음극으로 이동한다. 자유전자가 된 최외각 전자는 전해질을 통과할 수 없기 때문에 외부회로를 통해 음극으로 이동하여 리튬이온과 다시 결합한다. 이 때, 음극에는 그라파이트(graphite)와 같은 층상구조를 가진 물질이 있다. 음극에서 다시 결합한 리튬 원자들은 층상구조를 가진 물질과 결합하지 않고 층간에 존재한다.
배터리를 소모하는 과정은 다음과 같다. 충전되며 음극으로 이동했던 리튬 원자들은 다시 양극의 전이금속 산화물과 결합하려 한다. 이것은 리튬 원자가 전이금속산화물과 결합함으로써 더 낮은 에너지 상태(즉, 더 안정적인 상태)를 갖기 때문이다. 배터리 내의 음극에 존재하던 리튬 원자는 전자를 잃고 다시 리튬이온과 전자로 나뉜다. 리튬이온은 전해질을 통해 양극으로 이동하지만 리튬에 속박 되어있던 전자는 전해질을 통과하지 못하기 때문에 외부회로를 통해 흐른다. 이때, 외부회로에 흐르는 전기에너지가 배터리에서 소모하는 에너지이다. [3]
리튬 폴리머 배터리 전해질 종류
전해질은 이온의 전달을 용이하게 하는 역할을 하며 이온 전도도가 높은 물질이 주로 사용된다. 전해질을 액체 전해질을 사용할 경우에는 리튬이온 배터리 (Lithium-ion batteries, LIB)라 하고 고분자 전해질을 사용하면 리튬 폴리머 배터리 혹은 리튬 이온 폴리머 배터리(Lithium-ion polymer batteries, LIPB)라 부른다. 폴리머의 경우에는 액체 전해질을 사용할 때보다 폭발성에 대한 위험도가 적기 때문에 상용화가 용이하고, 제작 시 얇고 소형으로 만들 수 있어 전자기기에 두루 사용되고 있다. 특히 리튬폴리머 배터리는 무선조종항공기, 모바일 장치 등과 같이 가벼운 배터리 무게가 필요한 장치에 많이 사용된다. 리튬폴리머 전지의 전압은 구성물질에 따라 다른데, 리튬-금속산화물(예: LiCoO2)이 양극 구성 물질일 때는 2.7–3.0V에서 4.2V(완충 된 경우)까지 사용할 수 있다. 정확한 전압 정격은 제품 데이터 시트에 명시되어 있다.
액체 전해질을 사용하는 리튬이온 배터리에서는 리튬이온의 이동을 용이하게 하기 위해서 미세 기공이 존재하는 10 ~ 20μm의 폴리올레핀 분리막을 사용하기도 한다. 액체 전해질을 적용하는 리튬이온 배터리는 일반적으로 금속 캔에 포장되는데, 액체 전해질을 고분자 전해질로 대체하게 되면 외장재로 금속 캔을 사용할 필요가 없다. 따라서 전지를 가볍게 제작할 수 있고 형태에 구속도 작아지게 된다. 고분자 전해질에는 고체 고분자 전해질(solid polymer electrolyte), 젤 고분자 전해질(gel polymer electrolyte), 고분자 염(polyelectrolyte) 등이 있다.
고체 고분자 전해질은 고분자와 염으로만 구성되어있다. 고체 고분자 전해질로 사용되는 고분자는 상온에서도 고분자 사슬의 움직임이 활발하고, 염을 해리할 수 있는 산소(O), 질소(N), 황(S) 등의 극성 원소를 포함해야한다. 주로 polyethylene oxide (PEO), polypropylene oxide (PPO), polyphosphazene, polysiloxane 등의 유도체에 대한 연구가 지속되어 왔으며 PEO에 관한 연구가 활발히 진행되고 있다. 고체 고분자 전해질은 다음과 같은 장점을 가지고 있다. 먼저 음극에 리튬 금속을 사용할 수 있어 전지의 에너지 밀도를 높일 수 있다. 또한 액체가 아니기 때문에 누액의 염려가 없어 안정적이다. 또한 다양한 모양으로 전지를 제조할 수 있으며 초박막 전지 형태로도 전지를 제조할 수 있다. 만약 외부 온도가 상승하여 전지온도가 상승하여도 가연성 가스 분출이 없다는 안정성도 갖고 있다. 마지막으로 분리막 및 보호회로 등이 필요 없어 저비용으로 전지 제조가 가능하다.
젤 고분자 전해질은 고분자, 유기용매, 리튬 염으로 구성되어있다. 고체 고분자 매트릭스 내에 유기 전해액을 함침 시켜 제조된다. 외형상으로는 고체 필름상태이나, 고분자 사슬 내이 전해질이 존재하여 이온전도도가 크다. 따라서 리튬이차전지용 고분자 전해질로서 활발히 연구가 진행되어왔다. 젤 고분자 매트릭스에 사용되는 대표적인 고분자는 폴리아크릴로니트릴 (polyacrylonitrile, PAN), 폴리비닐디렌-플루오라이드 (poly(vinylidene fluoride, PVdF)가 있다. 그 외에도 폴리메틸메티크릴레이트 (poly(methyl methacrylate, PMMA), 폴리에틸렌옥사이드 (poly(ethylene oxide, PEO) 등이 있다. PAN은 극성이 큰 CN기를 보유하고 있어 리튬이온이나 용매와 인력이 강하게 작용하여 후보물질로서 많은 연구가 되었다. 상온에서 이온전도도가 높고 기계적 물성이 좋으며 양극 활물질과의 반응성이 낮다는 특징이 있다. PVdF계는 미세 기공을 갖고 있으며 미세 기공 내의 액체 전해질이 이온 전도성을 우수하게 나타낸다는 특징이 있다. PMMA계 고분자 전해질은 투명하다는 특성으로 인해 전기변색소자용 전해질로도 적용될 수 있다. 전위창이 넓어 리튬 금속에 대해 4.5 V의 값을 갖는다. 일반적으로 젤 고분자 전해질 내에서 이온은 액체를 매개로 이동하며 고분자 매트릭스는 필름의 기계적 강도와 함께 액체 성분을 저장하는 역할을 한다.
마지막으로 고분자 염이 있다. 고분자 물질 자체가 양이온, 음이온으로 구성되어 있는데 이들이 해리되어 이온전도성을 나태날 때를 고분자염이라 한다. 고분자염에서는 양이온이나 음이온만 이동할 수 있으므로 단일전도체(single ion conductor)라고도 부른다. 일반적으로 리튬염을 포함하는 고분자 전해질에는 해리된 음이온이 고분자 사슬과 상호작용을 하지 않으면서 이동할 수 있다. 고분자 염이 리튬이온 이차전지에 사용될 경우 음이온이 이동하지 않으므로 장시간 사용하여도 전해질에 대한 저항의 변화가 작으며 안정된 방전 전류를 얻을 수 있다는 장점이 있다.
리튬 폴리머 배터리는 충전, 방전을 반복할 시 배터리가 팽창하는 문제점이 있어왔다. 2009년 대한민국에 첫 출시되었던 아이폰 3GS모델의 배터리가 팽창된 모습을 보여준다. 리튬 폴리머 배터리는 과충전, 과방전, 과열, 단락, 충격 등으로 인해 파우치가 파열되거나 전해질이 누출 되고 화재가 일어나는 것과 같이 다른 리튬 이온 전지가 가지고 있는 여러 문제들과 비슷한 문제를 여전히 가지고 있다. 모든 리튬 이온 셀은 반복되는 동작에 의해 전해질이 기화되고 이로 인해 과충전을 일으켜 팽창하는 문제가 있다. 다른 배터리는 외부에 단단한 케이스가 있어 이러한 팽창을 막아줄 수 있지만 리튬이온배터리의 경우 파우치 형태의 주머니를 가지고 있기 때문에 이러한 문제가 생기면 눈에 띄게 팽창 할 수 있다. 현재에는 많은 연구와 생산성 결함을 줄임으로써 팽창과 폭발에 대한 문제를 감소시켰다. [3]
전기차 응용
- LG화학은 리튬이온폴리머 배터리를 탑재한 전기자동차를 지난 2002년 세계적인 자동차 경주대회인 '파익스 피크 인터내셔널 힐클라임 대회'에 참가시켰다.[4]
- 세계 최대의 자동차 메이커 제너럴모터스(GM)가 2010년 양산할 세계 최초의 전기자동차 쉐보레 볼트(Chevrolet Volt)에 LG화학의 리튬이온폴리머 배터리가 채택됐다.[4]
- 현대차의 하이브리드 아반떼에 리튬이온폴리머 배터리를 LG화학이 공급했다.
- SK가 개발한 전기차 전용 리튬이온폴리머 배터리가 대한민국 첫 고속전기차 블루온(Blue on)에 탑재되었다.[5]
- 코나 EV나 니로 EV에는 NCM622의 리튬 폴리머 배터리를 채용했다.[6]
- CT&T 전기차 e-ZONE도 LG화학 제작의 리튬이온 폴리머 배터리를 탑재했다.[7]
각주
- ↑ 문지기, 〈리튬폴리머전지란?〉, 《가가배터리》, 2004-08-09
- ↑ 2.0 2.1 자동차 전문 교육 자동차 역사가, 〈자동차용 리튬 폴리머 전지(Lithium polymer battery)〉, 《자동차 산업 전문 포털》, 2020-04-21
- ↑ 3.0 3.1 〈리튬폴리머 전지〉, NAVER-KPS physics dictionary,
- ↑ 4.0 4.1 권세진 기자, 〈불황시대의 성공사례 LG화학〉, 《월간조선》,
- ↑ SKinno News, 〈SK이노베이션의 배터리 역사, 제대로 알아보기 – ‘전기차 배터리’ 개발 40년의 기억③ – 배터리 근대사(近代史) – SK이노베이션 전문 보도채널 SKinno News〉, 《SK이노베이션》, 2020-10-25
- ↑ 〈전기차에게 가장 중요한 부품 배터리에 대해 알아보자〉, 《이브이포스트》, 2019-5-27
- ↑ 이상원 기자, 〈CT&T, 서울시 소방서에 LG리튬폴리머배터리 전기차 납품〉, 《M오토데일리》, 2011-02-25
참고자료
- "LiPo Battery", 《지형 공간정보체계 용어사전》
- 〈리튬폴리머 전지〉, NAVER-KPS physics dictionary
- 이상원 기자, 〈CT&T, 서울시 소방서에 LG리튬폴리머배터리 전기차 납품〉, 《M오토데일리》, 2011-02-25
- 〈전기차에게 가장 중요한 부품 배터리에 대해 알아보자〉, 《이브이포스트》, 2019-5-27
- SKinno News, 〈SK이노베이션의 배터리 역사, 제대로 알아보기 – ‘전기차 배터리’ 개발 40년의 기억③ – 배터리 근대사(近代史) – SK이노베이션 전문 보도채널 SKinno News〉, 《SK이노베이션》, 2020-10-2
- 권세진 기자, 〈불황시대의 성공사례 LG화학〉, 《월간조선》
- 자동차 전문 교육 자동차 역사가, 〈자동차용 리튬 폴리머 전지(Lithium polymer battery)〉, 《자동차 산업 전문 포털》, 2020-04-21
같이 보기

 위키원
위키원