수산화물
수산화물(Hydroxide)은 수산화 이온(OH⁻)과 양이온이 결합한 물질이다. 이때의 수산화 이온의 개수는 양이온의 개수와 같다. 물에 녹아 이온화되면 염기성 용액을 만든다. 알코올(R-OH)이나 카복실산(R-COOH)은 형태 상으로는 수산화물처럼 보이지만, 보통 수산화물에서 제외된다.
수산화물은 일반식 M¹(OH), M²(OH)₂, M³(OH)₃, M⁴(OH)₄ 등으로 표시된다. 금속의 수산화물이 가장 일반적이며, 수산화나트륨 NaOH, 수산화바륨 Ba(OH)₂, 수산화철 Fe(OH)₃ 등이 이것에 속한다. 넓은 뜻으로는 수산기를 가진 화합물을 모두 포함하지만 유기화합물에 대해서는 일반적으로 하이드록시화합물이라는 이름이 쓰인다.
보통 산화물의 수화물로 볼 수가 있으나, 이것들 중에서 염기성인 화합물만을 가리킬 때가 많다. 즉, 비금속산화물이나 어떤 종류의 금속산화물의 수화물은 산성을 보이므로 수산화물이라고 하지 않는다. 예를 들면, B₃O₃·3H₃O나 CrO₃·H₃O 등은 산의 성질을 보이므로 붕산 H₃BO₃ 또는 크로뮴산 H₃CrO₄라고 한다.
상세[편집]
수산화물은 1~4족의 금속원소들이 물(H₂O)과 반응하여, 음전하를 띤 수산화이온(OH⁻)의 염기성 염이 되는 화합물을 의미한다. 즉, 금속 원소들은 물에 녹아 수산화물을 형성시켜 수용액을 염기성으로 만들고, 이때 수소(H₂)는 증발한다.
Li + H₂O → LiOH + H₂
Na + H₂O → NaOH + H₂
K + H₂O → KOH + H₂
Be + H₂O → Be(OH)₂ + H₂
Mg + H₂O → Mg(OH)₂ + H₂
Ca + H₂O → Ca(OH)₂ + H₂
수산화물의 예) LiOH, NaOH, Be(OH)₂, Mg(OH)₂, Al(OH)₃
수산화물의 염기성 세기는 1족과 2족이 강하며, 3족과 4족은 약하다. 이러한 특성으로 1족, 2족 원소들은 자연계에서 단독원소로 존재하지 않고 수산화물 등 다른 원소들과 화합물을 이루며 존재한다.
수산화물은 염기성을 나타내는 화합물을 지칭하므로, 비금속과 물이 결합한 화합물은 산의 성질을 나타내므로 수산화물이라고 하지 않는다. 또한 아래와 같이 수산화물과 형태도 다르다.
B₂O₃ + 3H₂O → 2H₃BO₃ 에서 H₃BO₃는 붕산이라고 한다.
CrO₃ + H₂O → H₂CrO₄ 마찬가지로 H₂CrO₄는 크로뮴산이라고 한다.
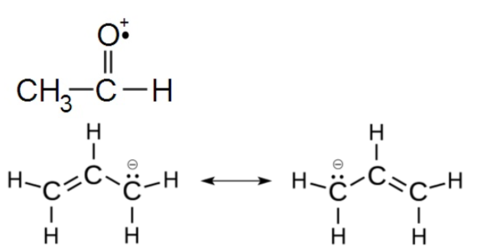
위쪽 그림의 두가지는 유사해보이지만 다른 물질로써 하나는 전자가 많고, 다른 하나는 결합하지 않은 홑전자를 가지고 있다. 이들의 기능은 구별된다. 수산화물의 수산화이온 또는 수산화이온(hydroxide ion)는 이원자음이온으로써 보통 비유기화합물의 음이온이다. -1 전하를 가지며 금속과 이온결합을 할 수 있다. 금속과 결합하여 강한 염기성을 띤다. 단독적인 형태로 발견될 수 있다.
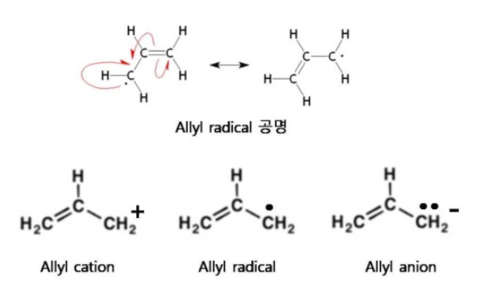
히드록실기라디칼 또는 수산기라디칼(hydroxyl radical)은 수소결합을 서로 할 수 있으며, 유기화학에서 알코올이나 카복실산 등에서 수산기를 가지고 있고, 수산기는 극성이 있으므로 물에 녹기 쉽다. 이 라디칼은 화합물과 공유결합을 한다. 자유 라디칼은 반응성이 크며 고정된 전하를 가지고 있지 않아서 이온과는 달리 중성상태이다. 라디칼은 이온과는 달리 전자가 부족한 상태이지만 전자의 수가 양성자의 수와 여전히 일치하므로 전자가 과잉이나 부족한 상태가 아니어서 전하를 이동시키지 않는다. 수산화물 이온과는 달리 단독적으로 거의 존재하지 않고 다른 분자와 결합하여 존재한다.
수산화물의 hydroxide ion(수산화이온)은 이온으로써 이온결합을 하지만, hydroxyl radical(히드록실 라디칼)은 자유 라디칼로써 공유결합을 하는 작용기의 홑전자를 가진 반응성이 큽니다. 일반적인 라디칼은 무기화합물을 구성할 수 있지만 주로 유기화합물에서 공유결합을 한다.
위의 그림은 formaldehyde radical cation으로써 라디칼이며 동시에 이온의 형태를 가지는 것도 있다. 또 allyl anion은 라디칼 및 음이온이며 공명구조를 가진다.
기존 라디칼에 대해 전자수가 더 많고 적음에 따라 양이온과 음이온 또는 라디칼양이온과 라디칼음이온이 된다.[1]
각주[편집]
- ↑ applepop, 〈[산화물(oxide)과 수산화물(hydroxide)〉, 《네이버블로그》, 2020-01-17
참고자료[편집]
같이 보기[편집]

 위키원
위키원