아세틸렌
아세틸렌(Ethyne)은 알카인 계의 탄화수소 중 가장 간단한 형태의 화합물이다. 화학식은 C₂H₂이다. 에타인이라고도 부른다. 천연으로는 존재하지 않으며, 1836년 H.데이비가 발견하고, 1892년 프랑스의 무아상이 공업화에 성공하였다.
아세틸렌은 상온에서 불안정한 무색의 가연성 기체이고 공기보다 가볍다. 연료로도 쓰이고 유기 합성에서 구축 단위(building block)로도 사용된다. 순도 100%인 아세틸렌은 냄새가 없지만, 상업용 순도의 아세틸렌은 다이바이닐 황화물(divinyl sulfide) 불순물로부터 유래한 특징적인 마늘 냄새가 난다. 아세틸렌은 밝은 빛을 내며, 연기나는 불꽃을 내며 탄다. 금속을 용접할 때 산소와 아세틸렌을 사용한다. 용접 온도는 3300°C까지 도달할 수 있다.
고농도에서 흡입 시 마취 효과가 나타날 수 있다. 산소부족으로 인한 숨 가쁨, 정신적 경계심의 감소, 근육 조정의 손상, 판단력 상실, 감각의 무뎌짐, 정신적 불안정, 피로를 일으킬 수 있다. 질식의 과정으로 구역질, 구토, 피로, 의식 상실 등이 일어날 수 있으며 심할 경우 발작, 혼수상태, 사망에까지 이를 수 있다. 임산부에게서의 산소 부족은 태아 발육에 지장을 줄 수 있다.
개요[편집]
아세틸렌은 탄소가 1개일 때는 삼중결합을 이룰 수 없으므로 탄소가 2개지만 알카인 중에서 가장 간단한 화합물이다. 알카인은 두 개의 탄소 간에 삼중결합이 하나 있는 것을 말하기 때문이다. 이성질체는 없으며, 탄화수소 중에서 수소의 개수가 가장 적다.
대기압-상온에서 기체. 조금 특이하게도 대기압하에서는 액체로 만들 수 없다. -84°C 이하의 온도에서 고체로 존재하다가 그 이상에서 바로 기체로 변한다. 즉 승화한다. 따라서 액화하려면 온도만 낮춰서는 소용이 없고, 압력을 더 가해야 한다. 1.27 기압은 되어야 하며, 이 때의 끓는 점은 -80.8 °C.
무색이며, 원래는 냄새가 없지만 상용으로 팔리는 것은 불순물 때문에 특유의 냄새가 있다.
예전에는 카바이드, 정확히는 칼슘 카바이드(CaC₂)에 물을 부어 아세틸렌을 생산했었다. 요즘은 메테인을 일부 연소시켜 나머지 메테인을 아세틸렌으로 변환하거나, 에틸렌을 얻기 위해 탄화수소를 크래킹하는 과정에서 부산물로서 생산된다.
순수한 아세틸렌은 독성이 별로 없지만, 공업용 카바이드에 물을 부어 만든 아세틸렌은 불순물이 섞여 있어 유독할 수 있다. 바나나나 특히 홍시를 후숙시키기 위해 도매상인 / 중간상인들이 카바이드를 쓰는 경우가 있으므로 홍시는 잘 씻은 후 껍질까지 까서 먹는 것이 좋다. 참고로, 후숙에는 기본적으로 에틸렌이 사용되지만, 아세틸렌도 비슷한 효과를 낼 수 있다.
공기 또는 산소와의 혼합물은 폭발하기 쉬우므로 취급할 때 주의해야 한다. 폭발한계는 2.5 ~ 81% 이다. 상온에서는 거의 같은 부피의 물에 용해되고 알코올 ·벤젠 ·아세톤 등에도 녹는다. 특히 아세톤에는 잘 녹으므로, 규조토에 스며들게 한 아세톤에 가압하여 녹이고, 용기로 운반한다. 삼중결합을 가지므로 첨가반응을 잘 일으키며, 물 ·염화수소 등과반응시키면 아세트알데히드 ·염화비닐 등이 생긴다.
또, 아세틸렌의 수소원자는 다른 탄화수소보다 산성이 강하여, 아세틸리드라고 하는 금속염을 생성한다.
구조[편집]
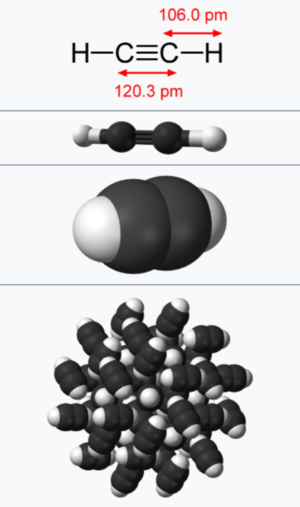
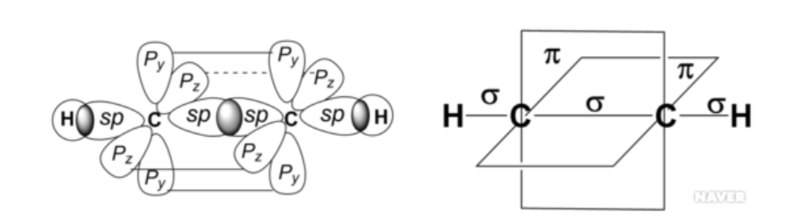
아세틸렌에서 각각의 탄소는 2s와 한 개의 2p 오비탈이 혼성하여 sp 혼성 오비탈을 가지고 있어서, 결합각은 180°이며 대칭인 화합물이다. 탄소와 탄소는 한 개의 시그마 (σ) 결합과 두 개의 파이 (π) 결합을 하여, 탄소-탄소 삼중 결합 구조를 유지하며, 결합길이는 120.3 pm 이다. 아세틸렌의 탄소에 존재하는 또 다른 sp 오비탈은 수소의 1s 오비탈과 시그마 결합을 하고 있으며 결합 길이는 106 pm이다.
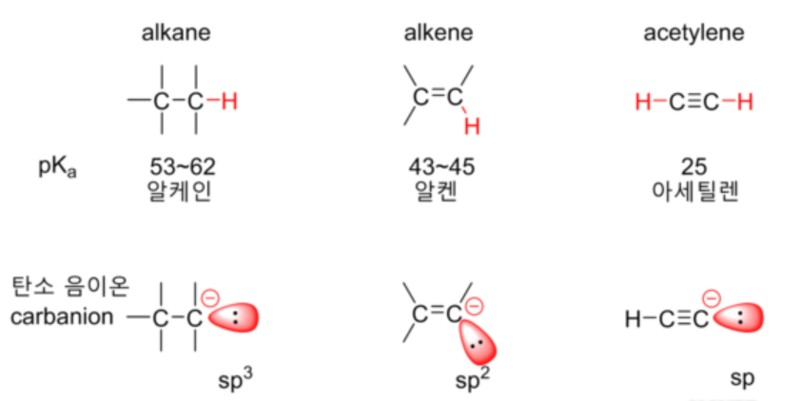
아세틸렌의 탄소가 sp 혼성 오비탈을 가지고 있기 때문에 알켄(sp²)이나 알케인(sp³) 탄소에 비해 s 성격이 높다(50%>33%>25%). 탄소 혼성 오비탈의 s 성격이 더 높을수록 전자가 핵에 그만큼 더 가까이 있다는 것이고, 따라서 생성된 아세틸렌의 탄소 음이온이 핵과의 정전기 작용에 의해 훨씬 더 안정화될 것이며, 결국 산성도는 알카인>알켄>알케인 순서라는 것을 알 수 있다. 따라서, 아세틸렌의 탄소-수소 결합은 상당히 산성을 띄며, pKa는 25이다.
역사[편집]
아세틸렌은 1836년 데이비(Edmund Davy)에 의해 발견되었으나, 1860년에 프랑스 화학자인 버텔롯(Marcellin Berthelot)에 의해 처음으로 아세틸렌(acétylène)이라고 불렸다. 그때 당시에는 탄소의 원자 질량을 6이라고 알고 있어서, 아세틸렌의 실험식(empirical formula)을 C₄H₂ 라고 제안하였다. 버텔롯은 사이아노젠(cyanogen)과 수소 기체 혼합물에 전기 스파크를 가하거나, 수소가 탄소 아크(carbon arc) 장대 사이를 통과하면 아세틸렌이 생성된다는 것을 발견했다.
1892년 프랑스의 무아상이 공업화에 성공하였다.
1900년대 초반에는 조명용 연료로 많이 쓰였었다. 그리고 초창기 자동차의 헤드라이트용으로도 쓰였었다. 우리나라에서는 일제강점기 말기에는 버스의 연료로 쓰였고, 가까운 과거까지도 포장마차 등등의 조명으로 많이 쓰였다. 칼슘 카바이드는 물과 반응하여 아세틸렌을 발생시키는데, 이를 이용하여 촛불 비슷한 것을 만들어 쓴 것이다. 즉, 카바이드를 밀폐된 통에 담고, 통 윗부분에 구멍을 뚫어 쇠로 된 대롱을 꽂은 후, 통에 물을 붓는 구조였다. 물과 카바이드가 반응하여 아세틸렌이 발생되고, 이는 대롱을 통해 나오게 되어 있어서 여기에 불을 붙여 조명용으로 쓰는 것이었다. 현재까지도 조명으로서의 용도가 명맥을 유지하고 있어서, 카바이드를 사용한 휴대용 램프가 야외용으로 간간이 쓰이곤 한다.
성질[편집]
상온에서 무색 무취의 기체상태로 존재하며, 비중은 공기가 1일 때 0.9057이다. 녹는점은 -81.5°C, 끓는점은 -84°C이며 임계온도는 36.5°C, 입계압력은 61.6atm이다. C≡C 결합 길이는 1.20Å, C-H 결합 길이는 1.06Å이다. 생성열은 50kcal이며 연소열은 312.9kcal이다. 물과 알코올에는 보통정도로 녹으며, 아세톤에는 특별히 잘 녹는다. 공기 중에서 태울 경우 그을음을 내며 탄다. 연소 시에 매우 많은 열을 내놓기 때문에 용접 등 높은 온도가 필요한 작업에서 주로 사용된다.
화학적 성질[편집]
아세틸렌의 삼중 결합에는 다량의 에너지가 포함되어 있어, 반응성이 풍부하다. 아세틸렌과 관련된 반응으로는 다음과 같은 것이 있다.
- 염소와 반응하여 1,1,2,2-테트라클로로에테인, 1,2-다이클로로에테인 등과 같은 화합물을 생성한다.
- 브로민과 반응하여 1,1,2,2-테트라브로모에테인, 1,2-다이브로모에테인 등과 같은 화합물을 생성한다.
- 염화 수소, 브로민화 수소, 아이오딘화 수소와 반응하여 각각 1,1-다이클로로에테인, 1,1-다이브로모에테인, 1,1-다이아이오도에테인을 생성한다.
- 황산 수은 등의 촉매 존재 하에 물과 반응하여 아세트알데하이드를 생성한다.
- 촉매 존재 하에 수소와 반응하여 에틸렌이나 에테인을 생성한다.
- 나트륨과 반응하여 C₂HNa, C2Na₂등의 화합물을 생성한다.
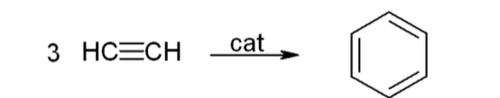
- 아세틸렌 3분자가 중합되면 벤젠이 만들어진다. 반응식은 다음과 같다.
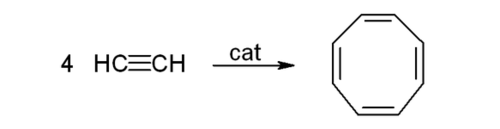
- 아세틸렌 4분자가 중합되면 사이클로옥타테트라엔이 만들어진다. 반응식은 다음과 같다.
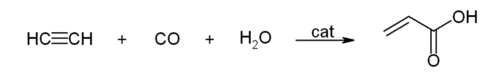
- 아세틸렌과 일산화탄소가 촉매 존재 하에 물과 반응하면 카복실산이 만들어진다. 반응식은 다음과 같다.
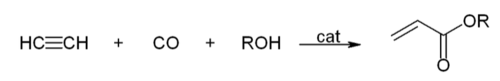
- 아세틸렌과 일산화탄소가 촉매 존재 하에 알코올과 반응하면 CH₂=CHOOR형태의 에스터를 얻을 수 있다. 반응식은 다음과 같다.
합성[편집]
- 탄화 칼슘의 가수분해 : 1950년대까지 화학 산업에서 아세틸렌과 콜타르로부터 생산된 방향족 화합물이 유기 화합물의 주요한 원료로 사용되었다. 물과 탄화 칼슘(calcium carbide; CaC₂)이 반응하면 아세틸렌 기체와 탄산 칼슘(calcium carbonate) 슬러리가 생성되는데, 이 반응은 1862년에 요소 합성법을 개발한 독일 화학자인 뵐러(Friedrich Wöhler)에 의해 발견되었다.
CaC₂ + 2H₂O → Ca(OH)₂ + C2H₂
- 탄화 칼슘은 전기 아크로(electric arc furnace)를 이용하여 2000 °C에서 생석회(lime; CaO)의 탄환원법(carbothermal reduction)에 의해 생성할 수 있고, 생석회는 900~1000 °C에서 석회암(limestone; CaCO₃)의 이산화 탄소 이탈 반응에 의해 생성된다.
- 메테인의 부분 연소 : 1950년대 이후 아세틸렌은 대부분 메테인의 부분 연소에 의해 합성되었다. 이 방법으로 1983년에 40만톤 정도가 생산되었다. 또한, 탄화수소의 크랙킹으로부터 얻은 에틸렌에 부산물로 아세틸렌이 존재하는데, 아세틸렌의 폭발성과 지글러-나타(Ziegler-Natta) 촉매의 역할을 무력화시키는 성질 때문에 제거가 필요하며, 보통 팔라듐-은 촉매를 이용하여 수소화 반응하여 에틸렌으로 전환시킨다.
반응성[편집]
- 아세틸라이드 : 알칼리 금속과 반응하여 수소 기체를 발생시킨다. 보통 아세틸렌의 수소는 pKa가 25이므로, NaNH₂ (sodium amide)나 LDA (lithium diisopropylamide)와 같이 짝산의 pKa가 25보다 더 큰 염기로 탈 양성자화(deprotonation)할 수 있고, 이때 생성된 음이온은 친핵체(nucleophile)로 사용될 수 있으며, 보통 아세틸라이드(acetylide)라고 부른다. 친핵성인 아세틸라이드로부터 다양한 아세틸렌 유도체를 합성할 수 있다.
- 레페 화학(Reppe chemistry): 독일 화학자인 레페(Walter Reppe)는 1928년부터 아세틸렌 반응 연구를 시작하였는데, 아세틸렌이 금속 촉매 하에 반응하면 공업적으로 중요한 다양한 화합물을 합성할 수 있다는 것을 발견하였다.
- 바이닐화 반응(vinylation): 아세틸렌이 구리와 같은 금속 촉매 하에 알코올, 사이안화 수소(HCN), 염화 수소(HCl)와 반응하여 각각 바이닐 에터(vinyl ether), 아크릴로나이트릴(acrylonitrile), 염화 바이닐(vinyl chloride) 등을 합성하는 반응이다.
- 알데하이드의 에타인일화 반응(ethynylation of aldehyde): 아세틸렌이 촉매 하에 알데하이드와 반응하여 알파-에타인일 알코올(alpha-ethynyl alcohol)을 합성하는 반응이며, 1,4-뷰타인다이올(1,4-butynediol)의 공업적 생산 방법이기도 하다.
- 일산화 탄소와의 반응 : 아세틸렌이 촉매 하에 일산화 탄소와 물과 반응하여 아크릴산(acrylic acid)을 합성하는 반응이다. 반응 조건에서 물을 알코올로 바꿀 경우 아크릴산 에스터를 합성할 수 있다.
- 고리형 중합 반응(cyclic polymerization): 세 개 또는 네 개의 아세틸렌 분자를 촉매 하에서 반응시켜 각각 벤젠 또는 사이클로옥타테트라엔(cyclooctatetraene)을 합성하는 반응이다.
참고자료[편집]
같이 보기[편집]

 위키원
위키원